A nem gyógyuló, krónikus sebek kezelése folyamatosan növekvő gondot jelent, a sebek növekvő száma, és a gyakran halálos kimenetelű szövődmények miatt. A krónikus sebek ellátása jelentősen megterheli az egészségügyi költségvetést. Figyelembe kell venni, hogy a bőrön különböző baktériumok közösségei élnek, amelyeknek microbiom az elnevezése. Ezek a baktérium közösségek védik a bőrt a patogén baktériumok károsító hatásától és támogatják a szervezet immunválaszát a kórokozókkal szembeni védekezésben. A krónikus sebeken kialakulhat polimikróbás biofilm, amely megakadályozza a sebgyógyulást. A biofilmben a baktériumok egy extracellularis polymer matrixba vannak ágyazva, amely biztosítja a védettséget és a rezisztenciát a szervezet immunhatásaival és az anti - biotikumokkal szemben. A baktériumok a biofilmben egymással kapcsolatot tartanak. A mechanizmus neve quorum sensing (QS), amely által biztosítják túlélésüket az antimikrobiális hatásokkal szemben. A biofilm meg - szüntetésére, a hatékony, szakszerű kezelés, elsősorban a következetes sebtisztítás, a debridement és a Aqua- Clear technologiát megvalósító sebfedők alkalmazása.
Érbetegségek: 2018/4. 123-129. oldal
KULCSSZAVAK
mikrobiom, krónikus sebek, biofilm, antibiotikum stewardship, innovatív sebkezelés
Bevezetés
A fiziologiás sebgyógyulás olyan többlépcsős, összetett folyamat, amelyet az elpusztult szövetek helyreállítását szolgáló immunrendszer szabályoz. A szervezet helyreállító reakciójának legfontosabb elemei, a fehérvérsejtek, amelyek a szövetpusztulás helyére áramlanak. A gyulladás sejtjei enzimeket termelnek, amelyek pusztítják a mikróbákat és az elhalt szöveteket, majd felfalják és elszállítják az elhalt szöveteket és a fertőzést előidéző kórokozó mikróbákat. Amikor ez megtörtént, akkor a gyulladásos sejtek vándorlása megszűnik, leáll a gyulladást szabályozó citokin produkció, mert már nincs szükség a gyulladás fenntartására, az idegen anyagok elpusztítására.
Az immunfolyamatoknak ez a szabályozása (regulációja) gátolja, hogy újabb fehérvérsejtek vándoroljanak a seb területére, amelyek a gyulladás elhúzódását okozzák. A fiziológiás, "normál" sebgyógyulás esetén az immunreguláció következtében nem alakul ki krónikus gyulladás. Olyan sejtek jelennek meg, amelyek a szövetek újraképződését elősegítő, "növekedési faktorokat" termelnek. Megindulhat az elpusztult szövetek (erek, kötőszöveti rostok, hám) újraképződése, lehetővé válik a sebgyógyulás.
Krónikus, nem gyógyuló sebek
A fiziológiás sebgyógyulást a hosszan fennálló, megszűnni nem akaró, krónikus gyulladás akadályozza, ezáltal kialakul a nem gyógyuló, krónikus seb.
Ennek az az oka, hogy az elhalt szövetek, baktériumok eltávolítása nem történik meg. Az elhalt szövetek és a fertőzést okozó kórokozók folyamatosan jelen vannak, és a gyulladást okozó fehérvérsejtek folyamatosan vándorolnak a seb területére. Ezért a gyulladás folyamatosan fennmarad. A gyulladásos faktorok, a sejtek vándorlását előidéző citokinek túlprodukciója jön létre, a sejtek működése "kicsúszik" az immunrendszer ellenőrzése alól.
A gyulladásos folyamatok ellenőrízetlensége (dysregulációja) következik be, a gyulladás krónikussá válik. "Citokin vihar" alakul ki, amely az egész szervezetet fenyegeti → a fertőzés szisztémássá válik → szepszis keletkezhet. A folyamatosan fennálló gyulladás sejtjei, olyan enzimeket termelnek, amelyek roncsolják a sejteket, a baktériumok elszaporodva pusztítják a szöveteket → a seb állapota folyamatosan súlyosbodik, állapotromlás van? nincs sebgyógyulás → szövődmények keletkeznek. A gyulladás elhúzódásának, krónikussá válásának az az oka, hogy külső és belső okok fenntartják a gyulladást (a fehérvérsejtek felszaporodását és a gyulladásos faktorok termelődését).
A krónikus gyulladást előidéző tényezők
- Elhalt sejtek - nekrotikus szövetek;
- A szervezet saját belső, kóros folyamatai un. intrinsic faktorok- különböző betegségek pl. daganat, cukorbetegség, veseelégtelenség, májbetegség, haematologiai betegségek, autoimmun folyamatok, perifériás keringési zavar, stb., amelyek negatívan befolyásolják a szervezet immun - folyamatait, ezáltal akadályozzák a sebgyógyulást;
- Külső okok, un. extrinsic faktorok ? a legfontosabb elem a fertőzés, amelyre a lehetőséget részben a sebgyógyulás kezdeti fázisában kialakult fertőzésre adott elégtelen védekezési válasz (immunválasz) adja. A krónikus gyulladást a külső, folyamatosan ismétlődő fertőzések tartják fenn.
A krónikus sebekben kialakulnak baktérium közösségek, amelyet biofilmnek neveznek. A biofilm súlyosbítja a fertőzést és hátráltatja a sebgyógyulást. Ennek oka a proteasek jelenléte és a krónikus seb területén kialakult immunsuppresszió. Fontos, hogy a biofilm rezisztens az antibiotiumok és az antimikrobialis szerek hatására. A sebkezelésben ki kell dolgozni a hatékony kezelési stratégiát a biofilm elpusztítására, és az ismételt kialakulás megelőzésére. A közlemény célja összefoglalni a biofilm jellemzőit, hatását a sebgyógyulásra, és a biofilm hatékony kezelését.
Mi a mikrobiom?
A mikrobiom az emberi testben élő kommenzalista (az egyik fél számára előnyös, a másik számára közömbös), szimbionta és patogén mikroorganizmusok alkotta ökológiai rendszer. A mikrobiom a mikrobák (mikrobioták) összessége, amelyek velünk, bennünk, rajtunk élnek, táplálnak, védenek, valamint időnként ártalmassá válnak. Az emberi szervezetet a humán sejtekből összeállt szövetek és szervek alkotják, olyan szerveződést követve, amelyben közös ökoszisztémát alkotnak a szervezetünkben élő mikrobákkal, azaz a mikrobiommal. Az ide tartozó baktériumok, vírusok, gombák részt vesznek az emberi szervezet integritását biztosító határok védelmében, nélkülözhetetlen anyagokat állítanak elő és megakadályozzák idegen (és betegséget okozó) mikro organizmusok tartós megtelepedését.
A krónikus sebek kialakulása együtt jár a mikrobiom ökoszisztémájának a megbomlásával, a bőrön, a seb- környéken és a sebben kialakult kóros baktérium közösségek kialakulásával.
A biofilm kialakulása
A baktériumok általában planktonikus (egyedi sejt) formában találhatóak. A planktonikus baktériumokat a gazdaszervezet antitestjei, fehérvérsejtjei és az antibiotikumok elpusztítják. Csak a planktonikus formában létező baktériumok ellen hatásosak az antimikrobialis szerek (fertőtlenítők) és az antibiotikumok. A biofilm egy olyan komplex mikrobiológiai közösség, amely baktériumokból és esetenként gombákból áll.
Sok baktérium ismert tulajdonsága, hogy képes olyan molekulákat kibocsátani, amelyek diffundálva kapcsolatot létesítenek más baktériumokkal. Ennek a folyamatnak a neve quorum sensing (QS), amely által a baktériumok egymással kommunikálnak és az interakció révén, mint "multicellularis kolonizáció" működnek. Virulenciájuk és pathogenitásuk ezáltal fokozódik.
A leggyakoribb biofilm képző baktériumok a methicillin rezisztens Staphylococcus aureus (MRSA), Staphylococcus epidermidis és a Pseudomonas aeruginosa.
A kórokozók az általuk termelt, extracelluláris polimer anyagokba (extracellular polymeric substance, EPS) ágyazódva helyezkednek el. Ez sejten kívüli DNS-ből, fehérjékből, polysaccharidokból áll. Ez az EPS a mikrobákból álló közösséget az adaptív rezisztencia követeztében ellenállóvá teszi az antibiotikumok hatásával szemben. A biofilm alapú krónikus bakteriális fertőzések rendkívül ellenállónak bizonyulnak a kezelésekkel szemben. A biofilm kialakulását jelentősen elősegíti a nem megfelelő indikációban és elégtelen dózisban adott antibiotikum kezelés.
A biofilmre jellemző, hogy folyamatosan változik. Általában polimikrobás közösség, ami különböző specieseket tartalmaz. Ennek következtében a baktérium fenotípus változáson megy át, melynek során génjeik szabályozása megváltozik. A biofilm (biohártya) bakteriális jellemzői súlyos veszélyt jelentenek krónikus fertőzésekben, elhúzódó sebgyógyulásban, antibiotikum rezisztenciában. Megszüntetése időt és szakértelmet igényel, jelentős egészségügyi költségekkel társul.
A biofilm jelentőségének felfedezése 1970-ben megérttette, hogy a baktériumok synergista kapcsolatot képesek kialakítani, hogy elősegítsék a túlélésüket azáltal, hogy a baktériumok közössége az egyes baktériumokra jellemző egyedi tulajdonságokat egyesíti a biofilmben. A sejtek ebben az aggregációban (biofilm) különböző fiziológiai és metabolikus tulajdonságokkal rendelkeznek, amelyek szerepet játszanak a továbbélésükben és eltérnek a planktonikus formától. A molekuláris biologia segített a biofilm komplexitásának felismerésében. A krónikus sebek 60%- ában kialakul a biofilm. A biofilm kialakulását sok faktor befolyásolja: a seb etiologája, a sebképződéshez társuló alapbetegségek (pl. cukorbetegség, vesebetegség, májbetegség, daganat, stb.) a seb elhelyezkedése, és a kezelés módja. A sebeken kialakuló fertőzések pontos meghatározásához szükséges a baktériumok azonosítása és a hatékony antibiotikumok meghatározása. Biofilm kialakulhat élettelen felszíneken is pl. implantátumokon, katéteren, kontaktlencsén, intrauterin eszközökön, stb.
Hogyan alakul ki a biofilm?
1. stádium: reverzibilis állapot. A mikroorganizmusok szabadon mozognak és egyesével (planktonikus formában) fordulnak elő. Azonban ezek az egyedi baktériumok rátapadnak a felszínekre és a kolonizáció folyamán kialakíthatják a biofilmet. Ez a kezdeti letapadás visszafordítható (reverzibilis). 2. stádium: állandósult felületi megtapadás. A baktériumok osztódnak, differenciálódnak, megváltozik a gén expressziós tulajdonságuk, ami a túlélésüket segíti. Ez a baktériumok egymás közötti kommunikációjának köszönhető, aminek a megjelölése: quorum sensing (QS). 3. Stádium: nyákos, védő matrix kialakulása: biofilm. Ahogy a baktériumok megtapadnak a sebalapon, meg kezdődik a protektív matrix szekréciója, amit extracelluláris polymer substance-nak neveznek (EPS). Ebben a nyákos protektív matrixban vannak beágyazódva a baktérium kolóniák. Az EPS összetétele a jelenlévő mikro organizmusok szerint különböző, de általában polysaccharidákat, fehérjéket, glikolipideket és bakteriális DNS-t tartalmaznak. A bakteriális DNS az élő vagy elhalt baktériumokból származik. A kiválasztott proteinek és enzimek segítik a biofilm megtapadását a sebalapon. Az érett biofilm folyamatosan bocsát ki planktonikus baktériumokat, mikrokolóniákat, biofilm fragmentumokat, amelyek szétszóródva új helyeken tapadnak meg a sebalapon, ezáltal létrehozva új biofilm kolóniákat. A biofilmben lévő mikroorganizmusok tovább viszik az új telepekbe azokat a képességeket, amelyekkel a túlélésük biztosított és képesek ellenállni antimikrobiális szereknek és antibiotikumoknak (1. ábra).
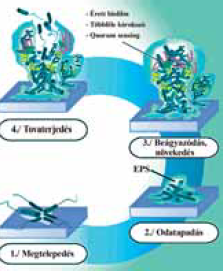
1. ábra.
A biofilm kialakulás folyamatának négy állomása.
Milyen gyorsan alakul ki a biofilm?
A laboratóriumi körülmények között vizsgált planktonikus baktériumok pl. Staphylococcusok, Streptococcusok, Pseudomonas, Escherichia coli:
- néhány perc alatt megtapadnak,
- mikrokolóniák létrejönnek 2-4 óra múlva,
- az EPS kialakul 6-12 óra múlva, ami védi a kolóniákat az antibiotikumok, antimikrobiális szerek, fertőtlenítők ellen,
- érett biofilm kolóniák, melyek kibocsátanak planktonikus baktériumokat, és rezisztensek az antimikrobás szerek ellen, 2-4 nap alatt,
- a kolónia mechanikus károsítása után ismételt biofilm képződés 24 óra alatt.
Ezek az adatok megerősítik azt a megfigyelést, hogy a seb tisztítását, debridementet folyamatosan kell végezni a biofilm újraképződésének megakadályozására.
Kritikus kolonizáció
A bakteriológiai vizsgálattal nem dönthető el a biofilm képződés lehetősége. A kritikus kolonizáció elnevezés klinikai fogalom és arra utal, hogy a baktériumok magas számuk miatt, kritikus szerepet játszanak a sebgyógyulás akadályozásában.
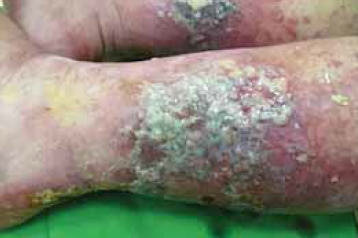
2. ábra.
A biofilm sárgás-fehér színű, felszíne fényes, zselészerű.
Klinikailag felismerhető a biofilm
A biofilm mikroszkopikus struktúra, de klinikailag felismerhető. Sárgás-fehér színű, zselészerű, felszíne fénylő (2.ábra). A biofilm összefüggő réteget képez a seben. A seb környékén egyes esetekben kékes-fekete elszíneződés van (3. ábra), amely a súlyos toxikus hatás következtében kialakult érelzáródásra utal a dermis alsó harmadában és a fascia területén (nekrotizáló fasciitis). A biofilm leválaszthatatlanul a sebalapra tapad. A biofilm kialakulásában résztvevő számos baktérium a fenotipusának megfelelően pigmentet termel, mely rá jellemző pl. Pseudomonas aeruginosa piocianint termel, ami zöldes színű (4. ábra).
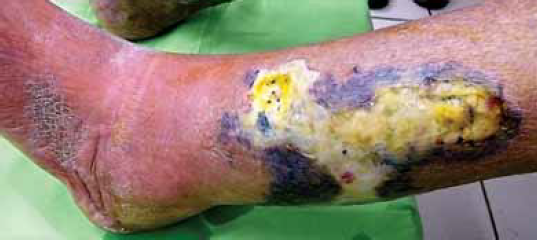
3. ábra.
A seben összefüggő réteget képező sárgás színű biofilm nem leválasztható. A seb környékén a kékes-fekete elszíneződés a fascia ereinek toxikus hatásra bekövetkezett elhalására utal (nekrotizáló fasciitis).
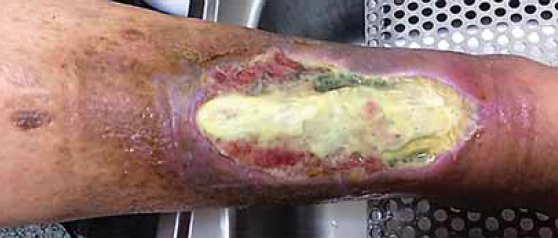
4. ábra.
A biofilmben számos baktérium, fenotipusára jellemző pigmentet termel, pl. a Pseudomonas aeruginosa piocianint, amely zöldes színű.
A biofilm masszát csak mechanikusan, szike és csipesz segítségével lehet megbontani és eltávolítani a sebalapról (5. ábra). A gennyes váladék és a fibrines lepedék klinikailag elkülöníthető a biofilmtől. A gennyes felrakódás általában sárgás, átlátszatlan, viszkózus, letörölhető. A lemezes szerkezetű fibrin lepedék megbontható és csipesszel egyszerűen leválasztható, leemelhető a sebalapról (6. ábra). A fibrinlepedék eltávolítása után előtűnik a granulációs sebalap (7. ábra).
Hogyan "védi" a biofilm a baktériumokat?
A biopolymerbe, az EPS matrixba ágyazott baktériumok védelmet kapnak a szervezet immunszisztémájával, az antimikrobiális szerekkel, az antibiotikumokkal és a környezeti hatásokkal (oxigén limitáció, táplálékigény, kémiai behatások) szemben. Ez a védelem lehetővé teszi a túlélésüket, szemben a planktonikus állapottal. Az EPS ugyanis nem engedi át az immunglobulinokat, antibiotikumokat, és antimikrobiális szereket. A biofilm ellenáll az antibiotiumok hatásának és az immunologiai behatásoknak is.
A fő kezelési stratégia a mikróbás fertőzések ellen az antibiotikumok használata (antibiotikum stewadship), amely az adaptive rezisztencia következtében, gyakran elégtelen az infekciók megszüntetésére. A kulcsszereplő, amely védi a baktériumokat a veleszületett (innate) immunrekcióktól, egy un. rhamnolipid, amely a quorum sensing (QS)-t reguláló virulencia faktor. A QS egy sej-sejt szignalizáló mechanizmus, amely koordinálja a virulencia faktort és az aggregált sejteket a biofilmben. A rhamnolipidek ismert képessége, hogy hemolysist okoznak és bizonyított, hogy különböző, az immunrendszerhez tartozó sejtek lysisét, pl. a phagocytáló macrophagok és polymorphonuclearis leukocyták károsodását okozzák (1, 2, 3). A gátolt működés miatt elmarad a baktériumok bekebelezése és elpusztítása. Ez is szerepet játszik a baktériumok túlélésének és szaporodásának biztosításában.
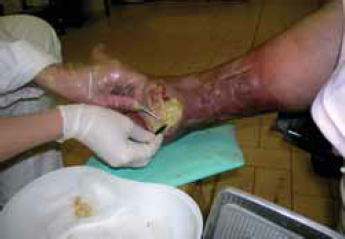
5. ábra.
A biofilm masszát mechanikusan ? szike és csipesz segítségével ? kell megbontani és fokozatosan eltávolítani.
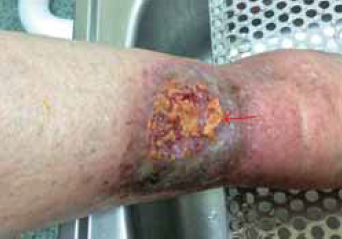
6. ábra.
A biofilmtől a lemezes fibrin lepedék elkülöníthető (nyíl), csipesszel leválasztható vagy letörölhető a sebalapról.
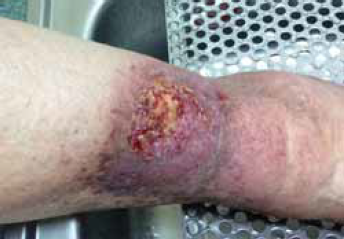
7. ábra.
A fibrines felrakódás leválasztása után, láthatóvá válik a sebalapon az élénkvörös granulációs szövet.
A baktériumok kölcsönös védelme a biofilmben
A polimikrobás biofilmben a baktériumok közötti együttműködés azáltal is érvényesül, hogy az antibiotikum rezisztens baktérium protektív enzimet, vagy antibiotikumot kötő proteineket termel, ami a szomszédos, nem antibiotikum rezisztens baktériumokat megvédi a biofilmben. A közösségben lévő baktériumok egymásnak átadnak olyan géneket, amelyek kialakítják az antibiotikum rezisztenciát a biofilmben együttélő baktériumokban. Ez a különböző speciesek között is megtörténik. A kutatások bizonyították, hogy az egyik baktérium species által kialakított EPS képes lehetővé tenni egy másik species számára is, hogy a biofilm matrixába beépüljön (4).
Hibernáció
A baktériumok egy másik túlélési stratégiája, hogy leállítják az anyagcseréjüket, azaz hibernálják magukat. Mivel a baktériumnak aktív metabolizmust kell mutatnia, ahhoz, hogy az antibiotikumok elpusztíthassák őket, a hibernált baktériumokat, a biofilmben az antibiotikumok nem tudják elpusztítatni, olyan dózisban sem, ami egyébként az aktív baktériumokat elpusztítaná. Ebből azt a gyakorlati következtetést kell levonni, hogy a biofilmben lévő baktériumokra a laboratóriumi körülmények között meghatározott hatékony anti - biotikumok nem hatásosak.
Miért késlelteti a sebgyógyulást a biofilm?
A fehérvérsejtek közé tartozó neutrophil granulocyták, phagocyták a veleszületett immunrendszer részeként a szervezet első védelmi vonalához tartoznak. A biofilm jelenléte folyamatosan fennálló gyulladást, kemokinek felszabadulását, a granulocyták aktivitását befolyásolják, fokozódik a baktériumok phagocytozisa. Ezek a gyulladásos sejtek nagy mennyiségben választanak ki reaktív oxigén gyököket (ROS), és proteolitikus enzimeket: elastase, katepszin G, urokinase típusú plasminogén aktivátor, myeloperoxidáz valamint a matrix metalloproteinasekat - MMPs (MMP-8 és MMP-9) is. A ROS és a proteasok károsítják a seb körüli szöveteket, a matrix proteineket, az immunsejteket, és ezáltal késleltetik a sebgyógyulást. A nem gyógyuló sebekben a MMPs mennyisége megnövekedett. A biofilm és a nekrotikus szövetek eltávolításával csökken a gyulladás, a proteolitikus enzimek és az MMPs produkció.
Vannak-e olyan hatások, melyek elősegítik a biofilm kialakulását?
Ismert, hogy olyan állapotok, melyek károsítják az immunrendszert, vagy csökkentik az antibiotikumok hatását (microcirkulációs zavar, necrosis) elősegíthetik a biofilmek kialakulását. Pseudomonas aeruginosa, gram-negativ patogén baktérium, amely jelentős szerepet játszik a sebfertőzések kialakulásában, különösen jelentős szerepe van immungyengeségben szenvedő betegek esetében. A biofilmet alkotó microorganizmusok rezisztenssé válnak az ismert antimikrobialis szerekkel szemben, ami ezeket a fertőzéseket életveszélyessé teszi. A vizsgálatok azt bizonyították, hogy az interakció Staphylococcus aureus és a Pseudomonas aeruginosa között, fontos faktor a kolonizációban és a biofilm kialakulásban (5, 6, 7).
Antibiotikum stewardship
A krónikus sebek ellátásában nagyon gyakori a hibásan alkalmazott szisztémás antibiotikum alkalmazás. Ez a gyakorlat az utóbbi években növelte a rendelkezésre álló antibiotikumok (AB) ellen a baktériumok rezisz - tenciáját. A baktériumok képesek a fenotipus meg - változtatására, és biofilmnek nevezett koloniákat hoznak létre a sebeken. Az egyes fajok szinergista hatása követ - keztében nem reagálnak az AB-ra. Az AB politika helyett inkább az ?antibiotikum stewardship? fogalom használatos, ami az antimikrobás gyógyszerekkel történő kezelési elveket foglalja magában. Az AB megfelelő használata azt jelenti, hogy költséghatékony, abban az értelemben, hogy a használt AB maximálisan hatékony, minimális a toxicitása és a baktérium rezisztencia. A stewardship célja: az AB rezisztencia terjedésének megakadályozása, a beteg állapotának javítása, elősegíteni az életben maradási esélyeit, költségcsökkentés. Az ?antibiotikum stewardship? legfontosabb javaslatai a krónikus sebek antibiotikum kezelésében a következők (8):
- csak szisztémás tüneteket mutató esetben használandó szisztémás antibiotikum;
- mikrobiologiai vizsgálat szakszerűen vett mintából történjen;
- figyelembe kell venni a pharmakokinetikai/pharmakodinamikai folyamatokat;
- a célzott antibiotikum a lehető legszűkebb spektrumú legyen és hatásos a Staphylococcus aureus és Streptococcus beta-haemolyticus ellen;
- antibiotikum kombinációk alkalmazása specifikus helyzetben;
- a kolonizáció és a fertőzés elkülönítése. Iránymutató a kvantitatív mikrobiologiai vizsgálat: infekció esetén a mikroorganizmusok száma 105/g;
- meg kell akadályozni az önkezelést (már meglévő antibiotikum felhasználása);
- pontos dozírozás, az antibiotikum adásának módja;
- lokálisan nem javasolt antibiotikum;
- ismerni kell, hogy kezelték-e kórházban előzetesen a sebes beteget;
Minden egyes AB használat, akár indokolt akár nem, befolyásolja a baktériumok ökologiáját (szelektív nyomás) és ez fokozza a rezisztenciát. Éppen ezért, az AB használat befolyással van a környezetre és ebben alapvetően különbözik minden más gyógyszer csoporttól. Az régóta ismeretes, hogy az antibiotikus kezelés mellékhatásaként a gyomor-bélrendszerben élő hasznos baktériumok is jelentős mennyiségben kihalnak. Az új vizsgálat magyarázattal szolgál arra, hogyan is történik a mikrobiom pusztulása, és arra is rámutat, hogy az antibiotikum-használat következményei igen messzire nyúlnak: a nem kívánt mellékhatások valószínűleg a szervezet egészét érintik, az immunrendszer működésétől kezdve a tápanyag-felszívódáson, a cukor anyagcsere változásokon, az elhízáson át a stressz-érzékenység és a viselkedés módosításáig.
A téma fontosságát alátámasztandó, tanulmányok fejtik ki, hogy minden évben a felnőttek 40%-a, illetve a gyermekek 70%-a részesül legalább egyszer antibiotikus kezelésben, nem is szólva az antibiotikumokkal kezelt milliárdnyi tenyésztett állatról, amelyek azután emberi fogyasztásra kerülnek. A megfelelően alkalmazott antibiotikumok segítenek az életveszélyes bakteriális fertőzések leküzdésében, azonban a kezeltek több mint 10%-a esetében nem kívánatos mellékhatások jelentkeznek. "Az elmúlt tíz évben egy egész univerzumnyi új tudás keletkezett az antibiotikum-használat messzire nyúló hatásaival kapcsolatosan, és a mikrobiom kutatása is óriási léptekkel halad" (9).
A biofilm kezelésének szempontjai
1. A biofilm tömegének csökkentése.
2. A biofilm újraképződésének megakadályozása.
ad.1. A debridement, és erőteljes fizikai tisztítás a legjobb módszer a biofilm csökkentésére. A debridement módszerei: a biofilm beirdalása, mechanikus eltávolítás (szike, csipesz). Alapvetően fontos az elhalt szövetek mechanikus eltávolítása (bőrgyógyász, sebész).
ad 2. Amennyiben a biofilm részleges eltávolítása után planktonikus baktériumok maradnak a seben, a biofilm újraképződése lehetséges. Ez az oka annak, hogy az antimikrobás szerekkel való tisztítást folyamatosan kell végezni. Az antimikrobás anyagoknak a váltogatott adása is indokolt, ha a baktérium telepek újratermelődése észlelhető. A következő anyagok használhatók sikeresen: ezüst, povidone jód, polyhexamethilén bigu anide (polyhexanide vagy PHMB).
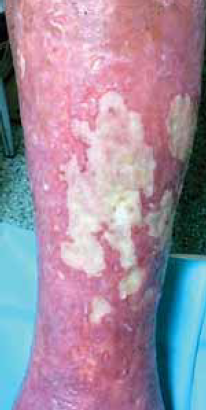
8. ábra.
A nyákos, fénylő felszínű biofilm befedi a nem gyógyuló seb alapját, a környezet gyulladt, ödémás (2017.07.04.).
Kezelési javaslat
A seb stádiumának figyelembevételével kell a sebkezelést megtervezni (10, 11,12,13). Tisztítás Betadine szappanos lemosással, bő vizes öblítés, a szappanmaradékok eltávolítására, a seb környékének felszárítása után a sebre Betadine ecsetelő, a seb környéki bőrre 5% karbamid tartalmú krém.
A biofilm befedi a seb alapját, a környezet gyulladt, ödémás (esetismertetés) (8. ábra). A biofilm mechanikus megbontása után a AquaClear tech nologia alkalmazása szük séges: géllel impregnált hydroaktív kötszer-HydroTac®- a seb nagyságára vágható. A kötszer nedvesség leadásával és a feloldott váladék visszaszívásával fellazítja, megbontja a biofilm masszát (2017. 07. 04.) A kötszert 2-3 naponta javasolt cserélni. A hydroaktív kötszer cseréje alkalmával a Betadine szappanos lemosás, mechanikus tisztítás, majd Betadine ecsetelés szükséges. A HydroTac? kötszer ismétlés legalább 3 alkalommal ill. szükség szerint, amig a tapadós váladék ?a biofilm ? leválik. A lepedék csökkent a sebalapon (2017. 07. 25.), a sebszélek fokozatosan menetelessé váltak, mert csökkent a gyulladás, a sebalapon megjelentek a szöveti újraképződést jelző granulációs bimbók (9. ábra). A feltisztúlt sebalapon bő váladékozás van. Többrétegű szuperabszorbens sebfedő ajánlott. A Zetuvit?Plus közvetlenül a sebalapra kerülhet, más sebfedő nem szükséges, csak szappanos, vizes sebtisztítás, kötésrögzítő. Kötésváltás a váladékozástól függően 2-3 naponta. A granulációs fázisban a sebüreg jó ütemben telődik (2017. 09. 19.), kevés a váladék, sebalapon élénkvörös granuláció látható, a seb nagysága jelentősen csökkent, a sebszélek menetelesek, folyamatos a széli hámosodás (10. ábra). Semleges kenőccsel impregnált háló - Grassolind? - javasolt. Kötéscsere 3-4 naponta, kötéscsere alkalmával, szappanos-vizes mosás, fertőtlenítő ecsetelő. Seb körüli bőrre 5% karbamid krém. A seb behámosodott (2018.01.09.) több, mint két éves fennállás után (11. ábra).
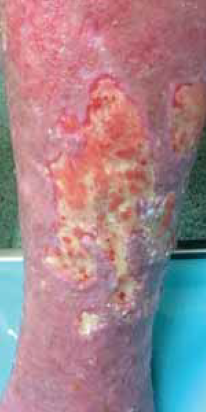
9. ábra.
A szakszerű kezelés hatására a seb alapján megjelent a vörös színű granulációs szövet, a környezet gyulladása csökkent (2017.07.25.).
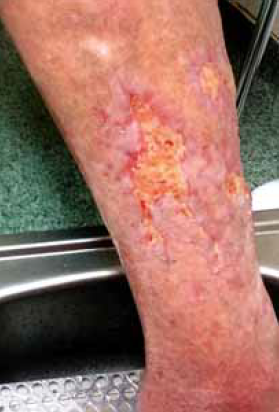
10. ábra.
A sebüreg jó ütemben telődött, a sebszélekről hámosodás látható, a seb nagysága jelentősen csökkent (2017.09.19.).
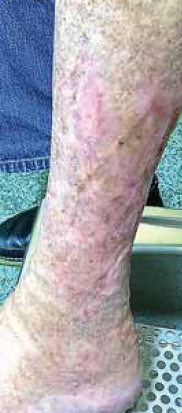
11. ábra.
A több, mint két éve nem gyógyuló seb behámosodott (2018.03.06).
Uj lehetőségek a biofilm kezelésében
Az antibiotikum rezisztens fertőzések számának ro - hamos növekedése szükségessé teszi a fertőzések elleni új stratégiák kidolgozását. Kutatóknak sikerült egy olyan (nano)technológiát kifejleszteniük, amivel a biofilmek integritása megbontható, és a szabaddá vált baktériumok az antibiotikumok célpontjaivá válhatnak. A bacteriocinek bioaktív antimicrobialis peptidek, melyek számos baktérium ribosomáiban képződnek, majd kiürülnek a sejtből. A bakteriocinek képesek elpusztítani vagy gátolni a prokaryoták növekedését, és hatékonyak antibiotikum rezisztens baktérium törzsekkel szemben. Az opportunista humán patogén Pseudomonas aeruginosa kórokozót modellként alkalmazva sikerült igazolni azt, hogy a biofilmekből szabaddá tett, annak a kötéséből kiszabadított kórokozók sérülékenyebbek az antibiotikumokkal szemben, mint a biofilm matrixában, egymással szerves kapcsolatban létező baktériumok. Ezek a kutatási eredmények felvetik a lehetőségét, hogy a jövőben helyettesíthetik az antibiotikumokat (14).
Milyen klinikai jelek alapján ítélhető meg a biofilm megszűnése?
Klinikailag jó indikátor a granuláció megindulása, ami együtt jár az exsudátum és a lepedék csökkenésével. A klinikai állapot követése és az állapot pontos monitorozása nélkülözhetetlen ahhoz, hogy a biofilm megszűnte bizonyítható legyen. A sebes beteg akkor bocsátható otthonápolásra, ha az ápoló személyzet tudja, hogy a sebalapon milyen jelei vannak a baktérium fertőzésnek, a biofilm kialakulásának, mert csak így tudja a megtanult eljárásokkal (debridement, szakszerűen alkalmazott sebfedők, antimikróbás ecsetelők) a biofilm ismételt kialakulását megakadályozni.
Irodalom
- Phillips PL, Wolcott RD, Fletcher J, Schultz GS.: Biofilm. Wound International. 2008, 1: 1-6.
- de Kievit TR.: Quorum sensing in Pseudomonas aeruginosa biofilms. Environ Microbiol. 2009, 11:279-288
- Cooper RA et al.: Biofilms in wounds: a review of present knowledge.. J Wound Care. 2014, 23:575-580
- Ganesh K., Sinha M., et al.: Chronic Wound Biofilm Model. Adv Wound Care (2015) 4, 382-388.
- Alhede M, Bjarnsholt T, et al.: Pseudomonas aeruginosa biofilms: mechanisms of immune evasion. Adv Appl Microbiol. 2014, 86:1-40
- Alves PM, Al-Badi E, et al.: Interaction between Staphylococcus aureus and Pseudomonas aeruginosa is beneficial for colonisation and pathogenicity in a mixed biofilm. Pathog Dis. 2018, 1:76
- Taylor PK et al.: Antibiotic resistance in Pseudomonas aeruginosa biofilms: towards the development of novel anti-biofilm therapies.J Biotechnol. 2014,191:121-130
- Levy-Hara G., et al.: ?Ten Commandments? for the Appropriate use of Antibiotics by the Practicing Physician in an Outpatient Setting. Front Microbiol. 2011, 2:230 Published online 2011 November 24. doi: 10.3389/fmicb.2011.00230
- Rodrigues RR, Greer RL, Dong X, et al.: Antibiotic- Induced Alterations in Gut Microbiota Are Associated with Changes in Glucose Metabolism in Healthy Mice. Front Microbiol. 2017 Nov 22;8:2306. doi: 10.3389 /fmicb.2017.02306. eCollection 2017.
- Mosti G., De Maeseneer ? Cavezzi A et al.: Society for Vascular Surgery and American Venous Forum Guidelines on the management of venous leg ulcers: the point of view of the International Union of Phlebology. Int Angiol 2015, 34 : 202-218
- Daróczy J.: Krónikus bőrsebek korszerű kezelésének irányelve. IME. 2008, 3:30-35
- Daróczy J.: Sebkezelés. Kiadó: Egészségügyi Emberi Erőforrás Fejlesztési Főigazgatóság, Budapest, 2014. ISBN 978615800 9 3
- Moore MF.: Biofilms, Their Role and Treatment Options in the Chronic Non-Healing Wound. Surg Technol Int. 2017, 31:916
- Zou J, Jiang H, Cheng H, et al.: Strategies for screening, purification and characterization of bacteriocins. Int J Biol Macromol. 2018, 17:781-789
Levelezési cím: Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2018/4. 123-129. oldal


