A mélyvénás thrombosis és pulmonalis embolisatio ma is vezető helyet foglal el a kórházi halálozási statisztikákban. A szerzők célja a mélyvénás thrombosis rizikófaktorainak részletes ismertetése, különös tekintettel az esetleges genetikai háttérre, majd ennek tükrében saját beteganyagukban ezen genetikai eltérések azonosítása. Irodalmi adatok alapján a mélyvénás thrombosis mögötti leggyakoribb genetikai eltérés a Leiden mutáció. Saját beteganyagukban a 7 mélyvénás thrombosison átesett fiatal, vizsgált beteg közül 5 esetben sikerült ezt a mutációt igazolni. Egyéb eltérést - valószínűleg a kis esetszám miatt - nem tudtak igazolni. Az ismert genetikai kockázati tényezők mellett meglévő egyéb rizikófaktorok közötti kapcsolat pontos felmérésére további, nagyobb esetszámú tanulmányok szükségesek.
Érbetegségek: 2006/4. 123-127. oldal
KULCSSZAVAK
mélyvénás thrombosis, Leiden mutáció, thrombophylia
Bevezetés
A mélyvénás thrombosis és pulmonalis embolisatio ma is vezető helyet foglal el a kórházi halálozási statisztikákban. A pulmonalis emboliák 90%-a alsó végtagi vagy medencei gyűjtőerekből származik. Egyes pathológiai adatok szerint minden második alsó végtagi mélyvénás thrombosis szövődik embolisatióval, ugyanakkor az alsó végtagi vénás occlusiók közül minden ötödik klinikailag tünetmentes marad.
A mélyvénás thrombosis rizikófaktorai
A nem és életkor etiológiai szerepe bizonyított (46 év feletti férfiaknál ötször, nőknél kétszer gyakrabban alakul ki, a férfi:nő arány 1:2-2.5). Az alsó végtagon hétszer gyakrabban jelentkeznek a tünetek, a bal oldal érintettsége a jobb oldalhoz viszonyítva 6:1 (a jobb arteria iliaca communis és a bal vena iliaca communis kereszteződéséből adódó véna leszorítás és többnyire a kismedence területén észlelhető vénafejlődési variánsok, ún. "véna-sarkantyúk" következtében).
Egyéb kockázati tényezők:
- Graviditas, szülés, gyermekágy.
- Anticoncipiens, oestrogen tartalmú gyógyszerek szedése.
- Korábbi thromboemboliás megbetegedés.
- Tumoros megbetegedések.
- Gyulladásos megbetegedések.
- Kiterjesztett műtétek utáni állapot.
- Végtagi, medencei traumák.
- Vérképző rendszeri megbetegedések (polycythaemia vera).
- Tartós fekvéssel együtt járó belgyógyászati betegségek.
- Az alvadási rendszer primer (például endogen anticoagulansok hiánya) és secunder zavarai (vese- és májbetegségek stb.).
A kórkép kialakulásában alapvetően 3 fő tényezőnek (Virchow-triász) van szerepe:
- az érfal károsodásának (például trauma, műtét stb.),
- a vénás áramlás lelassulásának (immobilizáció, például gipszkötések, tartós külső kompresszió),
- a vér fokozott alvadékonyságának (öröklött vagy szerzett thrombophylia).
Ad 1. érfal károsodása: az endothel-károsodás következtében aktiválódnak a plazma alvadási faktorai.
Ad 2. vénás áramlás lelassulása, vénás stasis: a vénák tartós statikai igénybevétele (ülés, egyhelyben állás), külső kompressziója (kismedencei tumor, terhesség, Baker cysta stb.), dilatatiója (varicositas, terhesség, oestrogen tartalmú gyógyszerek szedése) a vénás visszaáramlást nehezítve növeli a thrombosis rizikóját.
Ad 3. a vér fokozott alvadékonysága: veleszületett primer (antithrombin III.-, Protein C-, Protein S-hiány), vagy szerzett secunder (malignus daganatok, antikoncipiensek, vese- és májbetegségek) okokkal függ össze.
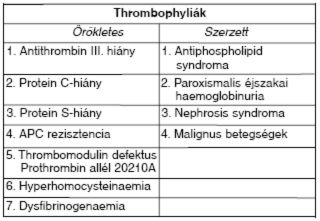
I. táblázat: Thrombophyliák felosztása.
Öröklött vagy szerzett thrombophylia
Az öröklött vagy szerzett thrombophylia a haemostasist procoagulatios irányba eltolva elindítója lehet a mélyvénás thrombosisnak. Leginkább akkor kell gondolni thrombophyliára, ha fiatal egyéneken különösebb ok nélkül, ismételten, minimális provokáló tényező mellett, akár vénás és artériás területen egyaránt, többszörös, vagy szokatlan lokalizációban phlebothrombosis alakul ki (I. táblázat).
Öröklött thrombophyliák (II. táblázat)
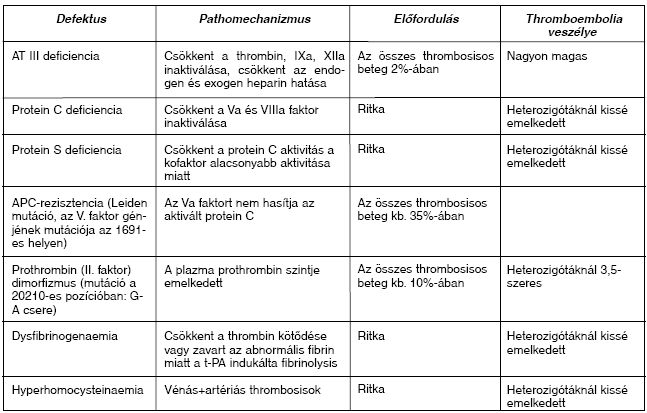
II. táblázat: Öröklött thrombophyliák.
1. Antithrombin III deficiencia
Az antithrombin III egy szerin proteáz inhibitor, amely funkcionálisan semlegesíti a thrombint és a Xa, IXa, XIa és XIIa faktort. Az AT III kötődését a thrombinhoz a heparin serkenti. Az AT III deficiencia AD domináns módon öröklődő betegség, melynek következtében nő a thromboemboliák kialakulásának veszélye. A szerzett AT III deficiencia májbetegségek, vesebetegségek, consumptív thrombohaemorrhagias állapotok következtében vagy bizonyos gyógyszerek (heparin, L-asparaginase) alkalmazása során alakulhat ki.
2. Protein S deficiencia
AD módon öröklődik. Szerzett protein S deficiencia alakulhat ki terhesség során vagy fogamzásgátló gyógyszerek szedése következtében.
3. Aktivált protein C deficiencia
A protein C akkor aktiválódik, amikor a thrombin az endothelsejtek felszínén található thrombomodulinhoz kapcsolódik. A protein C inaktiválja az Va és VIIIa faktort. Hypercoagulatiós állapotot írtak le thrombomodulin, protein C, protein S és újabban az V. faktor olyan mutációja esetén, amely rezisztens a protein C inaktiválására.
Az APC rezisztencia egyes családokban AD módon öröklődik, míg más családokban ismeretesek heterozigóta protein C deficiens betegek, akik teljesen tünetmentesek.
Az APC antikoaguláns hatását azáltal fejti ki, hogy neutralizálja az Va és VIIIa faktort. APC rezisztenciában szenvedő betegek többségénél egyetlen pontmutáció igazolható az V faktor génjében (Leiden mutáció). Az APC rezisztencia a leggyakoribb olyan öröklődő rendellenesség, amely hypercoagulatios állapotot okoz. A vénás thrombosis kockázata APC rezisztenciában öt-tízszeres heterozigótákban, és ötven-százszoros a homozigótákban. Az APC-rezisztencia általában nem jár az artériás thromboemboliás események fokozott kockázatával.
Az APC rezisztencia klinikai laboratóriumi diagnózisa egy aPTT alapú teszt, melyhez APC-t adnak. Normál APC hozzáadására az aPTT megnyúlik. A beteg plazmáját adva hozzá az aPTT nem nyúlik meg hasonló mértékben.
4. Prothrombin gén mutációi
A prothrombin a szerin proteáz thrombin prekurzora, mely utóbbi a haemostasis és a thrombosis folyamatában kulcsszerepet játszik prokoaguláns és antifibrinolyticus hatásán keresztül. A prothrombint egy 14 exonból álló 21 kb hosszúságú gén kódolja, amely a 11-es kromoszómán a 11q11-q12 pozíciójában található. A faktor II G20210A mutációjáról kimutatták, hogy kapcsolatban van a mélyvénás thrombosis megnövekedett kockázatával. Heterozigóták esetében a kockázat közel háromszoros, homozigóta eset még nem ismeretes.
5. Hyperhomocysteinaemia
1969-ben McCully (1) írta le először a magas homocystein koncentrációval együtt járó súlyos atherosclerosist és kiterjedt artériás thrombosist. Úgy vélte, hogy a hyperhomocysteinaemia okozza az érfal megbetegedését és a következményes thrombotikus folyamatokat. Később több vizsgálat erősítette meg McCully véleményét és ma már egyértelműnek látszik, hogy a hyperhomocysteinaemia az atherosclerosis, valamint az artériás és vénás thrombosis önálló rizikófaktora. A súlyos hyperhomocysteinaemia ritka. A mérsékelt hyperhomocysteinaemia a populáció 5- 7%-ában fordul elő, és kezdetben nem okoz tüneteket. A 30-40 évesek között azonban már gyakori a korai coronariasclerosis, valamint kialakulnak a visszatérő artériás és vénás thrombosisok.
A homocystein egy sulfur gyököt kötő aminosav, amely a methionin metabolizmusa során alakul ki:
methionin > homocystein > cystathionin > cystein > glutathion.
A homocystein visszaalakul methioninná (itt a B12 vitamin a kofaktor), miközben a methyl-tetra-hydro-folát (MTHF) tetra-hydro-foláttá alakul. Ebben a folyamatban vesz részt a methylene-tetra-hydro-pholate-reductase (MTHFR) enzim, melynek örökletes hibája szintén anyagcsere zavarhoz vezet.
A homocystein koncentráció két ok miatt válik kórosan emelkedetté:
- Genetikai defektus
- Vitamin hiány
Ad. 1. Cystathion-beta-synthase hiány súlyos hyperhomocysteinaemiához vezet. A homozigóta forma ritka: 200 000 születésre esik 1. Az MTHFR gén hibája esetén (C677T pontmutáció) növekszik a homocystein koncentráció. Ez a génhiba a kanadai átlagpopulációban 5-15%-ban fordul elő.
Ad. 2. A homocystein metabolizmushoz szükség van különböző vitaminokra (B6, B12, folsav). Hiányukban a homocystein koncentráció jelentősen emelkedhet.
A homocystein károsító hatásai, melyek fokozott thrombosiskészséget eredményeznek:
- növeli a F XII. hatását,
- növeli a F V. aktivitását, a thrombomodulin expresszióját gátolja,
- a t-PA kötődését gátolja az endothelialis sejthez (a plasminogenhez kötődést nem gátolja),
- a szöveti faktorok expresszióját indukálja,
- az endothelium heparán-szulfát expresszióját csökkenti,
- erősíti a thrombin formációt,
- prothrombotikus környezetet eredményez.
Célkitűzés
A mélyvénás thrombosis számos rizikófaktora, hajlamosító tényezője ismeretes. Adott esetben ezek felmérése, számbavétele a prevenció alkalmazása végett szükséges. Vizsgálatunk célja iliaca szintű mélyvénás thrombosis miatt thrombolysisen átesett betegeinknél a fő rizikófaktorok azonosítása volt, különös tekintettel az esetleges genetikai háttérre.
Beteganyag és módszer
Kórházunk Intenzív osztályán 2000 januárja és 2003 decembere között 23 beteget kezeltünk magasra terjedő, v. iliacát érintő mélyvénás thrombosis miatt. A diagnózis alapját a részletes anamnesis felvétel, fizikális vizsgálat, D-dimer teszt és az érintett vénák duplex ultrahang vizsgálata képezte (1. ábra). (A kapcsolódó irodalomban egyéb diagnosztikai módszerekről is olvashatunk.)
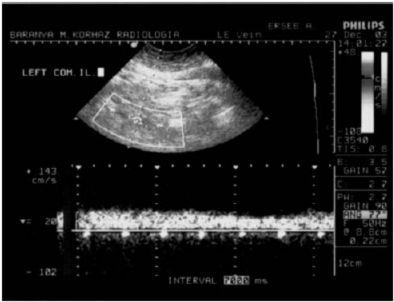
1. ábra: Vena iliaca communis szintjéig terjedő mélyvénás thrombosis.
Betegeink életkora széles határok között mozgott, az átlagéletkor 52,3 év volt. 23 betegünk közül 7 volt 30 év alatti, fiatal nő. Esetükben genetikai vizsgálatra is sor került. Ennek során Leiden mutációt, prothrombin dimorfizmust, valamint az MTHFR és CBS (cystathion-betasynthase) gén mutációját vizsgáltuk.
Eredmények
Betegeink a diagnózis megállapítását követően fibrinolyticus terápiában részesültek, sebészi kezelésre egyik esetben sem volt szükség. A betegek állapota szignifikánsan javult a kezelés alatt, fatalis kimenetel, súlyos szövődmény nem volt.
30 év alatti 7 betegünk közül - akiknél genetikai vizsgálatra is sor került - kettőnél volt pozitív a családi anamnesis. 7-ből 6 esetben jelent meg a dohányzás, mint rizikófaktor és mind a 7 beteg oralis antikoncipiens szedő volt. Genetikai vizsgálatunk során betegeinknél 7-ből 5 esetben (71,4%) találtunk kóros eltérést. Mind az 5 esetben Leiden mutációt igazoltunk.
Megbeszelés
Leiden mutáció
A vénás thrombosis leggyakoribb öröklődési oka az aktivált protein C (APC) rezisztencia. Az APC rezisztens fenotípus az V-ös faktort kódoló génen bekövetkező (G1691A) pontmutációval van kapcsolatban. A pontmutáció eredményeként a fehérjében az egyik APC hasítási hely károsodik, így az V-ös faktor rezisztenssé válik az APC-re. A Leiden (APC) mutáció detektálása az adott génszakasz PCR amplifikációját követő restrikciós endonukleázzal való hasítással történik.
Irodalmi adatok szerint Leiden mutáció esetén a thrombosis rizikója kétszeres, oralis antikoncipiens szedő nők rizikója pedig 4-szeres. E kettő összesen nyolcszoros rizikófokozódást jelent vénás thrombosis tekintetében. Tanulmányunk során mi is hasonló kockázatnövekedést tapasztaltunk. 1994-ben ismertek fel az aktivalt protein C elleni orokletes rezisztenciat, amelynek hattereben Bertina es munkatarsai (9) az V. faktor genjenek 1691. poziciojan létrejövő G > A szubsztituciot mutattak ki, mely a feherje 506-os aminosav-poziciojanak glutamin > arginin cseréjét okozza. A mutáció következtében gátolt az antikoaguláns rendszerben központi szerepet játszó aktivált protein C proteolitikus hasítása az V. faktoron, így a kontroll alól felszabaduló koagulációs kaszkád a thrombophylia irányába tolódik el. Az eddigi vizsgálatok szerint az APC rezisztencia az egyik legjelentősebb oka a vénás thrombosisoknak és szerepet játszhat a műtétet követő thrombotikus betegségek, terhességgel, antikoncipiens szedéssel kapcsolatos szövődmények kialakulásában. Populációgenetikai vizsgálatok szerint a Leiden mutációt hordozó egyének aránya az átlagpopulációban 5-10% közötti.
Prothrombin gén mutációi
Egy leideni munkacsoport (6) vizsgálatai alapján 1996 óta ismeretes a prothrombint kódoló gén 20210 G-A mutációja. A 20210 pozícióban lévő allélon G-A báziscsere megy végbe, s ez emelkedett prothrombin koncentrációt eredményez. Ezt a prothrombotikus állapotot mélyvénás thrombosison átesett betegekben igazolták. Megállapították, hogy a II. faktor G20210A-variánsa önálló rizikófaktor. A mutáció prevalenciája egészségeseknél Európában átlagosan 1,0% (8), északon ennél alacsonyabb, dél felé haladva a gyakoriság nő.
Az egészségesek körében végzett első hazai vizsgálatokban (7) a II faktorvariáns előfordulását 1,4%-nak találták, míg thrombophyliás betegeknél a prevalencia 3,9%.
Irodalmi adatok szerint tehát a prothrombin G20210A mutáció, mely emelkedett prothrombin szintet eredményez, egyértelműen fokozott kockázatot jelent vénás thrombosis tekintetében. Tekintettel a kis esetszámra, betegeink között prothrombin gén mutációt nem találtunk.
MTHFR (5, 10- methylene-tetra-hydro-pholatereductase) és CBS (cystathion-beta-synthase) gén mutációi
Az 5, 10- methylene-tetra-hydro-pholate-reductase lényeges szerepet játszik a folsav metabolizmusában. Az MTHFR-t kódoló gén 677-es pozíciójában bekövetkező CT mutáció egy csökkent aktivitású termolabilis enzimet, így következésképpen enyhe homocystein szint emelkedést eredményez. Az MTHFR defektusa autoszomális recesszív betegség, mely klinikai tünetek széles spektrumát mutatja.
Kang és munkatársai a fentiek szerint határozták meg a hyperhomocysteinaemia fokát (III. táblázat) (11, 12).

III. táblázat: Hyperhomocysteinaemia fokának meghatározása Kang szerint.
Bár tanulmányunk során a fenti mutációk egyikét sem sikerült betegeinkben kimutatni, a hyperhomocysteinaemia bizonyítottan fokozott kockázatot jelent coronaria, cerebrovascularis és perifériás érbetegségekre, valamint mélyvénás thrombosisra nézve. Den Heijer munkacsoportja szerint 22 µmol/l feletti (egészségesekben: 5-15 µmol/l) homocystein koncentracio felett a mélyvénás thrombosis rizikója négyszeresére, a visszatérő vénás thrombosisok rizikója pedig kétszeresére növekszik (10). A hyperhomocysteinaemia és a vénás thrombosisok kialakulása közötti összefüggést kutató tanulmányok között ellentmondás is van. Brattstrom és munkatársai (2) nem találtak szignifikáns különbséget az egészséges felnőttek és 42 thromboemboliában szenvedő beteg homocystein koncentrációja között. Hasonló eredményekről számolt be Amundsen és munkacsoportja (3). Ezzel szemben Bienvenue és munkatársai (4) a mélyvénás thrombosisban szenvedőknél szignifikánsan magasabb homocystein koncentrációt igazoltak: a betegek 37,5%-ában lehetett hyperhomocysteinaemiát igazolni.
A Leiden mutáció és a hyperhomocysteinaemia együttesen jelentősen megnöveli a thrombosis kialakulásának kockázatát (5).
A plasma homocystein szintjét genetikai és környezeti tényezők (köztük elsősorban táplálkozási faktorok) határozzák meg. A genetikai faktorok közül a CBS és MTHFR gén mutációja emelendő ki.
Cystathion-beta-synthase hiány súlyos Cystathion-beta-synthase hiány súlyos hyperhomocysteinaemiához vezet (több mint 400 µmol/l,). A homozigota forma ritka: 200 000 szuletesre esik 1.
Az MTHFR gén hibája esetén (C677T pontmutáció) növekszik a homocystein koncentráció. Ez a génhiba a kanadai átlagpopulációban 5-15%-ban fordul elő.
Fiatal korban bekövetkező magasra terjedő mélyvénás thrombosis esetén, különösen, ha az bizonyítható ok nélkül, szokatlan lokalizációban vagy ismétlődően jön létre, mindenképpen gondolnunk kell az esetleges genetikai rendellenességre, melyet genetikai vizsgálatokkal igazolhatunk. A leggyakoribb ilyen rendellenesség a Leiden mutáció, melyet 7 betegünk közül 5 esetében sikerült igazolnunk. Ezen kívül célszerű a vizsgálatot kiterjeszteni néhány egyéb, gyakrabban előforduló mutációkra is (MTHFR, prothrombin gén mutációi).
Egyéb mutációk, illetve hajlamosító tényezők - például dohányzás, oralis antikoncipiens szedés - együttes jelenléte esetén a mélyvénás thrombosis rizikója megsokszorozódik. A rizikófaktorok meglétéről a betegek részletes felvilágosítása szükséges, ugyanis thrombophylia esetén az oralis antikoncipiens szedése ellenjavallt, a dohányzás mindenképpen kerülendő. Thrombophyliában szenvedő betegeinknél egyes állapotok (például graviditás, szülés, gyermekágy) esetén fokozott körültekintés, ellenőrzés, illetve orvosi beavatkozások (például műtét) és egyes belgyógyászati kórképek (gyulladásos megbetegedések, tartós immobilizációval együtt járó állapotok) esetén megfelelő thrombosis prophylaxis alkalmazása szükséges.
Tekintettel a kis esetszámra, a kockázat pontos felmérésére további, nagyobb esetszámú tanulmányok szükségesek.
Rövidítések jegyzéke
AD: autoszomalis domináns,
APC: aktivált protein C,
aPTT: aktivált partialis thromboplastin time,
AT: antithrombin,
CBS: cystathion-beta-synthase,
C-T mutáció: citozin-timin mutáció,
G-A báziscsere: guanin-adenozin báziscsere,
MTHF: methylene-tetra-hydro-pholate,
MTHFR: methylene-tetra-hydro-pholate-reductase,
PCR: protein C rezisztencia,
t-PA: tissue plasminogén aktivátor.
Irodalom
- Amundsen, T., Ueland, P. M., Waage, A.: Plasma homocysteine levels in patients with deep venous thrombosis. Arterioscler. Thromb. Vasc. Biol. 1995; 15: 1321-1323.
- Balogh I., Póka R., Pfiegler Gy., Dékány M., Boda Z., Muszbek L.: High prevalence of factor V Leiden mutation and 20210A prothrombin variant in Hungary. Thromb. And Haemostasis 1999; 81:660-
- Bertina, R. M., Koeleman, B.,P.,C., Koster, T., Rosendaal, F. R., Dirven, R. J., de Ronde, H., van der Velden, P. A., Reitsma, P. H.: Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994; 369, 64-
- Bienvenue, T., Ankri, A., Chadefauz, B. et al.: Elevated total plasma homocysteine, a risk factor for thrombosis; relation to coagulation and fibrinolytic parameters. Throm. Res. 1993; 70: 123-129.
- Bienvenue, T., Ankri, A., Chadefauz, B. et al.: Elevated total plasma homocysteine, a risk factor for thrombosis; relation to coagulation and fibrinolytic parameters. Throm. Res. 1993; 70: 123-129.
- Den Heijer, M., Kostor, T., Blom, H. J. et al.: Hyperhomocysteinaemia as a risk factor for deep-vein thrombosis. N. Engl. J. Med. 1996; 334: 759-762.
- Kang, S. S., Wong, P. W., Malinow, M. R.: Hyperhomocysteinaemia as a risk factor for occlusive vascular disease. Ann. Rev. Nutr. 1992; 12: 279-298.
- Kang, S. S., Wong, P. W., Norusis, M.: Homocysteinaemia due to folate deficiency. Metabolism 1987; 36: 458-462.
- Losonczy H., Nagy I., Menyhei G.: Combined coumarin and oral pentosan polysulfate (PPS) treatment of postthrombotic syndrome. Thrombosis and haemostasis, 1991; 65 (6) 1133.
- McCully K. S.: Vascular pathology of homocysteinaemia: implication for the pathogenesis of arteriosclerosis. Am. J. Pathol. 1969; 56: 111-128.
- Menyhei G.: Plethysmographia és izotóp venographia értéke az acut mélyvénás thrombosis diagnózisában. - Interpress, Pécs, 1988; 17-20.
- Poort, S. R., Rosendal, F. R., Reistma, P. H., Bertina, R. M.: A common genetic variation in the 3, -untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and increase in venous thrombosis. Blood 1996; 88:3698-703.
- Rosendaal, F. R., Doggen, C. J. M., Zivelin, A., Arruda, V. R., Aiach, M., Siscovick, D. S. et al.: Geographic distribution of the 20210 G to A prothrombin variant. Thromb. And Haemostasis 1998; 79: 706-8.
- Selhub, J., D'Angelo: Hyperhomocysteinaemia and thrombosis: acquired conditions. Thromb. And Haemostasis 1997; 78: 527-531.
Dr. Gyevnár Zsuzsanna
Baranya Megyei Kórház, Sebészet
Pécs, Rákóczi u. 2.
Érbetegségek: 2006/4. 123-127. oldal


