Bevezetés. A terhesség és a gyermekágy időszaka önmagában is magas thromboemboliás kockázattal járó állapot. Ez a kockázat jelentősen fokozódik, primer és/vagy szekunder thrombofiliára hajlamosító tényezők együttes jelenléte esetén.
Anyag és módszer. A szerzők fokozott trombózis kockázattal élő várandós nők trombózis megelőzésében az elmúlt tíz év során szerzett tapasztalataikról számolnak be.
Eredmények. A jelzett időszakban 350 fokozott thromboemboliás kockázatú terhest vizsgáltak szakambulancián. Közleményükben a magas és igen magas kockázati csoportba sorolható terhesek kezelésének eredményeit ismertetik részletesen. Kiemelik a körültekintő anamnézis felvétel, angiológiai vizsgálat és haemostaseológiai jellemzők ismeretében történő kockázatbecslés jelentőségét, melynek alapján döntöttek a megelőző kezelés módjáról és mértékéről.
Következtetések. A LMWH profilaxis módját mindig egyénileg kell megállapítani, a terhes testtömege, terhességi kora és az egyénre számított kockázat nagysága alapján. A thrombofiliás tényezőkből adódó kockázatbecsléshez 3 vagy 4 rizikócsoport - alacsony, közepes magas és nagyon magas - megkülönböztetése látszik célszerűnek.
Érbetegségek: 2008/4. 111-118. oldal
KULCSSZAVAK
thrombofilia, terhesség, thrombosis profilaxis, ambuláns kezelés, kis molekulatömegű heparin
Rövidítések: APCR (aktivált protein C rezisztencia), PS (protein S), PC (protein C), AT-III (antithrombin III), LMWH (kis molekulatömegű heparin), MVT (mélyvéna thrombosis), PE (pulmonalis embolia), TE (thromboembolia), Anti-FXa aktivitás (aktivált X-es faktor elleni aktivitás), ACAT (anticardiolipin antitest), AFA (antifoszfolipid antitest), AFS (antifoszfolipid szindróma) CVI (krónikus vénás insuffitientia), CD-color (Doppler ultrahang vizsgálat)
Bevezetés
Jól ismert orvosi tapasztalat és széleskörűen bizonyított tény, hogy a terhesség és a gyermekágy időszaka önmagában is magas thromboemboliás kockázattal járó állapot (1, 14, 17, 24, 25). Ez a kockázat jelentősen fokozódik, primer és/vagy szekunder thrombofiliára hajlamosító tényezők (VII., VIII. táblázat) együttes jelenléte esetén. Mai haemostaseológiai ismereteink és új terápiás lehetőségeink birtokában azonban a terhességi thromboemboliás szövődmények kialakulása megelőzhető, vagy jelentősen csökkenthető a megfelelő kockázatbecslés és ezen alapuló thromboprofilaxis alkalmazásával. Az elmúlt 10-15 év során közzétett irodalmi adatok alapján sem született azonban teljesen egységes szakmai ajánlás. A kockázatbecslés súlyozottsága is eltér kissé az egyes szerzők esetében. Abban azonban egységes az irodalom, hogy minimum három, azaz kis, közepes és nagy kockázatú csoportokat kell elkülöníteni. Egyes szerzők emellett kifejezetten nagy kockázattal járó csoportot is megkülönböztetnek. (1, 2, 6) Kezelésre, illetve megelőzésre ma már egységesen a kis molekulatömegű heparinokat (LMWH) ajánlják, számos ismert, előnyös tulajdonságuk alapján (2, 4, 8, 9, 16, 20, 23). Kompressziós harisnyával és szükség esetén helyi kezeléssel kiegészítve. Bizonyított az ambuláns kezelés hatékonysága és biztonságossága is (8). A javaslatok az LMWH dózisát és alkalmazásának időtartamát illetően különböznek. Speciális esetekben LMWH mellett szükség lehet salicyl adására is. (5, 13, 26).
Vizsgálati anyag és módszer
Az elmúlt tíz évben (1998. 01. 01 - 2008. 04. 30.) kórházunk Angológiai Szakambulanciáján megjelent 350 terhes adatait retrospektív módon értékeltük. Az anamnézis felvétel és vizsgálat elsősorban az egyéni és családi thromboemboliás megbetegedések, valamint a szerzett thrombosis készségre utaló tényezők felmérésére irányult. Ha indokoltnak láttuk, kezdeményeztük a veleszületett és szerzett thrombofiliás markerek vizsgálatát is. Ezt követően, az összes szempont figyelembe vételével történt kockázatbecslés, melynél prof. dr. Bauersachs és prof. dr. Boda Zoltán ajánlásait követtük (I. táblázat). A besorolás ajánlásai mellett figyelembe vettük továbbá a beteg együttműködési készségét (az elvárható és megvalósuló kontroll vizsgálatok lehetőségét), szülészeti gondozási javaslatokat, például tervezett műtétes szülésvezetést. A preventív kezelés módjáról tehát minden esetben individuálisan döntöttünk.
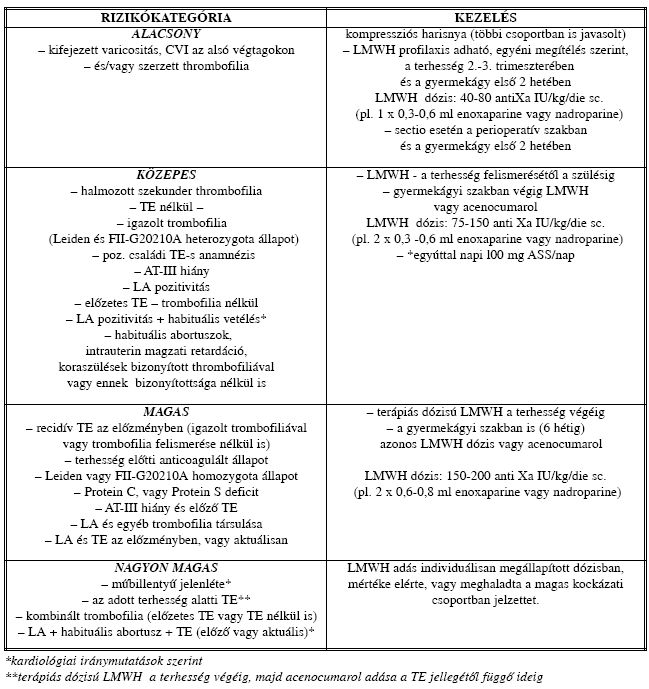
I. táblázat. A terhességi profilaxis rizikócsoportjai és kezelésük.
Eredmények
A vizsgált időszakban kórházunk Angiológiai Szakambulanciáján 350 várandós anyát vizsgáltunk, illetve az őket gondozó szülészorvosok számára konzíliumot adtunk (II. táblázat).
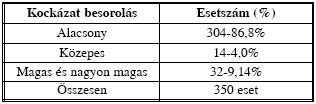
II. táblázat. Eseteink kockázat besorolásunk alapján.
Közülük 304 esetben (86,8%) csupán varicositas miatt kérték az angiológiai vizsgálatot. Ők a kis kockázatú csoportba tartoztak. Thromboprofilaxisként a minden esetben javasolt kompressziós harisnyán és lokális kezelésen kívül kb. 50%-ban volt szükség kis adagú LMWH adására is a várandósság idején, vagy csak a peripartalis időszakban. Varicophlebitis miatt 16 anyát kezeltünk LMWH preventív adagjával. Véna saphena ligatura a későn jelentkezőknél 4 esetben volt elkerülhetetlen.
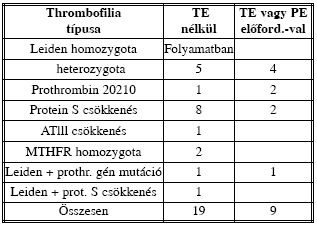
III. Táblázat. A thrombofilia típusainak és szövődményeinek megoszlása
Familiaris thrombofilia valamely formája összesen 29 betegünknél volt kimutatható (III. táblázat). Közülük 20- nál nem volt sem korábbi, sem az adott terhesség alatti thrombosis. A thromboembolia szempontjából legmagasabb kockázatot jelentő Leiden homozygota állapotot csupán egy betegünknél igazoltuk, őt az igen nagy kockázatot viselő csoportba soroltuk. Jelenleg még gondozás alatt áll. Terápiás dózisú LMW heparin kezelést a terhesség 10. hetétől (felismeréstől kezdve) alkalmazunk. Eddig - 30. hét - terhessége jól fejlődik, szövődmény nem lépett fel. A szintén magas kockázatot jelentő AT lll hiányos terhes, illetve kombinált thrombofiliával kezeltek közül a Leiden heterozygota és prothrombin gén mutációval élő terhes terhessége is sikeres volt. A Leiden heterozygota és protein S csökkenés miatt kezelt terhes thrombofiliája első terhessége során elszenvedett MVT kapcsán került felismerésre. Második terhessége kezelésünk mellett zavartalan volt. Relatíve nagy gyakorisággal fordul elő gondozottjaink között protein S csökkenés. A protein S szint terhességben fiziológiásan is csökken. Eseteinknél azonban ez a csökkenés ennél kifejezettebb volt, azaz 50%-ot meghaladó mértékű. Kezelésünk mellett valamennyi thrombofiliás terhes terhessége sikeres volt.
Korábbi thromboemboliás esemény miatt összesen 19 terhesnél vált szükségessé heparin profilaxis, esetenként ismételt terhességeiknél is. Így összesen 22 gondozott esetet értékelhetünk. Közülük 5-en pulmonalis embolia, 14-en mélyvéna thrombosis miatt keresték fel ambulanciánkat. Utóbbiak összesen 17 esetben.
Pulmonalis embolia 4 esetben mint korábbi esemény szerepel. Egy terhesnél azonban az aktuális terhesség idején lépett fel, a terhesség 8. hetében, előzetes ovuláció indukciót előidéző hormonkezelést és embrió transzfert követően. A kórtörténetet tanulságai miatt kissé részletesebben is érdemes ismertetni. A terhesnél először az embriótranszfert követő l0. napon lépett fel feszítő cruralis, majd bal oldali mellkasi fájdalom, fulladásérzéssel. Az alsó végtagi color-Doppler vizsgálat negatív volt, és a kardiológiai ultrahang sem mutatott jobb szívfél terhelést. D-dimer értéke az ún. "szürke zónában" volt. További képalkotó vizsgálatok, tekintettel a korai terhességre, nem történtek az első ellátó belgyógyászati osztályon. A terhes gyorsan múló panaszai ellenére is javasoltak azonban LMWH profilaxist, 1 x 0,4 ml Fraxiparine formájában. Ennek alkalmazása ellenére jelentkezett ismét mellkasi szúró fájdalma a 8. héten. Ekkor került gondozásunkba. Ismételt CD a véna tibialis posteriorban thrombosist valószínűsített. Mellkasi ultrahang pedig basalis, segmentalis pulmonalis infarctust a bal oldalon. Így terápiás dózisú Fraxiparine adására tértünk át, melyet a gyermekágy végéig folytattunk. Terminusban, sectióval egészséges gyermeke született. Anyai szövődmény a terhesség során nem lépett fel.
Az adott terhességet megelőzően lezajlott pulmonalis emboliák közül egy másik terhesnél az embolia előtt 2 terhesség is korai vetéléssel végződött. Thrombofiliát igazolni nem tudtunk. Az előzőekben leírt elvek szerint kezelve, harmadik terhessége sikeres volt. Anyai szövődmény sem lépett fel. Thrombofilia, Leiden heterozygota állapot két terhesnél volt igazolható. Mind az ő, mind a negyedik betegünk terhessége kezelésünk mellett zavartalan és sikeres volt. Recidív thrombemboliás eseményt nem tapasztaltunk.
Mélyvéna thrombosis miatt 17 terhesség kapcsán, összesen 14 terhest gondoztunk. Közülük 12 esetben korábban zajlott MVT, 5 esetben pedig az aktuális terhesség idején. Összesen kilenc terhesnél igazoltunk örökletes thrombofiliát. Az előzetes mélyvéna thrombosis miatt kezeltek valamennyi terhessége sikeres volt és anyai szövődmény sem lépett fel. Az öt, terhesség során kialakult MVT közül két terhesnél lépett fel vetélés. Egyiküknél hármas ikerterhesség állt fenn, mely ovuláció indukciót követően jött létre. Véna femoralis thrombosisa a 7. terhességi héten alakult ki. Teljes dózisú LMWH kezelés ellenére a 22. héten vetélés történt, melynek oka intrauterin fertőzés volt. A másik terhesnél Leiden heterozygota állapot mellett extrem obesitas (130 kg), csökkent glukóz tolerancia és hypertonia állt fenn. Terhessége 7. hetében MVT gyanújelei mellett thrombosist igazolni nem tudtak, de tekintettel a halmozott veszélyeztető tényezőkre, testsúlyra számított preventív dózisú LMWH adását kezdték el. A 14. héten fokozódó alsó végtag fájdalom és ekkor már egyértelműen igazolt v. poplitea thrombosis miatt került gondozásunkba. Terápiás adagú LMWH adása ellenére is vetélés lépett fel a 20. terhességi héten.
Anticardiolipin

IV. táblázat. Thromboprofilaxis eredménye AFS-s és ismétlődő vetélés miatt kezelt terhesekben.
Anticardiolipin antitest (ACAT) jelenléte és antifoszfolipid antitest syndroma miatt 10 terhest gondoztunk, összesen 15 terhesség kapcsán (IV. táblázat). A feltüntetett adatok alapján egyértelmű a folytatott thromboprofilaxis sikeressége, hiszen csupán egyetlen spontán abortus történt a megkezdett thromboprofilaxist követő 2 napon és egy korai magzatelhalás következett be szemben a korábbi, gondozás nélküli terhességeik kimenetelével, ahol a terhességek 80%-a sikertelen volt (V. táblázat). A thromboprofilaxis melletti korai magzatelhalás sem thromboemboliás jellegű volt, melynek kivédésére irányult kezelésünk, hanem egyéb jellegű. Cervix insuffitientia miatti magzatvesztés történt. Ezt leszámítva 93%-os eredményességet véleményezhetünk 10 beteg 15 kezelés melletti terhessége kapcsán.
A csoport részletes elemzése során látható, hogy 2 terhesnél familiaris thrombofilia is is súlyosbította az AFS-t. Egy szekunder AFS miatt kezelt terhes, akinek korábbi anamnézisében thromboemboliás esemény nem szerepelt, egy spontán abortus és egy koraszülés igen, mivel gondozásunk korai szakaszában jelentkezett, csak preventív dózisú LMWH-t kapott és 100 mg aspirint, szemben az utóbbi években általánosan javasolt terápiás nagyságrendű LMWH dózissal. A terhesség sikeres kimenetelű volt, azonban a 2. trimeszter végén fellépő fenyegető vetélés véleményünk szerint bizonyítja, hogy magasabb LMWH dózis, azaz terápiás nagyságrendű adása lett volna indokolt. Ezt alkalmazva valószínűleg a fenyegető vetélés is elkerülhető lett volna.
Műbillentyű implantációval élő terhest egy alkalommal kezeltünk. Előzetes mitralis műbillentyű beültetése után terhességének 3. trimeszterében jelentkezett. Ekkor acenocumarolról LMWH terápiás adagjára tértünk át, majd szülést követően ismét acenocumarolt adtunk. Sem anyai, sem magzati szövődmény nem lépett fel.

V. táblázat. AFS és ismétlődő vetélés miatt kezelt betegek jellemzői.
Megbeszélés
LMWH profilaxis céljára többféle frakcionált heparin készítmény is alkalmazható. Nagyobb számú nemzetközi és hazai tapasztalat elsősorban enoxaparinnal, nadroparinnal és dalteparinnal áll rendelkezésre. Betegeinknél leggyakrabban nadroparinet, kisebb részben enoxaparinet alkalmaztunk, és kezdetben, néhány esetben dalteparinet is, döntően ambuláns formában, minden esetben a thrombocyta szám rendszeres ellenőrzése mellett. A kezelés magzati szövődményt nem okoz, mivel az LMW heparin nem jut át a placentán. Anyai szövődmények közül a gátmetszés, vagy sectio hegében esetenként kissé nagyobb haematoma képződés előfordult. Ez azonban további beavatkozást nem tett szükségessé. Irodalmi adatokkal összefüggésben nem észleltünk tehát jelentősebb vérzést, vagy súlyos thromboemboliás eseményt. Sőt, korábbi thromboemboliás eseményeket követő terhességekben, LMWH profilaxist biztosítva ezek ismétlődése is megakadályozható volt, sikeres terhességek mellett. Halmozott vetélésekre, vagy koraszülésekre, praeeclampsiára hajlamosító állapotokban LMWH és salicyl profilaxis hatására lényegesen nőtt a panaszmentes és eredményes terhességek száma. Mindemellett a szülések műtéti befejezésének szükségessége nem vált gyakoribbá a kezelésből adódóan.
A terhesség
A terhesség önmagában is enyhe thrombosis hajlammal járó állapot, mely egyéb thromboemboliára hajlamosító tényezővel vagy rizikó faktorral kombinálódva, thromboemboliához vezethet. A lehetséges thromboemboliás események alatt nemcsak a jól ismert anyai elváltozásokat értjük, például thrombophlebitis, mélyvéna thrombosis, hanem a következőkben felsorolt magzati eseményeket is. Spontán abortuszok, a 2-3. trimeszterben jelentkező halvaszülés, placenta abruptio, súlyos intrauterin magzati retardáció, korai, súlyos praeeclampsia is ide sorolhatók, melyek 0,2-3%-ban jelentkeznek a terhességek során és vezetnek perinatalis mortalitáshoz vagy morbiditáshoz (VI. táblázat).
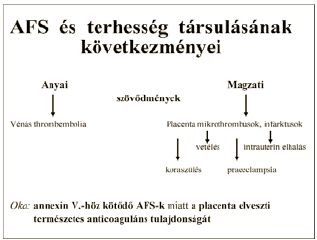
VI. táblázat. AFS és terhesség társulásának következményei.
Ezen terheseknél végzett hisztológiai vizsgálatok ugyanis az uteroplacentáris erekben típusosan megnövekedett fibrin depositumokat, thrombosist és hypoxiára jellemző endotheliális és trophoblast elváltozásokat mutatnak, melyek ismeretében joggal feltételezhetjük, hogy az uteroplacentáris keringési egység thrombosisa a szülészeti elváltozások alapja. Nagy valószínűséggel veleszületett és/vagy szerzett thrombofilia az a láncszem, mely összekapcsolja az anyai thromboemboliás eseményeket és a magzati komplikációkat (15, 19).

VII. táblázat. Veleszületett thrombosisra hajlamosító tényezők.
Az egyes kongenitális thrombofiliák által okozott thrombosis készség fokozódás mértéke és ezen trombofiliák előfordulási gyakorisága a lakosságban különböző. (VII. táblázat). Az egyik legsúlyosabb thrombosis hajlammal járó AT-III hiány állapot például, mely kb. húszszoros rizikót jelent csak ritkán, 0,05%-ban fordul elő. A Leiden mutáció azonban, melynek heterozygota formája fentieknél enyhébb, kb. hatszoros thrombosis rizikót jelent lényegesen gyakoribb megjelenésű. Magyarországon a lakosság 5-7%-át érinti (18, 21). Hatványozott módon növeli a thrombosis készséget a rizikótényezők társulása, elsősorban a veleszületett thrombofiliák kombinációja, vagy kongenitális thrombofilia mellett szerzett thrombofiliás faktorok egyidejű jelenléte.
A terhes nőknél is előforduló, szerzett thrombofiliás faktorok felsorolása a 8. táblázatban nem teljes. Ide tartozik még például a hypermesis okozta dehidratio, varicositas, krónikus vénás elégtelenség, ikerterhesség, multiparitas, hypertonia, "0"-ás vércsoport, anyagcsere betegségek progressziója, súlyosabb infectiók. Tartós immobilizáció válhat szükségessé pathológiás terhesség egyes típusaiban is. Kiemelendő, hogy egy esetleges sectio önmagában is ötszörösére növeli a peripartalis thrombemboliás szövődmények előfordulását, mely megkétszereződik sürgősségi beavatkozás esetén (1, 16,).
Thromboembolia megelőzésére és a terhesség idején kialakult mélyvéna thrombosis és/vagy tüdőembólia kezelésére, illetve uteroplacentáris thrombosis megelőzésére tehát a terhesség bármely időszakában szükség lehet. Prevenció és kezelés céljára kumarin származékok adása az irodalmi adatok többsége alapján ma már a terhesség egyetlen szakaszában sem ajánlott (4, 16). Kivételt képeznek a műbillentyűt viselő terhesek. Ezen speciális indikációtól eltekintve azonban terhesség idején kialakult thromboembolia kezelésére, vagy annak megelőzésére heparin adása javasolt. Terhesek esetében elsősorban LMW heparin, mivel mind a primer, mind a szekunder thrombosis profilaxis általában több hetes, vagy több hónapos gyógyszeradást jelent. Hosszú távú kezelésre pedig az LMW heparinok szerényebb laboratóriumi ellenőrzési igényük és számos külföldi, valamint hazai szakirodalomban is megerősített előnyös tulajdonságaik, illetve használatuk során nyert kedvező tapasztalatok alapján kedvezőbbek a frakcionálatlan heparinoknál (2, 4, 8, 9, 16, 20, 23).
Az egyes thrombosisra hajlamosító tényezők önmagukban is más-más relatív kockázatot hordoznak, elvileg végtelen ezek kombinációjának száma, és így az egyes tényezők társulásából adódó rizikónövekedés mértéke is. Antikardiolipin antitest (ACAT) jelenlétekor például már praeconcepcionalis thromboprofilaxis is indokolt lehet. Azt a korai klinikai tapasztalatot pedig, mely szerint a kis molekulatömegű heparinok dózisát a terhesség előrehaladtával növelni szükséges, elsősorban a nagyon magas, magas és esetenként a közepes kockázati csoportokban is az anti-Xa aktivitás mérési eredményei is bizonyítják. (2, 4, 6). Mindezek alapján egyértelmű az a vélemény, hogy az LMWH profilaxis módját mindig egyénileg kell megállapítani, a terhes testtömege, terhességi kora és az egyénre számított kockázat nagysága alapján (2, 6, 21). A thrombofiliás tényezőkből adódó kockázatbecsléshez 3 vagy 4 rizikócsoport - alacsony, közepes magas és nagyon magas - megkülönböztetése látszik célszerűnek (4, 14).
A thromboprofilaxist igénylő terhesek közül kiemelt figyelmet érdemelnek a familiaris thrombofilia esetei, a pozitív thromboemboliás anamnézisű, az AFS-s, illetve autoimmun kötőszöveti betegségben szenvedő és a műbillentyűs terhesek.
A veleszületett thrombofiliák típusait, nemzetközi felmérésekre alapozott előfordulási gyakoriságát és ezzel összefüggő relatív thrombosis kockázatot a VII. táblázatban tüntettük fel. A familiaris thrombofiliás állapotok jelentőségét is tárgyaltuk a bevezetésben. Bár az egyes tanulmányok szerint a terhesség kimenetelére gyakorolt hatásuk típusa és gyakorisága eltérő (2, 26), abban egységes az irodalom, hogy igazolt thrombofilia esetén a terhesség teljes időszakában szükséges profilaxis, korábbi thromboemboliás esemény nélkül is. Nincs konszenzus azonban az LMWH dózisát illetően. Ez esetben is segít a terhesek rizikó csoportokba sorolása.
Ha thromboembolia szerepel az anamnézisben, korábbi thromboemboliás esemény bizonyított thrombofilia nélkül is magas kockázatot jelent. Egyértelműen javasolt LMWH profilaxis a terhesség és gyermekágy teljes időszakában. Saját gyakorlatunkban az LMWH dózisát fokozatosan emeltük a terhesség előrehaladtával. Előzetes thromboemboliás eseményű terheseknél, miközben egyértelműen magas kockázati csoportba soroljuk őket - megkülönböztethetünk a csoporton belül is kisebb, közepes, illetve magasabb kockázatúakat a thrombotikus folyamat helyétől, kiterjedtségétől, a kiváltó tényezőtől és az esetleges további társuló szekunder thrombofiliás tényezőktől függően. Ennek értelmében a terhesség különböző szakaszában térünk át az LMWH preventív dózisáról terápiás nagyságrendűre, és ugyanígy hosszabb vagy rövidebb ideig adagoljuk azt a gyermekágy idején. Kis kockázatnak értékeltük a csoporton belül például a v. poplitea thrombosist, bizonyított thrombofilia nélkül. Ekkor a terhesség fél idejéig preventív dózist, ezt követően teljes, terápiás LMWH dózist alkalmaztunk, melyet a gyermekágyi szak felétől ismét preventív dózisra csökkentettünk. Magasabb kockázatúnak minősítettünk például korábbi iliofemoralis thrombosist. Ez esetben preventív dózist rövidebb ideig, csak az első trimeszterben alkalmaztunk. Ezt követően pedig teljes terápiás dózisra tértünk át.

VIII. táblázat. Szerzett trombózisra hajlamosító tényezők.
A csoporton belül is legmagasabbnak ítélt kockázat, például előzetes tüdőembolia és/vagy igazolt thrombofilia ismeretében kezdettől fogva terápiás dózisú LMWH-t javasoltunk és ezt a teljes gyermekágyi szakban is folytattuk. Saját eredményeinknél ismertetett 2 ovuláció indukciót követő thromboemboliás szövődmény hívja fel a figyelmet arra, hogy az ovuláció indukció és embriotranszfer esetén alkalmazott hormonkezelések thrombogén hatása - közismert módon - nem elhanyagolható! Emiatt a megfelelő thromboprofilaxist, előzetes kockázatbecslést ezen esetekben is szükséges alkalmazni!
Terhesség idején kialakult mélyvéna thrombosis kezelésére egyértelműen terápiás dózisú LMWH adása indokolt a terhesség és gyermekágy teljes időtartama alatt. Ezt követően pedig anticoagulálás olyan hosszú ideig, melyet a thrombotikus folyamat jellege alapján terhesség nélkül is javasolnánk. Anticoaguláns adása megkezdhető már a gyermekágyi szakban is, hiszen a rendelkezésre álló kumarin típusú gyógyszerek nem jutnak át számottevő mennyiségben az anyatejbe (2, 6).
Fontos entitás az antifoszfolipid szindróma. A fentieknél is nehezebb feladatot jelenthet egy terhesség sikeres lefolyásának, illetve adott esetben magának a terhesség létrejöttének elősegítése AFS esetén. Irodalmi adatok szerint ennek esélye thromboprofilaxis nélkül kb. 15% (5, 7). Az AFS, mint ismert egy autoimmun megbetegedés, melyre AFA-k következtében kialakult artériás vagy vénás thrombosisok és habituális abortuszok jellemzőek. Primer és szekunder formáját attól függően különböztetjük meg, hogy a fenti jellemző klinikai tünetek és AFA-k jelenléte mellett SLE vagy egyéb autoimmun betegség fennállása is igazolható-e. Autoimmun betegség nélkül primer, azzal együtt szekunder formáról beszélünk.
Az AFS-nek hat altípusát különböztetjük meg, attól függően, hogy milyen típusú thromboembolia alakul ki a klinikai lefolyás során (IX. táblázat).

IX. táblázat. Antifoszfolipid szindróma altípusai.
Terhességi thromboprofilaxis szempontjából külön is kiemelendő az V. csoport, melyben az AFA-k miatt sikertelen terhességek halmozódnak. Ebbe a csoportba a táblázatba foglalt kritériumoknak megfelelő esetek sorolhatók (X. táblázat).
AFS és terhesség esetén mind az anyánál, mind a magzatnál felléphetnek thromboemboliás események (VIII. táblázat). Az uteroplacentáris egység thrombosisának hátterében mai ismereteink szerint a placenta által termelt annexin-V csökkenése áll. Ezt a természetes anticoaguláns hatású anyagot kötik meg az AFA-k és ezzel közömbösítik is anticoaguláns hatását. Ez az elképzelés a kezelés alapja is. LMWH mellett azonban salicyl adása is szükséges a sikeres kezeléshez.

X. táblázat. AFS vagy altípusának kritériumai.
Az AFS terhesek egyértelműen magas kockázati csoportba sorolhatók és a terhesség teljes időszakában LMWH kezelés, valamint naponta 100 mg aspirin adása indokolt. Nagy dózisú LMWH adása szükséges közepes, illetve magas titerű ACAT vagy B2GP1-ellenes antitestek jelenléte esetén. Magzatvesztés szempontjából a legnagyobb veszélyt LA jelenléte ill. nagy titerű IgM típusú ACAT jelenti. Nagydózisú LMWH kezelés szükséges továbbá, ha az V. típus klinikai kritériumai, illetve ha előzetes thromboemboliás esemény vagy egyúttal egyéb kongenitális thrombofiliás tényező is fennáll. A kezelés testsúly szerint számított terápiás adagú LMWH (minimum 2x0,6 ml/nap) és l00 mg aspirin a terhesség felismerésétől folyamatosan. (6,13). Ductus Botalli persistens gyakoribb kialakulására nincsenek adatok. Saját gyakorlatunkban ha anyai indokból nem volt feltétlenül szükséges szülést követően is salicyl adása, úgy azt a 36. héten befejeztük. A gyermekágyi szakot követően anticoaguláns adása csak akkor szükséges, ha ezt a maternél korábban lezajlott thrombemboliás esemény indokolja.
Műbillentyűs terhesek esetén nem egységes az irodalmi ajánlás. Alapvetően két választás lehetséges ma is: a/ LMWH alkalmazása nagy dózisban naponta kétszer adva a terhesség egész időszakában és kumarin minél előbbi visszaállítása a gyermekágyi szakban.
b/ LMWH adása az első trimeszterben és a 36-40. héten, a közti időszakban pedig kumarin alkalmazása.
A kérdés ma sem tekinthető lezártnak (10, 14, 15, 22). Kardiológusok egy csoportja kumarin adását tartja biztonságosabbnak intrakardiális thrombusképződés elkerülésére. Így, kivéve a foetopathia szempontjából legveszélyeztetettebb időszakot a prevenciót kumarin kezeléssel látja biztonságosabbnak. Egységes álláspont kialakítását nehezíti, a műbillentyű melletti terhességek ritka előfordulása, illetve az ezzel összefüggésben szerzett kisszámú tapasztalat.
A fenti, nemzetközileg elfogadott elveknek megfelelően folytatott terhességi thromboprofilaxis tehát saját gyakorlatunk alapján is eredményesnek és biztonságosnak mondható.
Köszönetnyilvánítás
A haemostaseologiai laboratóriumi vizsgálatok elvégzéséért köszönettel tartozunk dr. Jáger Ritának (Szombathely, Országos Vérellátó Szolgálat Szombathelyi Területi Intézete) és dr. Melegh Bélának (Pécsi Orvostudományi Egyetem Biológiai Intézete).
Irodalom
- Bates M. Shanon, Greer A. Ian, Ginsberg S. Jeffrey: Use of Antithrombotic Agents During Pregnancy. CHEST 2004; 126:627S-644S
- Bauersachs M. R.: Risk stratification and heparin prophylaxis to prevent venous thromboembolism in pregnant women. Blood Coagulation, Fibrinolysis and cellular haemostasis 2007 1237-1245
- Bergqvist, D. U. Hedner: Pregnancy and venous thromboembolism. Acta Obstet.Gynecol. Scand. 1983; 62: 449-453.
- Boda Z., László P., Pfliegler Gy. és mtsai.: Thrombophilia, anticoaguláns terápia és terhesség. Orv. Hetil. 1998; 139: 3113-3116.
- Boda Z., Schlammadinger Á., László P. és mtsai: Nagy dózisú kis molekulatömegű heparin prophylaxis sikere antifoszfolipid-szindrómás terhesekben. Orv. Hetilap 2003, 144, 1131-34
- Boda Z.: Thrombosis és Vérzékenység -Medicina Könyvkiadó Rt., Budapest 2006 14. 315-340, 15. 341-351
- 7. Brenner, B., Blumenfeld, Z.: Thrombophilia and fetal loss. Blood Reviews, 1997, 11, 72-79
- Hirsh, J., Crowther M.: Low molecular weight heparin for the out-of-hospital treatment of venous thrombosis: rationale and clinical results. Thromb. Haemost. 1997; 78: 689-692.
- Hull, R.D., Reskob, G. E., Pinco, G. F. és mtsai.: Subcutaneous low-molecular-weight heparin compared with continuous intravenous heparin in the treatment of proximal vein thrombosis. N. Engl. J. Med. 1992; 326: 975- 982.
- Kiss R., Lengyel M.: Ajánlás műbillentyűs betegek antitrombotikus kezelésére Kardiológiai Útmutató 2002 márc., 113-115,122
- Laskin, C. A. et al.: Prednisone and aspirin in women with autoantibodies and unexplained recurrent fetal loss. N. Engl. J. Med., 1997, 337, 148-53
- Lensing, A.W., Martin H. P., Davidson B. L., Hirsh J.: Treatment of deep venous thrombosis with low-molecular- weight heparins. A metaanalysis. Arch.Intern.Med. 1995; 155: 601-607.
- Levine, L. S., Branch, D. W., Rauch, J.: The antiphospholipid syndrome. N. Engl. J. Med., 2002, 346, 752-63.
- Lindhoff-Last E., Sohn Ch., Ehrly A. M., Bauersachs R. M.: Aktuelles Management der Thromboembolie in Schwangerschafft und Wochenbett. Zentralblatt für Gynecologie 2000; 122 : 4-17
- Lockwood C. J.: Inherited Thrombophilias in Pregnant Patients: Detection and Treatment Pradigm. Obstet. Gynecology 2002; 99:333-341
- Magyar konszenzus nyilatkozat: A thromboembóliák megelőzése és kezelése. 2006 5.2.
- Melissari E., Parker C. J., Wilson N. V. és mtsai.: Use of low molecular weight heparin in pregnancy. Thromb. Haemost. 1992; 68: 652-656.
- Nagy Á., Melegh B., Losonczy H.: A familiaris thrombophilia leggyakoribb okának a Leiden mutációnak (faktor V. Q506) vizsgálata 116 thrombosisos betegben. Orvosi Hetilap 1997, 138, 2797-2800
- Pajor A.: Thrombophilia és terhesség Hippocrates 2001 3, 17-22
- Prandoni P., Lensing A. W. A., Büller H. R. és mtsai.: Comparison of subcutaneous low-molecularweight heparin with intravenous standard heparin in the treatment of proximal-vein thrombosis. N. Engl. J. Med. 1992; 339: 441-445.
- Rákóczi I., Pajor A., Losonczy H.: A thrombosishajlam problémái a szülészeti és nőgyógyászati gyakorlatban, 2000. Gyógyszereink 1999. 49:166-172
- Roberts N, Ross D, Flint S. K. és mtsai: Thromboembolism in pregnant women with mechanical prosthetic heart valves anticoagulated with low molecular weight heparin. British Journal of Obstetrics and Gynaecology 2001.108:327-329
- The European Fraxiparin Study (EFS) Group: Comparison of a low molecular weight heparin and unfractionated heparin for the prevention of deep vein thrombosis in patients undergoing abdominal surgery Br. J. Surg. 1988; 75: 1058-1063.
- Toglia M. R. és J. G. Weg: Venous thromboembolism during pregnancy. New Engl. J. Med. 1996; 335: 108-114.
- Verstraete M., Prentice C. R. M., Samama M.: A European view on the North American fifth consensus on antithrombotic therapy. Chest. 2000, 117, 1755-1770.
- Vossen C. Y., Preston F. E., Conrad J.: Hereditary thrombophilia and fetal loss: a prospective follow-up study. Journal of Thrombosis and Haemostasis 2004 592- 596, 2, 4.
Riba Mária
Vas Megyei Markusovszky Lajos Kórház,
Belgyógyászati Osztály, Szombathely
Érbetegségek: 2008/4. 111-118. oldal


