A saphena törzsek műtéte után megjelenô neovascularizáció fogalma a lekötött saphena csonk és a perifériás törzs, vagy oldalág közötti újdonképzôdött vénás összeköttetést jelöli. Ezen vénák makroszkópos vizsgálata a billentyűk hiányát, a többszörös lument illetve a lumenen belüli kötegeket mutatott. További szövettani jellemzôk a következôk: hegszövetben helyezkedik el az egy vagy több lumenű recidiv varix, endothel bélése van, az izom és a membrana elastica interna réteg hiányzik, szövettanilag megfesthetô intramuralis ideg a metszetekben nincs. A neovascularizáció a legjobb, rutinos sebészeket is frusztrálja, jól lehet kialakulásában nekik is szerepük van. A varicectomia során visszamaradó véna csonkból kiinduló neovascularizació, az egyik feltételezés szerint hypoxia miatt jön létre. A műtét után visszamaradó saphena csonk ligaturájától distalis endotel sejtek aktiválódnak, és a folyamatot az ezek által kibocsájtott növekedési faktor váltja ki. A VEGF az angiogenesis legerôsebb stimulátora. A vénás nyomáskülönbség, a nyomásváltozás, a rendellenes véreloszlás, és különösen a kiváltott áramlás, az endothelre kifejtett nyíró erô által, szintén a neovascularizació kiváltója lehet. Ez a nyíró erô az endothel felszínt éri a vér áramlása illetve áramlásváltozása következtében. Ha el akarjuk kerülni a neovascularizációt, ne traumatizáljuk a sapheno-femoralis junkciót. Ennek elsôsorban ajánlható módja, ha a terminalis és preterminalis billentyű kompetens, - ne operáljunk. Amennyiben a preterminalis billentyű elégtelen, akkor célszerű endovascularis műtétet (laser, rádiófrekvenciás) választani. Amennyiben a junkció lekötését határozzuk, akkor ne alkalmazzunk felesleges disszekciót, ne vongáljuk a szöveteket, ne használjunk elektromos koagulátort, és a vérzést gondosan csillapítsuk. Ezzel szemben a comb varicositast minél kiterjedtebben távolítsuk el.
Érbetegségek: 2008/2. 51-57. oldal
KULCSSZAVAK
varicositás, kiújulás, neovascularizáció, varicectomia, hab sclerotherápia
 Érsebész, phlebológus, Nancyban (Franciaország) az A. Paré kórházban dolgozik. A Svájci Phlebológiai Társaság díját 1999-ben nyerte el. Számos phlebológiai kongresszuson meghívott elôadó, több folyóirat (Phlebolgy, Phlebology Digest, Angiologie, Eur. J. Vasc. Endovasc Surg, International Venous Digest) szerkesztôbizottságának tagja.
Érsebész, phlebológus, Nancyban (Franciaország) az A. Paré kórházban dolgozik. A Svájci Phlebológiai Társaság díját 1999-ben nyerte el. Számos phlebológiai kongresszuson meghívott elôadó, több folyóirat (Phlebolgy, Phlebology Digest, Angiologie, Eur. J. Vasc. Endovasc Surg, International Venous Digest) szerkesztôbizottságának tagja.
A neovascularizáció, a műtét utáni saphena csonk és a perifériás saphena törzs vagy oldalágai között, vénák újdonképzôdése következtében kialakult recidivát jelenti (1. ábra). Annak ellenére, hogy ez a frusztráló jelenség elôfordulhat bármely operáló sebésszel, még a legjobbakkal, és még a legjobb műtét után is, - ennek természete, pathofiziológiája alig ismert, ezért aktív kutatás tárgya. A neovascularizació kudarc a sebész számára, aki tudtán és akaratán kívül felelôs létrejöttéért. Ezzel kapcsolatban két kérdést kellene megválaszolni: miért alakul ki, és hogyan elôzhetô meg?
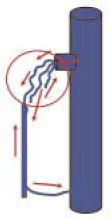
1. ábra.
A neovascularizáció során a saphena csonk és a perifériás saphena törzs (vagy oldalágai) közötti véna újdonképzôdés, egyes recidiv varicositasok oka. Az új erek billentyű nélküliek, bennük a vér áramlása a gravitáció törvényeinek engedelmeskedve többnyire a periféria irányába történik.
I. Mirôl is van szó?
I./1. Rezekció után vénák újdonképzôdését elsôként 1861-ben Langenbeck írta le (1). Egy fiatal férfi nagyon nagy vena saphena magna (vsm) varicositásából, három inch hosszú szakaszt exstirpált, majd az ércsonkokat lekötötte. Egy év múlva ugyanitt, a ligált ereket egy lúdtoll vastagságú véna kötötte össze.
I./2. Egy újabb leírást Glasstól (1987) olvashatunk, aki néhány ulcus crurisos beteget több ülésben operált (2). Elôször a comb alsó harmadában a vsm törzsét vágta át, majd késôbb a fekély gyógyulás alapján megválasztott különbözô idôpontokban a sapheno-femoralis junkciót kötötte le és a vsm törzsét strippinggel távolította el. Ugyanezen műtét alkalmával az elôzô beavatkozás hegét is kivette és feldolgozta. Ennek során az alábbiakat találta: 6 hét után a thrombus recanalizálódott, 18 hetesen új erek jelentek meg és a 40. héten a folytonosság helyreállt. Feltételezte, hogy az érpálya újraképzôdésének ingere a két véna vég közötti jelentôs nyomáskülönbség volt.
II. A neovascularizáció okai
Mindenek elôtt arra kell kitérnünk, hogy a neovascularizáció és a varicositas kialakulásában némi azonosság van. A varicositas pathofiziológiájában genetikai okokat, csökkent apoptosist, kollagen felszaporodást, elastin csökkenést, kevesebb endotelin béta receptort, VEGF megjelenést és gyulladásos folyamatot találhatunk. A neovascularizációban csak a két utóbbi vesz részt. II./1. VEGF (vascular endothelial groth factor): Ismert, hogy krónikus véna betegségben a VEGF szint emelkedett (3). A varicectomia során visszamaradó véna csonkból kiinduló neovascularizáció, hypoxia miatt jöhet létre. Vagyis a véna csonk ligaturájától distalis endotel sejtek (2. ábra) aktiválódnak, és a folyamatot az ezek által termelt növekedési faktor váltja ki (4). A VEGF az angiogenesis legerôsebb stimulátora. Rewerk tanulmányában primaer varicositas, recidiv varicositas és kontroll csoport került vizsgálatra (5). A hegbe ágyazott vékony falú vénák (neovascularizáció) immunhisztokémiai festését VEGF ellenes antitestekkel végezték el. A vizsgálat során a legnagyobb intenzitást a recidiv csoportban találták.
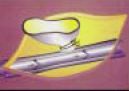
2. ábra.
A lekötött saphena csonk hypoxias endothel sejtjei VEGF-t bocsájtanak ki.
II./2. Gyulladásos folyamat: A krónikus vénás elégtelenség gyulladásos eredetérôl számos bizonyíték ismert. Legutóbb a billentyűk és a vénafal ultrastrukturális és immunhisztokémiai vizsgálata, a leukocyták kitapadását és transzmigrációját mutatta. A gyulladásos elmélet alapötlete a krónikus véna betegségben (CVD) megnövekedett endothel permeabilitásából származott (6). A postoperatív hegesedés szintén gyulladásos folyamatokkal jár. A vizsgálatok a gyulladásos folyamatok kiváltó okainak részleteit kutatják. A gyulladás sejt és molekuláris szintű megjelenése a varicositas kialakulásának legkezdetibb jelei.
II./3. A vénás nyomás szerepe a neovascularizáció kifejlôdésében: A vénás nyomáskülönbség, a nyomásváltozás, a rendellenes véreloszlás, és különösen a kiváltott áramlás, az endothelre kifejtett nyíró erô által, a neovascularizáció kiváltója lehet. Ez a nyíró erô az endothel felszínt éri, a vér áramlása illetve áramlásváltozása következtében. Amint azt El Wajeh kimutatta, a nyomáskülönbség önmagában az ér remodeling kiváltója lehet (7). Azok a vénák, amelyek egy lekötött sapheno-femoralis junkciónál (SFJ) fejlôdnek ki, megfelelnek a korábban ott lévô vénák adaptációjának, amely a rendellenes haemodinamikai állapotok hatására jött létre. Korábban operált 14, és további 9 kontroll végtagból szövetmintát vettek, majd szövettani és S100 neuralis, valamint Ki-67 (Mib1) endothel proliferációs immunhisztokémiai analízist vegeztek. A két csoport szövettanában különbséget nem találtak.
A nyomáskülönbség gyulladást okoz: Takase leírása szerint a rövid ideig tartó vénás nyomás emelkedés a mikrovasculaturában permeabilitas fokozódást indukál (8).
II./4. A nyíró erô a neovascularizáció kiváltója. A lassú áramlás során, de különösen az áramlási rendellenességek - elsôsorban reflux esetén, amikor ide-oda áramlás van, nyíró erô lép fel, amely Owatverot szerint a sejteket a gyulladásos mediátorok irányába fogékonyabbá teszi (9). Az endothel és simaizom sejtek feszülése direkt hatással van az endothel sejtek biológiájának számos területére, beleértve különbözô gyulladásos molekulák, mint a leukotrienek, prostaglandinok, bradikininek, szabad gyökök és citokinek szintézisét és kiválasztását.
A nyíró erô fokozza a gyulladásos aktivitást. Számos szerzô kimutatta, hogy mind a VEGF kiválasztás, mind a receptor megjelenés különbözô nyíró erôk illetve gyulladásos reakciók esetén felfokozott (10-12).
II./5. Jelenlévô erek szerepe: nyirokcsomó vénák. A jelenlévô erek, amelyek a v. femoralisba ömlenek: a subcutan abdominalis, pelvikus, inguinalis és residualis saphena törzs vénák szerepe nyilvánvaló, mivel ezek a neovascularizáció részei lehetnek (13). Az ott lévô nyirokcsomó vénák hypertrophizálnak, így a felületes és mélyvéna rendszer között jelentôs összeköttetést képeznek (3. ábra).
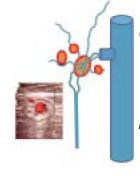
3. ábra.
A crossectomia környezetében lévô nyirokcsomó vénák hypertrophizálnak így a felületes és mélyvéna rendszer között jelentôs összeköttetést képeznek.
II./6. A haematoma revascularizációja. A haematoma szerepét számos újabb tanulmány hangsúlyozza. Az elsô munka 70 stripping-műtétet dolgozott fel: Az elsô héten 54 esetben találtak kis-, és 16-ban nagy haematomát. Egy év után csak abban a 16 esetben volt revascularizáció, amelyekben a nagy haematoma volt. Ezek közül 12-ben részleges-, míg 4-ben többszörös erekkel és teljes folytatólagossággal, továbbá refluxszal, teljes revascularizáció következett be (14).
A másik tanulmány 102 esetet dolgozott fel: 2 hónappal a műtét után 6 betegnek volt a saphena stripping haematomájában lassú, hosszan tartó refluxa, amely vagy egy comb perforansból, vagy egy oldalágból származott. Az egy éves kontroll vizsgálat során a haematoma csatorna a lágyék felé terjedt, másik 2 esetben pedig a v. femoralis communisba csatlakozott (15).
A neovascularizáció tehát a haematomák által, a műtéti agresszivitás következménye. Ernshaw tanulmányában az egy éves éves kontroll során, a reoperációk után több neovascularizációt talált, mint a primar varicectomia után (16). Ismert, hogy a reoperációk agresszívabbak, mint a primaer műtétek.
III. Makroszkópos és mikroszkópos definició
A morfológiai jellegzetességeket a különbözô szerzôk némileg különbözô módon írják le. A makroszkópos vizsgálat egy irreguláris véna masszában számos lument valamint lumenen belüli húrokat és kötegeket talált, amelyek az újdonképzôdés és nem a korábbi fennállás mellett szólnak. Gyakran nagy nyirokcsomók vannak a közelben. A neovascularizáció ereit a 2-5 izomsejtrétegű médiát lefedô, squamosus endothelium béleli. Az elasztikus rostok hiányoznak, az intima és media valamint az adventicia nehezen elkülöníthetô. A szövettani lelet megerôsíti a makroszkópos képet: irreguláris érfal, az érátmetszet különbözô pontjain a vastagság eltérô. Számos apró ér jelenléte az újdonképzôdött ér környezetében és a közeli nyirokcsomók szintén jellemzôek (17-19).

4. ábra.
Neovascularizációs véna conglomerátum öntete. A szabálytalan, kanyargós, kiöblösödésekkel tarkított, különbözô lumen méretű erek fonata jól látható.
A lágyéki reexplorációk során észlelt neovascularizációra jellemzô a kis méretű erek kanyargóssága (4. ábra), és az immunhistológiai vizsgálatok szerint az intramurális idegek hiánya. Nyamekye a neovascularizációnak három negatív kritériumát állította fel: az intramuralis idegek, a három rétegű érfal struktúra és az ér lumen szabályosságának hiányát (20). Stücker 91 szövettani blokk vizsgálata alapján egy pozitív kritériumot talált: hegszövet jelenlétét az újdonképzödött erek környezetében. Ô definiálta a neovascularizációra illetve a korábban már ott lévô erekre jellemzô tényezôket (21). A rezíduális vénákra jellemzô, hogy billentyű van a lumenben, a környezetében nem hegszövet, hanem zsír van, 89%-ban a véna media izom rétegében idegrostok mutathatók ki. A neovascularizációra jellemzô az ovális egy-, vagy többszörös járat a hegszövetben, amelynek endothel bélése van, viszont nincs sem muscularis sem elastica interna rétege. A véna fal immunhistokémiai vizsgálata nem talál idegrostokat. A lágyéki nyirokcsomók, mint errôl már szó volt, képesek a felületes és mélyvéna rendszert összekötni, ennek morfológiájára jellemzô, hogy a nyirokcsomó jelentôs subcapsularis vénás sinusokat és áthaladó vénákat tartalmaz.
IV. Mit tehetünk a neovascularizáció kockázatának csökkentésére?
IV./1. Primaer varicositas műtéte. Az elsô alapszabály: ha nincs csonk, nincs neovascularizáció. A saphena csonk elkerülésére a v. femoralisra oldalkirekesztôt teszünk, és a v. femoralis kis nyílását két rétegű tovafutó varrattal zárjuk (5. ábra). Ezzel a módszerrel kapcsolatban még nincsenek publikált eredmények.
A csonk endotheliumának elrejtésére javasolják a csonk fel nem szívódó varrattal történô lekötését, majd a csonk tovafutó polypropylen fonallal történô buktatását (6. ábra). A 114 esetben elvégzett 2 éves kontroll duplex UH jelentôs (11-rôl 3%-ra) recidiva csökkenést mutatott (22). Haas ugyanezen módszer alkalmazásával nem észlelt csökkenést a recidivák elôfordulásában, 279 végtag duplex vizsgálata során 9%-os recidivát talált (23). Mások a csonk endotheliumára koncentráltak, amelyet kémiai vagy hô kauterizációval roncsoltak, vagy a csonk szabad széléhez tett újabb ligaturával a felszínre kerülô endothelium mennyiségét csökkentették, - minden lényeges eredmény nélkül.
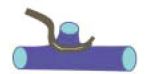
5. ábra.
A v. saphena magna csonk képzés elkerülésére a v. femoralis nyílását oldalkirekesztô segítségével, tovafutó varrattal zárjuk.
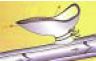
6. ábra.
A v. saphena csonk endotheljének elszigetelésére a csonk peremét tovafutó monofil varrattal zárjuk.
A csonk és a visszamaradt felületes vénák elszeparálása valószínűleg a sebész számára a legegyszerűbb dolog amit tehet. Gyakorlatilag a hiatus saphenus alatti csonk és a subcutan rétegben lévô oldalágak térbeli eltávolítása, az utóbbiak távoli lekötésével és a törzs strippelésével oldható meg. A visszamaradt incompetens csonk hátrányos szerepét Jones igazolta. A neovascularizáció akkor vezet recidiv varicositáshoz, ha törzs maradt vissza.
Egy vagy több oldalághoz kapcsolódó VSM csonkot találtak 27 esetben, amikor 500 recidiv varixos végtag duplex illetve műtéti vizsgálatát végezték el (25). További 14-ben saphena törzs maradt vissza. A következtetés az volt: a neovascularizáció a visszamaradt csonkkal vagy saphena törzzsel volt kapcsolatos, a neovascularizáció nem izolált volt.

7. ábra.
A mély és felületes véna rendszer szétválasztása folt beültetésével
IV./2. Elszigetelô módszerek. A VSM csonk és a subcutan ágak közé helyezett anatómiai vagy protézis anyag (7. ábra), a mély és felületes vénák apró erek általi összekapcsolódását elméletileg megakadályozza.
Anatómiai módszerek: Glass a fascia cribrosát (26, 27), Sheppard a fascia pectieneát használta (28). Ez utóbbi, meglehetôsen bonyolult módszer elônyeit Gibbs kontrollált randomizált vizsgálatai nem erôsítették meg (29). De Maeseneer tanulmányában az egyik csoport fossa ovalisába szilikon lapot implantált, és egy év után így kevesebb recidivát talált (30). Módszere a következô volt: a saphena csonkot fel nem szívódó fonallal kötötte le, és a csonkhoz szilikon foltot rögzített. Ezt a foltot a fascia cribrosa alá begyűrte, amely ezáltal a v. femoralist befedte, majd a fascia cribrosát, utána a Scarpa fasciát bezárta. Az egy éves kontroll során a 16,5%-os recidiva 6,2-re csökkent. Ernshaw hasonló módszert alkalmazott PTFE folttal, amely nem gátolta meg a neovascularizációt: 51 primaer esetben 14, 15 reoperáció után 40%-ot talált (31). De Maeseneer igazolta, hogy az anatómiai illetve a protézis anyagok azonos értéküek. Tanulmányában 193 beteg 235 varix műtéte során a fascia cribrosa zárásával anatómiai barriert képezett. Összesen 6,7%-os neovascularizációt talált. Hasonló volt az érték (5,2%) mint abban a 191 esetben, amikor szilikon foltot ültetett be. Anatomiai akadály beültetése, a fossa ovalis zárásával, az UH-al detectált neovascularizációk számát csökkentette (32).
VI./3. Kerüljük a junkció felesleges lekötését, amelyre egyes felmérések szerint 50%-ban kerül sor (33, 34). Legfontosabb, hogy műtétet a junkción csak abban az esetben végezzünk, ha a terminalis vagy preterminalis billentyű elégtelen. Amennyiben a saphena beömlés lekötése szükséges, a lehetô legkisebb metszést ejtsük, alkalmazzunk tumescens anaesthesiát, ezzel is csökkentve a haematoma kialakulás veszélyét, csak minimális disszekciót végezzünk, és a fascia cribrosát tovafutó varrattal zárjuk. Amennyiben a terminalis billentyű illetve a hozzá tartozó szakasz az oldalágakkal együtt megóvásra kerül, akkor az erek átmetszése ettôl distalisan történik.
IV./4. Az endovascularis laser illetve rádiófrekvenciás abláció csökkentette a neovascularizációk elôfordulását. Egy összehasonlító tanulmányban az operált 55 végtagból 6-ban (11%) kanyargós, tágult visszerek vezettek a SF junkcióhoz. Ezzel szemben a rádiófrekvenciás eljárással operáltak között nem volt recidiva (35). Egy másik EVOLVES nevű tanulmányban statisztikailag szignifikáns különbséget ugyan nem lehetett kimutatni, de a 2 éves utánvizsgálatkor a rádiófrekvenciás eljárással operált 36 közül 1-nél, míg a hagyományosan operált 29-bôl 4-nél találtak recidivát (36).
IV./5. Redo műtétek. Redo műtétek esetében, mivel a fascia cribrosa már nem zárható, kizárólag műanyag folt jöhet számításba. De Maessener legújabb tanulmányában azt közli, hogy a műanyaggal történô fedés jelentôsen csökkenti a recidiva arányt (37). Recidiv comb varicositas a folt nélküli esetekben 58%-ban, míg a folt beültetett esetekben 26%-ban jelent meg. Az 5 éves UH kontroll a folt nélküli esetekben 45%-ban, míg a folt beültetett esetekben 6%-ban mutatott neovascularizációs ereket. Vagyis a szilikon folt beültetése egyértelműen és jelentôsen csökkentette a neovascularizáció megjelenését. A műtét technikáját illetôen a folt helyzetét, azaz a v. femoralis communison történô elhelyezését, vagyis a csonk fedését és rögzítését, tartjuk fontosnak.
Egy másik randomizált tanulmányban 32 esetben PTFE foltot alkalmaztak. A 2 éves utánvizsgálatkor a folt nélküli esetekben 4, míg a folttal zárt esetekben 5 alkalommal észleltek neovascularizációt. A szerzôk a PTFE foltot a neovascularizáció megelôzésére alkalmatlannak találták (38).
Saját tanulmányunkban a junkcióból kiinduló recidiva miatt 100 betegen összesen 137 folt plasztikát végeztünk. Öt évvel a műtét után 119 végtagot kontrolláltunk. A redo műtéteket loco-regionális anaesthesiában végeztük, n. femoralis blokádot alkalmaztunk. A betegek 82%-át járóbetegként operáltuk, a többieket másnap engedtük haza. A műtéti eljárás az endoscopos módszerhez hasonló volt: lateralisan hatoltunk be, a saphena csonkhoz rövid tunelt képezve jutottunk el. Pontosabban, ferde, 4 cm hosszú lateralis incisiot alkalmaztunk, amelynek medialis vége a megelôzôen UH-al bejelölt saphena csonknak megfelelôen volt. A v. femoralist elektromos kés mellôzésével, binocularis lupe alkalmazásával kerestük fel. Az érhüvelyt megnyitottuk, majd a saphena csonkot az ér fölötti lebeny elôemelésével disszekáltuk. Elôször a csonkot a v. femoralis szintjében ligáltuk, majd saját lumene felé bebuktattuk, és az adventiciát tovafutó varattal zártuk. A diszekciót a perifériás erek irányába folytattuk, az oldalágakat klipp felhelyezése után vágtuk át. A csonkot és az oldalágakat PTFE folttal választottuk el, és azt biológiai ragasztóval rögzítettük. A folt elhelyezése és kimozdulásának megelôzése érdekében a behatolást a lehetô legkisebb diszekcióval és a legferdébben végeztük el. Szívó draint nem hagytunk vissza. A bôrt tovafutó, felszívódó fonallal zártuk (39). Rossz eredményünk csak 5 betegnél (4,2%) volt, ahol a junkcióban ismét kialakultak az összekötô erek és a varicositas megjelent, amely újabb műtét lehetôségét veti fel. Az 5 közül 2 beteg kövér volt, és ide kell sorolnunk azt az egyetlen beteget is, akinél suppuratio zajlott le. További probléma volt a csonk nem kielégítô resekciója.
Ha a most leírt eredményeket (39) összehasonlítjuk másokéval, akkor a következôket láthatjuk: olyan, a redo műtétekben nagy tapasztalattal rendelkezô teamek, mint Winterborn és mtsai 2 éves recidiva rátája 31%, De Maesener és mtsaié 9 és 22,3%. Jelentôs a különbség a szövôdmények tekintetében is: míg a mi tanulmányunkban 0,7% addig másoknál 32,5 ill. 19 %. Mások számos szövôdményrôl számoltak be: 13, ill. 6% infekció, 6,5 illetve 3% haematoma, 13, illetve 10% nyirok szövôdmény, 0,9% v. femoralis communis stenosis (37, 38). Áttekintve a fenti, valamint Ernshaw tanulmányát (31), különösen a műtéti ábrákat és fényképeket, minden esetben a v. femoralis nagy, széles feltárását láthatjuk.
Következésképp tovább redukáltuk a redo műtétek traumáját azzal, hogy még tovább csökkentettük a lateralis behatolás méretét, és a csonkot csak egy fel nem szívódó fonallal kötjük le. Rendszerint a csonk ligaturáját könnyű elvégezni, mivel a v. femoralis és a csonk adventiciája folytonos. A műtét utolsó fázisaként a perifériás csonkba maximális biztonsággal habot injectálunk (8. ábra), rendszerint proximál felöl distalis irányba vagy egy comb varix felöl proximal felé (9. ábra). Amennyiben proximál felöl distalis irányba, akkor nagyon óvatosan, 25 G-s tű, és a kimozdulás elkerülésére hosszabbító alkalmazásával történik. A vér visszafolyásával a reflux igazolódik. A hab injektálásakor a véna kifehéredik. A distalis csonk lekötésének értelme az, hogy a hab beadást biztonságossá és hatásossá tegye.
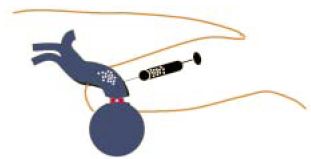
8. ábra.
A csonktól perifériás recidiv varixokat hab sclerotherapiával szüntetjük meg
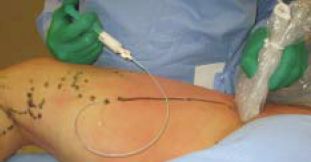
9. ábra.
A hab egy comb varix punkcióján keresztül kerül beadásra, amelynek haladását UH-al ellenôrzünk
Következtetés
Ne traumatizáljuk a sapheno-femoralis junkciót, ha el akarjuk kerülni a neovascularizációt. Elôszöris, megfelelô UH vizsgálattal ellenôrizzük a vsm terminalis vagy preterminalis billentyűjét, és ha az kompetens, akkor ne operáljunk. Amennyiben a preterminalis billentyű elégtelen, akkor célszerű endovascularis műtétet (laser, rádiófrekvenciás) választani. Amennyiben a junkció lekötését határozzuk, akkor ne alkalmazzunk felesleges disszekciót, ne vongáljuk a szöveteket, ne alkalmazzunk elektromos koagulátort, és a vérzést gondosan csillapítsuk. Ugyanakkor a comb varicositas minél kiterjedtebb eltávolítása javasolt. A redo műtétek vonatkozásában a felesleges beavatkozást kerüljük, inkább hab scleroterápiát alkalmazzunk. A folt használata nem annyira eredményes, mint ahogy azt 10 évvel ezelôtt gondoltuk. A traumák kerülése sokkal fontosabbnak tűnik: 'Tegyünk kevesebbet a junkciónál, elônyösebb a recidiva és a re-recidiva szempontjából.
Irodalom
- Von Langenbeck B. Beitrage zur chirurgischen Pathologie der Venen Arch Klin Chir 1861; 1: 47
- Glass GM. Neovascularization in recurrence of the varicose great saphenous vein following Transection. Phlebology. 1987; 2: 81-91.
- Shoab SS, Scuit JH, Coleridge-Smith PD. Increased plasma vascular endothelial growth factor among patients with chronic venous disease. J Vasc Surg. 1998; 28: 535-540
- Hollingsworth SJ, PowelI GL, Barker SGE, Cooper DG. Primary varicose veins: Altered transcription of VGFE and its receptors (KDR, flt-1, soluble flt-1) with sapheno-femoral junction Incompetence. Eur J Vasc Endovasc Surg. 2004; 27: 259-268
- Rewerk S, Labretsas K, Winkler M, Nüllen H, Duczek C, Meyer AJ, Grobholtz R, Thomas N. Vascular endothelian grouth factor (VEGF) and VEGF-receptor (VEGF-R) in the pathogenesis of primary and recurrent varicose. Phlebolymphology 2007; 14:154 (abstract)
- Takase S, Schmid-Schonbein G, Bergan. Leukocyte activation in patients with venous insufficiency J Vasc Surg 1999; 30: 148156
- El Wajeh Y, Giannoukas AD, Gulliford CJ, Suvarna SK, Chan P. Saphenofemoral venous channels associated with recurrent varicose veins are not neovascular. Eur J Vasc Endovasc Surg. 2004; 28:590-4.
- Takase S, Lerond L, Bergan JJ. Schmid-Schonbein GW. The inftammatory reaction during venous hypertension in the rat. Microcirculation. 2000; 7: 41-52
- Owatverot TB, Oswald SJ, Chen Y, Wille IJ, Yin Fe. Effect of combined cyclic stretch and fluid shear stress on endothelial cellmorphological responses, J Biomech Eng. 2005; 127: 374-382.
- Resnick N, Yahav H, Shay-Salit A, Shushy M, Schubert S, Zilberman LC, Wofovitz E. Fluid shear stress and the vascular endothelium:For better and for worse, Prog Biophys Mol Biol. 2003; 81: 177199.
- Abumiya T, Sasaguri T, Taba Y, Miwa y, Miyagi M. Shear stress induces expression of vascular endothelial growth factor receptor (Flk-1/K.DR) through the CT-rich Sp 1 binding site. Arterioscler Thromb Vasc Biol. 2002; 22: 907-913.
- Coleridge Smith PD. Leg Ulcers: Biochemical Factors. Phlebology. 2000; 15: 156-161.
- Lefebvre-Vilardebo M. Vous avez dit "Néovascularisation inguinale post-chirurgicale"? Editorial. Phlébologie 2001; 54: 253-254
- Munasinghe A, Smith C, Kianifard B, Price BA, Holdstock JM, Whiteley MS. Strip-track revascularization after stripping of the great saphenous vein. Br J Surg. 2007; 94:840-3
- Mitchel G, Rosser S, Edwards PR, Dimitri S, de Cossart L. Vascularisation of the haematoma tract following long saphenous vein stripping: a new cause of recurrent varicose veins. Phlebology 2003; 18:48 (abstract)
- Earnshaw JJ, Davies B, Harradine K, Heather BP. Preliminary results of PTFE patch saphenoplasty to prevent neovascularisation leading to recurrent varicose veins Phlebology 1998; 13:10-3
- Glass GM. Neovascularization in recurrence of varices of the great saphenous vein in the groin: Surgical anatomy and morphology. Vascular Surgery. 1989; 23: 435-442
- Glass GM. Neovascularization in recurrent sapheno- femoral incompetence of varicose veins: Surgical anatomy and morphology.Phlebology. 1995; 10: 136-142
- van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularization and recurrent varicose veins: More histologic and ultrasound evidence. J Vasc Surg 2004; 40: 296-302
- Nyamekye I, Shephard NA, Davies B, Heather BP, Earnshaw JJ. Clinicopathological evidence that neovascularisation is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg; 1998. 15: 412415
- Stücker M, Netz K, Breuckmann F, Altmeyer P, Mumme A. Histomorphologic classification of recurrent saphenofemoral reflux. J Vasc Surg 2004; 39: 816-821
- Frings N, Nelle A, Tran P, Fischer R, Krug W. Reduction of neoreflux after correctly performed ligation of the saphenofemoral junction. A randomized trial. Eur J Vasc Endovasc Surg. 2004; 28:246-252.
- Haas E, Burkhardt T, Maile N. Rezidivhäufigkeit durch Neoangiogenese nach modifizierter Krossektomie. Phlebologie. 2005; 34:101-104.
- Jones L, Braithwaite BD, Harradine K, Earnshaw JJ. Neovascularization is the principal cause of varicose vein recurrence: results of a randomized trial of stripping the long saphenous vein. Eur J Vasc Endovasc Surg 1996; 12:442-445
- Egan B, Donnelly M, Bresnihan M, Tierney S, Feeley M. Neovascularization: an "innocent bystander" in recurrent varicose veins. J Vasc Surg. 2006; 44:1279-84
- Glass GM. Prevention of recurrent saphenofemoral incompetence after surgery for varicose veins Br J Surg. 1989; 76:1210.
- Glass GM. Prevention of the sapheno-femoral and sapheno-popliteal recurrence of varicose veins by forming a partition to contain neovascularization. Phlebology 1998; 13:3-9
- Sheppard M. A procedure for the prevention of recurrent saphenofemoral incompetence. Aust N Z J Surg. 1978; 48: 322-326.
- Gibbs PJ, Foy DM, Darke SG. Reoperation for recurrent saphenofemoral incompetence: a prospective randomized trial using a reflected flap of pectineus fascia. Eur J Vasc Endovasc Surg. 1999; 18:494-498.
- De Maeseneer MG, Giuliani DR, Van Schil PE, De Hert SG. Can interposition of a silicone implant after sapheno-femoral ligation prevent recurrent varicose veins? Eur J Vasc Endovasc Surg. 2002; 24:445-449.
- Earnshaw JJ, Davies B, Harradine K, Heather BP. Preliminary results of PTFE patch saphenoplasty to prevent neovascularization leading to recurrent varicose veins. Phlebology. 1998; 13:10-13.
- De Maeseneer MG, Philipsen TE, Vandenbroeck CP, Lauwers PR, Hendriks JM, De Hert SG, Van Schil PE. Closure of the cribriform fascia: an efficient anatomical barrier against postoperative neovascularisation at the saphenofemoral junction? A prospective study. Eur J Vasc Endovasc Surg. 2007; 34:361-6
- Pichot O, Sessa C, Bosson JL.Duplex imaging analysis of the long saphenous vein reflux: basis for strategy of endovenous obliteration treatment. Int Angiol. 2002; 21:333-6.
- Cappelli M, Molino Lova R, Ermini S, Zamboni P.Hemodynamics of the sapheno-femoral junction. Patterns of reflux and their clinical implications. Int Angiol. 2004; 23:25-8.
- Kianifard B, Holdstock JM, Whiteley MS. Radiofrequency ablation (VNUS closure) does not cause neo-vascularisation at the groin at one year: results of a case controlled study. Surgeon 2006; 4:71-4
- Lurie F, Creton D, Eklof B, Kabnick Ls, Kistner Rl, Pichot O, Sessa C, Schuller-petrovic S. Prospective Randomized Study of EndoVenous radiofrequency Obliteration (Closure) versus Ligation and Vein Stripping (EVOLVeS): two-year follow-up. Eur J Vasc Endovasc Surg 2005; 29:67-73
- De Maeseneer MG, Vandenbroeck CP, Van Schil PE. Silicone patch saphenoplasty to prevent repeat recurrence after surgery to treat recurrent saphenofemoral incompetence: long-term follow-up study. J Vasc Surg. 2004; 40:98-105.
- Winterborn RJ, Earnshaw JJ. Randomised trial of PTFE patch insertion for recurrent great saphenous varicose veins. Eur J Vasc Endovasc Surg. 2007; 34:367-73
- Creton D. Surgery for recurrent saphenofemoral incompetence using expanded polytetrafluoroethylene patch interposition in front of the femoral vein: long-term outcome in 119 extremities. Phlebology. 2002; 16:93-97.
Denis Creton, MD,
Hopital A. Paré, rue A Paré, 54100 F, Nancy, France
e-mail: Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát..
Érbetegségek: 2008/2. 51-57. oldal


