Régebbi tanulmányokban a makrocirkulációban kialakult vénás hipertóniát és azokat a haemodinamikai változásokat vizsgálták, amelyek a vénák falára kihatással lehettek. Azonban nem magyarázták kellően a krónikus vénás elégtelenség alapvető mechanizmusát. A legújabb szövettani, ultrastrukturális és molekuláris kutatási eredmények arra utalnak, hogy nemcsak a nagy vénás nyomás, hanem biokémiai változások sorozata okozza a billentyűelégtelenséget és a vénafal átépülését. Ez előrehaladó gyulladásos folyamat, ami a varicosus vénák kialakulásához vezet.
Krónikus vénás betegségben (CVD) a saphena billentyűkön és a véna falában fehérvérsejt beszűrődést mutattak ki. A nagy vénás nyomás és a csökkent nyíróerő hatására leukocyta-endothel interakció jön létre. A fehérvérsejtek aktiválódnak és az endothelen átjutva a vénafalat felépítő extracellularis matrixban enzimkárosodást okoznak. Szabadgyök-képződés, matrix metalloproteinázok (MMPs és szöveti inhibitoraik (TIMPs) megváltozott aránya, valamint növekedési faktorok és cytokinek (TGF-â1, bFGF) emelkedett szintje játszik fontos szerepet a komplex gyulladásos folyamatban. A kollagén-szaporulat mellett a simaizomsejtek és az elasztin rostok disruptiója jön létre, ez okozza a billentyűkárosodást, valamint a vénafal fibrosisát és hypertrophiáját.
A CVD minden stádiumában a CEAP klinikai osztályainak megfelelően egy gyulladásos kaszkáddal van kapcsolatban.
Egyre inkább bizonyítható, hogy a CVD és a varixok kialakulását két tényező okozza: a vénás áramlási zavar és a krónikus gyulladás.
Érbetegségek: 2007/2. 91-95. oldal
KULCSSZAVAK
krónikus vénás betegség, gyulladás, leukocyta-endothel interakció, billentyűkárosodás, vénafal-átépülés
Bevezetés
Napjainkban világszerte vizsgálják, hogyan alakulnak ki krónikus vénás betegségben (CVD) a varixok, a bőrelváltozások, hogy keletkezik a lábszárfekély. A CEAP osztályoknak köszönhetően a betegség prevalenciáját pontosabban ismerjük. A legújabb epidemiológiai tanulmányok tünetekkel járó CVD-t 25-84%-ban mutattak ki, a vizsgált populációtól, a betegség stádiumától és a betegek átlagos életkorától függően (1). Magyarországon visszérbetegség a felnőttek között több mint 50%-ban fordul elő, ez az európai átlagértéknek felel meg (2).
Arnoldi már 1965-ben megállapította, hogy a CVD patomechanizmusában alapvető tényező a vénás hipertónia. Ilyenkor a billentyű-elégtelenség okozta reflux miatt a lábikra izompumpája járás közben sem képes csökkenteni a perifériás vénás nyomást, tartós, úgynevezett "ambulatorikus" vénás hipertenzió alakul ki (3). A nagy vénás nyomásra jönnek létre a makrocirkulációban a varixok, a mikrocirkulációban pedig a bőrelváltozások és a lábszárfekély (1. ábra). Régebbi tanulmányok főleg a mikrocirkulációs változásokat, a vénás fekély kialakulásának mechanizmusát ("fehérvérsejt csapda") vizsgálták. A makrocirkulációs vizsgálatok bizonyos mértékig háttérbe szorultak, elsősorban a fokozott vénás nyomás keletkezését, valamint azokat a haemodinamikai változásokat tanulmányozták, amelyek a vénák falára hatással lehettek.
Az elmúlt 10 év kutatási eredményei azonban arra utalnak, hogy nem pusztán a fokozott vénás nyomás, hanem biokémiai változások sorozata okozza a billentyűkárosodást és a vénafal átépülését. Ezek a biokémiai jelenségek gyulladásos láncreakciónak felelnek meg.
Tanulmányunkban áttekintjük a szövettani, ultrastrukturális és molekuláris kutatások új eredményeit.
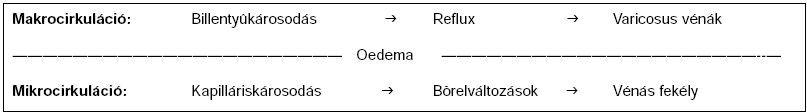
1. ábra.
A krónikus vénás betegség terjedése.
A gyulladás bizonyítékai. Fehérvérsejt beszűrődés a billentyűkön Az 1980-as évektől angioszkóppal vizsgálták a v. saphena magna belfelületét olyan betegeken, akiken a műtét előtt végzett duplex ultrahang vizsgálat refluxot mutatott ki. A varix műtétek során eltávolított vénaszegmenteket is tanulmányozták.
A valvulákon számos kóros elváltozást találtak. Először a billentyűszárnyak közti találkozási pontok, a commissurák távolodnak el egymástól, köztük hézag alakul ki, ez teszi lehetővé a refluxot. Ezt követi a valvulák elvékonyodása, megnyúlása, hasadása, vagy perforációja. Végül a billentyűk megvastagodnak, zsugorodnak, akár el is tűnhetnek. CVD-s betegek vénáin kevesebb billentyű található, mint a kontrollokon (4).
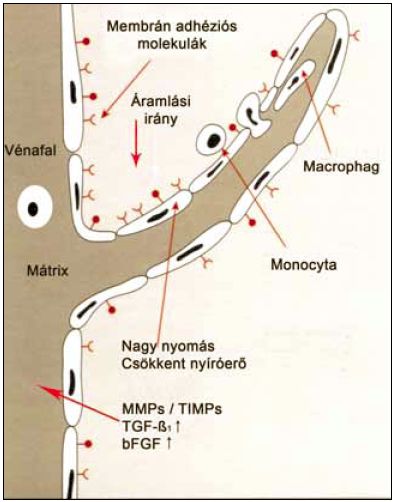
2. ábra.
Fehérvérsejt beszűrődés DVD-ben a billentyűkön és a véna falában. Az infiltráció nagyobb a billentyűk cranialis felszínén, mint a caudalis felszínen.
Lényeges, új megfigyelés volt, amikor ultrastrukturális és immunológiai vizsgálatok kimutatták, hogy CVD-ben a vénabillentyűk szárnyain és a vénák falában leukocyta infiltráció van, a kontrollokon azonban ez nem észlelhető. CD62-es és CD68-as monoklonális antitestekkel jelölt monocyták és szöveti macrophagok kapcsolódnak a véna endothelhez (5, 6). A beszűrődés nagyobb a vénabillentyűk cranialis ( proximalis) felszínén, mint a caudalis (distalis) felszínen és a vénafalban. Ez pontosan megfelel a nyomásviszonyoknak (2. ábra). A varicosus vénákon a kontrollokhoz viszonyítva a mastocyták (hízósejtek) infiltrációja is nagyobb (7). Neutrofil granulocyták nem vesznek részt a folyamatban (3. ábra). Feltételezik, hogy ez a gyulladásos infiltráció a varicositas etiológiájában döntő tényező. A folyamat ahhoz a reakcióhoz hasonlít, amit a nagy vénás nyomás a mikrocirkulációban okoz és a bőrelváltozások kialakulásához vezet.
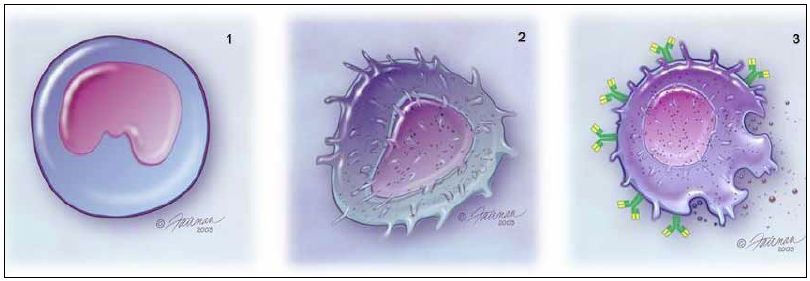
3. ábra
A beszűrődésben monocyták (1), macrophagok (2) és mastocyták (3) vesznek részt, de neutrophil granulocyták nem.
A leukocytákon és az endothel sejteken különböző membrán adhéziós molekulák jelennek meg ilyenkor: ezek elősegítik az endothelhez történő kapcsolódást, a fehérvérsejteken pedig a pseudopodiumok kialakulását, ami az endothelen való átjutáshoz, a transmigratióhoz kell.
A legfontosabb membrán adhéziós molekulák:
- az ICAM 1 (intercellular cell adhesion molecule 1),
- a VCAM 1 (vascular cell adhesion molecule 1) és
- az ELAM (endothel leucocyte adhesion molecule).
Az adhézióban fontos szerepet játszik még a leukocyták felszínéről kiválasztott "L"szelektin
(CD 62L jelű felszíni ligand), valamint az endothel sejtekből kiválasztott "E" és a thrombocytákból (platelets) kiválasztott "P" szelektin (8).
Leukocyta-endothel interakció - a fehérvérsejtek aktiválódnak
CVD-ben számos fehérvérsejt torlódik és gördül a vénák falán. Ha ezek aktiválódnak, megindul a fehérvérsejtek és a vénás endothel közti kölcsönhatás. Ennek a bonyolult, komplex folyamatnak leegyszerűsítve 5 fázisa van (9).
- Margináció. A fehérvérsejtek felsorakoznak az endothel mellett, felszínükön állábak, "pseudopodiumok" alakulnak ki.
- Gyors leukocyta gördülés (rolling). Ez percekig tart. Elősegíti a leukocytákból származó L szelektin és az aktivált endothelből származó P szelektin.
- Lassú leukocyta gördülés. Ez a szakasz 3 órán belül lezajlik. Az endothelből származó E szelektin irányítja. A folyamat eddig a fázisig még reverzíbilis.
- Adhézió. A leukocyták az adhéziós molekulák, elsősorban a VCAM segítségével az endothelhez tapadnak, a folyamat irreverzibilissé válik.
- Migráció. Megnyílnak az endothelsejtek közti rések és a fehérvérsejtek az endothelen áthatolva a media réteg extracellularis matrixába jutnak.
Gyulladasos mediatorok szerepe
Az endothel alatt elhelyezkedő extracellularis matrix lényegében kötőszöveti indákkal átszőtt, kocsonyás, interstitialis folyadék, kémiailag peptidoglikánokból és hialuronsavból áll. (A peptidoglikánokat régebben mukopoliszaharidoknak nevezték). A matrixba parenchyma sejtek ágyazódnak.
Az endothelen áthatolt aktivált monocyták, macrophagok, mastocyták károsítják az extracellularis matrix komponenseket: a kollagent, az elasztint, a laminint és a fibronectint, azáltal, hogy hatásukra oxigén szabadgyökök és proteolitikus matrix metalloproteinázok (MMPs) szabadulnak fel (10). A vénafal sejtjei is károsodnak, apoptozis, nekrózis léphet fel, nemcsak az endothel rétegben, hanem a parenchyma sejtekben, fibroblastokon, simaizom sejtekben. Ennek következtében a billentyűk és a véna fala meggyengül, szerkezetük átépül (remodeling). Újabb és újabb gyulladásos mediatorokat izolálnak, amelyek ebben a folyamatban részt vesznek. Mégis a bonyolult mechanizmusban a matrix metalloproteinázok (MMPs) és szöveti inhibitoraik (TIMPs, tissue inhibitors of metalloproteinases), valamint egyes növekedési fakorok és cytokinek játszanak kulcsszerepet.
A MMPs és a TIMPs közti egyensúly tartja fenn a vénafal homeostasisát. Ha a köztük lévő arány megváltozik, a matrix átalakul. Eddig több mint 25 MMPs-t különböztettek meg. Az MMP-1 nem más, mint a kollagenáz, az MMP-3 pedig a stromalizin.
Kimutatták, hogy a varicosus vénákban a TIMP-1 szintje emelkedett, a TIMP-2 szintje változatlan, az MMP-2 szintje pedig csökken. A TIMP-1 / MMP-2 arány 3,6-szor, a TIMP-2 / MMP-2 arány pedig 2,1-szer nagyobb volt, mint a kontrollokon mért érték. Tehát az enzimek és gátlóanyagaik közti egyensúly varicositasban felborul, a matrix átépül. (11, 12).
Ha az MMP-1 szintje csökken, a TIMP-1 okozta gátlás pedig növekszik - ez azt jelenti, hogy a kollagenáz aktivitás csökken. Ezért a kollagen fokozottan termelődik és lerakódik a vénák falában.
Az MMP-1-et a matrixba jutott hízósejtekből származó kináz aktiválja. MMP-2 szintje emelkedett a boka körül kialakult lipodermatosclerosisban, az MMP-9 pedig a lábszárfekély szélén található nagyobb mennyiségben (13). A két enzim aktivációja korán, már napokkal a fokozott vénás nyomás kialakulása után kimutatható (14).
A gyulladásos mediatorok egy másik csoportja is részt vesz a matrix átalakulásában.
Ezek a növekedési faktorok és cytokinek. A növekedési faktorok proteinek, amelyek a sejtfelszín receptoraihoz kötődnek és sejtproliferációt, vagy sejtdifferenciálódást okoznak. A cytokinek a növekedési faktorok egy alcsoportját képezik.
A varicosus vénák falában 2 cytokin szintjének emelkedését mutatták ki (15). Ezek:
- a ß1-es átalakitó növekedési faktor (transforming growth factor-ß1, TGF-ß1) és a bazikus
- fibroblast növekedési faktor (basic fibroblast growth factor, bFGF).
A TGF-ß csoportba legalabb 100 tipus tartozik. A TGF-ß 1 felszabadulása olyan eseménysorozatot indít el, amelyben a macrophagok stimulálják a fibroblastokat és a kötőszöveti fehérjék termelését. Így elősegítik a kollagen szintézisét, fokozzák a TIMP kiválasztást, gátolják az MMP1 termelését - végeredményben intenzív fibrosist okoznak (12). A bFGF-nek kemotaktikus hatása van, ezenkívül elősegíti a simaizomsejtek osztódását (16).
Végeredményben a szövettani és ultrastrukturális vizsgálatok azt mutatják, hogy CVD-ben a vénák falában a kollagen mennyisége megnő, a kollagénrostok elválasztják egymástól a simaizomsejteket, az elasztin-szálak és a símaizomsejtek széttöredeznek, intenzív fibrosis és hypertrophia alakul ki. Így a vénák fala meggyengül, kanyargóssá válik. Mindez krónikus gyulladásos folyamatnak felel meg.
A kutatások nyomán CVD-s betegeken új gyulladásos mediatorok kimutatása várható.
A gyulladás indító mechanizmusa CVD-ben, nyíró erő
Géndefektusok - függetlenül a vénás hipertenziótól - közvetlenül károsíthatják a billentyűket (17). Humoralis faktorok, mechanikus stress-mediált mechanizmus is kiváltó ok lehet.
A legfontosabb indító mechanizmus mégis az endothel membránra kifejtett folyadék nyíró erő (shear stress) - tehát az endothel membrán egységnyi felületére kifejtett, a membránnal párhuzamos erő (dyn/cm2). Ez a viszkózus jellegű vongáló erő, amivel az áramló vér tangenciális irányban "nyírja" az endothelt.
Fiziológiás körülmények között a normális shear stressnek erős gyulladásellenes hatása van. Ha azonban a nyíró erő a normál érték alá csökken, vagy ennél nagyobb lesz - proinflammatorikus gének fokozottan képződnek, az endothelből apoptotikus anyagok szabadulnak fel. Nemcsak a shear stress nagysága, hanem időbeli változása és mintája is fontos (18).
CVD-ben a nagy vénás nyomás és a vér stagnálása miatt a nyíró erő csökken, a vénafal mentén gördülő fehérvérsejtek sebessége is csökken. Ilyen lassú áramlási zónák főleg a vénák kanyarulatain, megtöretésein (kinkingeken), a postcapillaris venulákon, egyes perivénás szakaszokon találhatók (13, 19).
A lecsökkent shear stress hatására megnyúlnak az endothesejtek közötti rések, a fehérvérsejteken kialakulnak a pseudopodiumok, könnyebb az adhézió, megindul a migráció az extracellularis matrixba. Ebben a folyamatban fontos szabályozó szerepe van az endothel NO termelésének.
Végeredményben a vénás hipertenzió nem közvetlenül indítja el a vénafal gyulladását, hanem haemodinamikai változások útján, a csökkent nyíró erő segítségével.
Mechanoreceptorok
Feltételezik, hogy a vénás hipertenzió okozta nyíróerő változást, mint szignált mechanoreceptorok vezetik át a véna falára. Nem tisztázott, hogy egy jelfelfogó hálózatról, vagy egyetlen mechanoreceptor molekuláról van szó. Inkább a komplex jelfelfogó hálózat létezése feltételezhető. Ezt a szerepet mitogén-aktivált protein kinázok ("extracellular signal-regulated kinases1/2"), ion csatornák, G proteinek, speciális membrán mikrodomainok tölthetik be (20).
Elsősorban mégis a glycocalyx-nak tulajdonítanak ilyen mechanoreceptor szerepet. A glycocalyx az endothel belső, poliszaharida szegélye, ez közvetít minden, a véna lumene felől érkező áramlásváltozást, így a nyíróerő csökkenését is észleli. Fiziológiás körülmények között ez a finom, bolyhos bélés akadályozza a leukocyták adhézióját, védi az endothelt a fizikai és kémiai káros hatásokkal szemben. A gyulladás ezt a réteget szakítja meg (21).

4. ábra.
A billentyűk és a vénafal átépülése CVD-ben.
Gyulladásos kaszkád. Gyógyszeres kezelés
A gyulladásos folyamat szerepét a billentyűk és a vénafal átépülésében a 4. ábrán foglaltuk össze. Ez a reakció nemcsak a már kialakult CVD-ben észlelhető, jelen van már a betegség kezdetén és a CEAP rendszer minden klinikai stádiumán végigvonul (22).
Végeredményben egyre inkább bizonyítható, hogy a krónikus vénás betegséget és a varixokat a vénás hipertenzió okozta áramlási zavar és az ehhez csatlakozó gyulladásos kaszkád kettős faktora hozza létre.
A gyulladásos láncreakcióban a leukocyta-endothel interakció játszik különösen fontos szerepet. Ez lehet a gyógyszeres kezelés célcsoportja. Egy flavonoid frakció, a mikronizált heszperidin-diozmin kombináció gátolja a leukocyták adhézióját és migrációját, hatására a gyulladásos markerek szintje dózisdependens módon csökken, a billentyűk kevésbé károsodnak (23, 24). A klinikai hatás ezzel párhuzamos: az oedema csökken, a lábszárfekély pedig - ha kompressziós kezelést is alkalmazunk - hamarabb begyógyul (25).
Irodalom
- Pannier-Fischer, F., Rabe, E.: Epidemiology of chronic venous disease. Hautarzt, 54: 1037-1044. (2003.)
- Bihari I., Tornóci L., Bihari P.: Az alsó végtagi varicositas hazai epidemiológiai felmérése. Érbetegségek, 9: 57-62. (2002.)
- Arnoldi, C. C.: Venous pressure in patients with valvular incompetence of the veins of the lower limb. Acta Chir. Scand., 132: 427-430. (1966.)
- Hoshino, S., Satakawa, H., Iwaja, F.: External valvuloplasty under preoperative angioscopic control. Phlebologie, 46: 521- 529. (1993.)
- Ono, T., Bergan, J. J., Schmid-Schönbein, G. W., Takase, S.: Monocyte infiltration into venous valves. J. Vasc. Surg., 27: 158-166. (1998.)
- Takase, S., Schmid-Schönbein, G. W., Bergan, J. J.: Leukocyte activation in patients with venous insufficiency. J. Vasc. Surg. 30: 148-156. (1999.)
- Yamada, T., Tomita, S., Mori, M. et al.: Increased mast cell infiltration in varicose veins of the lower limbs: A possible role in the development of varices. Surgery, 119: 494-497. (1996.)
- Takase, S., Bergan, J. J., Schmid-Schönbein, G. W.: Expression of adhesion molecules and cytokynes on saphenous veins in chronic venous insufficiency. Ann. Vsc. Surg., 14: 427-435. (2000.)
- Boisseau, M. R.: How are leukocytes involved in the symptoms of chronic venous disease? Medicographia, 28: 128-136. (2006.)
- Takase, S., Pascarella,L., Bergan, J. J.: Hypertension induced valve remodelling. J. Vasc. Surg., 39: 1329-1335. (2004.)
- Jacob, M. P., Badier-Commander, C., Fontaine, V. et al.: Extracellular matrix remodelling in vascular wall. Pathol. Biol., 49: 326-332. (2001.)
- Badier-Commander, C., Verbeuren, T., Lebard, C. et al.: Increased TIMP / MMP ratio in varicose veins: A possible explanation for extracellular matrix accumulation. J. Pathol., 192:105-112. (2000.)
- Schmid-Schönbein,G.W.: Inflammation in the pathophysiology of chronic venous insufficiency. Phlebolymphology, 39: 95-99. (2003.)
- Pascarella, L., Penn, A., Schmid-Schönbein, G. W.: Venous hypertension and the inflammatory cascade: major manifestations and trigger mechanisms. Angiology, 56 (suppl. 1.): S3-S10. (2005.)
- Badier-Commander, C., Couvelard, A., Henim, D. et al.: Smooth cell modulation and cytokine overproduction in varicose veins. J. Pathol., 193: 398-407. (2001.)
- Pappas, J, You, R., Rameshwar, P. et al.: Dermal tissue fibrosis in patients with chronic venous insufficiency is associated with increased transforming growth factor â1 gene expression and protein production. J. Vasc. Surg., 30: 1129-1145. (1999.)
- Labropoulos, N., Giannoukas, A. D., Delis, K. et al.: Where does venous reflux start? J. Vasc. Surg., 26: 736-742. (1997.)
- Monos E.: A vérkeringés dinamikája. Semmelweis Egyetem, Képzéskutató, Oktatás-technológiai és Dokumentációs Központ. Budapest, 2001. 22-26. old.
- Buján, G., Pascual, G., Bellón, J. M.: Leukocytes and varicose veins etiology. Medicographia, 28: 109-114. (2006.)
- Yoshizumi, M., Abe, J., Tsuchiya, K. et al.: Stress and vascular responses: atheroprotective effect of laminar fluid shear stress in endothelial cells: possible role of mitogen-activated protein kinases. J. Pharmacol. Sci., 91: 172-176. (2003.)
- Weinbaum, S., Zhang, X., Han, Y. et al.: Mechanotransduction and flow across the endothelial glycocalyx. Proc. Nath. Acad. Sci. USA, 100: 7988-7995. (2003.)
- Nicolaides, A. N.: Chronic venous disease and leukocyteendothelium interaction: from symptoms to ulceration. Angiology, 56(suppl.1): S11-S19. (2005.)
- Bergan, J. J.: Chronic venous insufficiency and therapeutic effects of Daflon 500 mg. Angiology, 56(suppl.1): S21-S24. (2005.)
- Takase, S., Pascarella, L., Lerond, L. et al.: Venous hypertension inflammation and valve remodelling. Eur. J. Vasc. Surg., 28: 484-493. (2004.)
- Coleridge-Smith, P., Lok, C., Ramelet, A. A.: Venous leg ulcer: a metaanalysis of adjunctive therapy with micronized, purified flavonoid fraction. Eur. J. Vasc. Endovasc. Surg., 30: 198-208. (2005.)
Dr. Sándor Tamás
Semmelweis Egyetem, Kútvölgyi Klinikai Tömb,
II. Sebészeti Klinika
1125 Budapest, Kútvölgyi út 4.
Érbetegségek: 2007/2. 91-95. oldal


