1Pécsi Tudományegyetem Klinikai Központ I.sz. Belgyógyászati Klinika
2Országos Vérellátó Szolgálat Pécsi Regionális Vérellátó Központ
Absztrakt
A Raynaud-jelenség az acralis részek epizódikus, fájdalmas, rohamokban jelentkező keringés zavara. A szekunder formát (Raynaud-szindróma) változatos etiológiájú kórképek okozzák, a primer forma (Raynaud-kór) esetében háttérbetegség nem derül ki.
Tanulmányunkban az angiológiai szakrendelésre beérkező 51 Raynaud-jelenségben szenvedő beteg vérmintáiból meghatároztuk a vér hemoreológiai paramétereit; hemato kritot (Htk), plazma és teljes vér viszkozitást (PV, VV), vörösvérsejt (vvs) aggregációt és deformabilitást, illetve a vér áramlási képességét jellemző Htk/VV hányadost. Ezen paramétereket egy 58 fős, egészséges önkéntesekből álló kontroll csoporthoz hasonlítottuk. Vizsgáltuk továbbá a Raynaud-betegekben különböző kóros fehérjék jelenlétét (hideg agglutinin, krioglobulin, antifoszfolipid antitestek).
A vizsgált betegek 3/4-e hideg agglutinin, 42%-a pedig krioglobulin pozitívnak bizonyult. Az antifoszfolipid szűrés 17%-ban mutatott eltérést. Az egészséges kontroll csoporthoz képest az aggregációs index szignifikánsan nagyobb volt. A magas nyíró feszültségeken szignifikánsan alacsonyabb vvs deformabilitást kaptunk a Raynaud-betegekben. A Htk/VV hányadosa pedig szignifikánsan magasabb volt a Raynaud csoportban a kontroll csoporthoz képest.
A Raynaud-jelenség hátterében játszódó folyamatok részletesebb megismerése elengedhetetlen az újabb kezelési stratégiák kidolgozásához. Vizsgálataink során meg figyeltük a Raynaud-jelenséget mutató betegeknél a kóros fehérjék felszaporodását a vérben. A vvs aggregáció fokozottnak bizonyult Raynaud-betegségben, amely jelenség hátterében a vérben felszaporodó kóros fehérjék szerepét feltételezzük. A vvs deformabilitásra utaló értékek is kedvezőtlenebbnek bizonyultak betegeinknél, ami szerepet játszhat a mikro keringés romlásában, egyben utal arra, hogy nem csupán vazospazmusról, hanem komplex keringési zavarról lehet szó. A testhőmérsékleten mért, a vér oxigénszállító kapacitására utaló magasabb Htk/VV érték kompenzációs mechanizmus lehet.
Érbetegségek: 2013/2. - 33-39. oldal
KULCSSZAVAK
Raynaud-jelenség, Raynaud betegség, laboratóriumi vizsgálatok
1. Bevezetés
1.1. Raynaud-jelenség
A Raynaud-jelenség vazospasztikus rendellenesség, túlzott vazomotoros válasz, amelynek következtében bizonyos területek vérellátása romlik, így azok jellegzetes színelváltozással reagálnak. A rohamokban jelentkező, fájdalmas keringészavart rendszerint hideg vagy érzelmi stressz váltja ki. Az érintett területek jellemzően a kéz ujjai, de a lábakon, a törzsön, sőt az arcon is jelentkezhetnek a tünetek. A roham három fázisban zajlik le. Az érintett terület elfehéredik a vérellátás romlása miatti hipoxia következményeként, majd cianotikus kék színt vesz fel a megszaporodó redukált hemoglobin következtében, ezután a spazmus oldódásával reaktív hiperémia következik be. A végtagban kialakuló keringési zavar és hipoxia súlyos esetben fekélyesedéshez, gangrénához vezethet.
A Raynaud-jelenség két formáját különböztetjük meg: a primer Raynaud-kórt és a szekunder Raynaud-szindrómát. A Raynaud-kór kialakulása alapbetegséghez nem köthető, önálló betegség. A szekunder Raynaud-szindróma hátteré - ben több tényező és betegség állhat: immunológiai betegségek, endokrin eltérések, vaszkuláris okok (pl. atero szklerózis), infekciók, hematológiai betegségek, mechanikai ártalmak, kémiai anyagok és gyógyszer mellékhatások [1,2,3].
A primer Raynaud-kór diagnózisát a következő kritériumok alapján mondhatjuk ki [4]:
- Ujjakra lokalizálódó, hidegre jelentkező vazo - spasztikus roham
- Mindkét oldali végtag érintettsége
- Gangréna hiánya, illetve legfeljebb az ujjak végén jelentkező gangréna
- Nem mutatható ki háttérben álló egyéb betegség, gyógyszerszedés
- Legalább 2 éves anamnézis
- Normális süllyedés
- Antinukleáris antitest hiánya
- Normális körömágy kapilláris morfológia
A jelenség prevalenciájáról kevés adat áll rendelkezésre, becslések szerint előfordulási gyakorisága 3-20%. Újabb vizsgálatok szerint a Raynaud-jelenség nemek szerinti prevalenciája a nőknél 5%, a férfiaknál 3%. Az eltérő becslések hátterében hormonális, klimatikus különbségeket, eltérő életstílust, különböző környezeti hatásokat és eltérő genetikai prediszpozíciót feltételeznek [5].
A primer Raynaud-kór kezdete változó, de az esetek többségében a pubertáskorra esik, előfordulása nőknél kétszer gyakoribb, mint férfiaknál [1].
A szekunder Raynaud-szindrómát okozó alap beteg - ségek spektruma igen széles. Prevalenciája az életkor növekedésével nő. A Raynaud-szindrómát okozó beteg - ségek előfordulása az életkorral szintén növekszik, így ezt az összefüggést ezzel magyarázzák. Bizonyos betegségekben például szisztémás szklerózisban a Raynaud-jelenség megelőzheti a betegség manifesz tálódását [5].
1.2. Patomechanizmus
A betegség patomechanizmusa a mai napig kevéssé tisztázott. Lényege az erekben lévő vazodilatátorvazokonstriktor egyensúly megbomlása vazokonstriktor irányba. Három fő tényezőt feltételeznek, melyek egymással szoros összefüggésben alakítják ki az értónus egyensúlyának változását vazokonstriktor irányba, együttes jelenlétük a betegség kialakulásához vezethet [6]:
- neurogén faktorok
- vér kapcsolata az érfallal (endotéllel)
- kóros immunválasz, gyulladás
1.2.1 Neurogén faktorok
A neurotranszmitterek felszabadulása az autonóm és szenzoros afferensekből hozzájárul az artériák tónusához. Raynaud-jelenségben a tónus vazokonstrikció irányába tolódik, amiben több tényező is közrejátszik [7]. A G-proteinhez kötött alfa-adrenerg receptorok noradrenalin, adrenalin hatására vazokonstrikciót okoznak az erekben. Raynaud-jelenségben megnövekedett alfa-receptor aktivitás, denzitás észlelhető a perifériás érfalban. Hideg hatására ezeknek a receptoroknak az aktivációja növekszik, továbbá feltételezik, hogy Raynaud-jelenségben csökken az aktivációs küszöbük [8]. A CGRP (calcitonin gene-related peptide) vazodilatációt okozó neuropeptid, ami a szenzoros afferensekből szabadul fel. Raynaud- jelenségben a CGRP szintjének csökkenését találták, ami a vazodilatáció károsodásához vezethet [9]. Ezen folyamatok vég - eredményeként a perifériás értónus neurális szabályozása a vazokonstriktor irányba tolódik. A Raynaud-jelenségben lezajló vazospazmus hátterében centrális szabályozási zavart is feltételeznek, de a perifériás mechanizmusok nagyobb szerepet játszhatnak [10].
1.2.2. A vér kapcsolata az érfallal
Az érfal strukturálisan és funkcionálisan is károsodik Raynaud-jelenségben. Szekunder Raynaud-szindrómában főként az érfal szerkezete károsodik, míg primer Raynaudkórban az érfal funkcionális károsodása dominál [11].
Funkcionális változások okának elsősorban az érfalak belsejét borító endotél károsodását tartják. Ma már elfogadott, hogy az endotél fizikai barrier szerepe mellett kifinomult szabályozó funkciót is ellát, így befolyásolva az értónust [7]. Vazoaktív anyagokra reagálva, illetve vazodilatátor és vazokonstriktor anyagok termelésével központi szerepet játszik a vazoregulációban. Finom egyensúly áll fenn a vazodilatátor (pl. NO) és a vazokonstriktor (pl. endothelin-1) mediátorok között, amelynek központjában az endotél áll. E szabályozás megbomlása feltételezhetően kulcsfontosságú szerepet játszik a Raynaud-jelenség kialakulásában [7,12]. Az eddigi kutatások fokozott endotél-függő vazokonstrikciót (növekedett endo - thelin-1 szint), csökkent endotél-függő vazodilatátor szintet (csökkent NO, prosztaciklin szint), illetve károsodott endotélfüggő vazodilatációt találtak Raynaud-jelenséget mutató betegekben [13]. Vég eredmény ként az értónus vazokonstriktor irányba billen e tényezők következtében.
1.2.3. Kóros immunválasz, gyulladás
Az érfalon belül keringő alakos elemek és a vérben megtalálható fehérjék szintén hozzájárulhatnak a Raynaudjelenség kialakulásához. A trombociták aktivációja régóta ismert Raynaud-jelenségben. Ezt bizonyítják a vérben megemelkedő tromboxán és tromboglobulin szintek, amelyek trombocita granulumokból felszabaduló potens vazokonstriktorok és aggregáció fokozó faktorok. E faktorok képződése növekedik hideg hatására. A tromboxán szintáz gén fokozott expresszióját is kimutatták Raynaud-jelenségben [14,15]. Fokozott fehérvérsejt aktivációt is leírtak a Raynaud-jelenségben, amely hozzájárulhat a megnövekedett oxidatív stresszhez [16].
A fokozott oxidatív stressz szerepének felismerése egyre jobban előtérbe kerül a Raynaud-jelenség kutatásában. A rohamokban fellépő véráramlás csökkenés többszörösen ismétlődő iszkémiás-reperfúziós károsodáshoz és oxidatív stresszhez vezethet. Szabad gyökök képződésében a hipoxantin–xantin oxidáz rendszer és a polimorfonukleáris fehérvérsejtek aktivációja vesz részt [17].
1.3. Terápia
A Raynaud-betegség kezelési lehetőségei igen korlátozottak, oki terápia jelenleg nem létezik, ezért csak tüneti szerek alkalmazására van lehetőség. A szekunder Raynaud-szindrómában a kezelés sikeressége szorosan összefügg az alapbetegség kezelési lehetőségeivel. A terápia célja a rohamok gyakoriságának és súlyosságának mérséklése, ezáltal az életminőség javítása.
1.3.1. Primer prevenció
Elsődlegesen életmódi változtatásokkal lehet jó eredményeket elérni a kezelés során. Az érintett területek melegen tartása, ezáltal a fő kiváltó trigger elkerülése jelentősen csökkenti a rohamok gyakoriságát. Az öltöz - ködés módosítását (pl kesztyű használata) már 10°C körüli hőmérsékleten meg kell kezdeni. Elengedhetetlen a dohányzás elhagyása. A rohamok bekövetkezténél fontos mielőbb friss vért juttatni az érintett területekre (például karkörzéssel mechanikus módon). A terület meleg vízbe helyezése szintén javítja a vérellátást. A vazokonstriktor szerek (például alfa-1 receptor agonisták) elkerülése is alapvető. Az életmódi terápia primer Raynaud-kórban nagyobb jelentőséggel bír [1,2].
1.3.2. Gyógyszeres kezelés
Gyógyszeres terápia alkalmazására a primer prevenció sikertelensége esetén kerül sor. Lényege a vazoreguláció befolyásolása direkt vazodilatátorokkal és/vagy a vazokonstrikció gátlásával. Újabban olyan anyagok is bekerültek a repertoárba, amelyek az endotél funkciót javítják (pl: sztatinok) vagy a szerotonin felvételt gátolják [18]. A vazodilatátor anyagok közül a Ca-csatorna blokkolók alkalmazhatóak eredményesen [19]. A nitrátok a Raynaud-jelenség mindkét formájában hasonlóan hatásosnak bizonyultak, orális, transzdermális tapasz vagy kenőcs formában is alkalmazzák [20]. A prosztaglandin - származékoknak a vazodilatátor hatáson kívül tct aggregáció gátló és antiproliferatív hatásuk is van [21]. Foszfodiészteráz inhibitorok (pl. Tadalafil) jó eredményeket mutattak terápia rezisztens szekunder Raynaudszindrómában [22]. A vazokonstrikció gátlására endothelin-1 receptor blokkolót, angiotenzin receptor blokkolót (ARB) és alfa-adrenoceptor blokkolót alkalmazhatnak [18]. Ugyanakkor azt is tapasztaljuk, hogy a gyógyszeres kezelési próbálkozások gyakran eredménytelenek.
1.3.4. Sebészi kezelés
A panaszok fokozódása és nem gyógyuló sebek esetén számításba jön perkután kémiai vagy műtéti szimpa tektómia. A műtétek 90%-ában jó eredményről számolnak be, a gangréna demarkálódik, a fájdalmas rohamok megszűnnek [23].
2. Célkitűzés
Vizsgálatunk célja a Raynaud-jelenségben szenvedő betegek hemoreológiai vizsgálata volt, ami a jelenség jobb megismeréséhez vezethet. Vizsgáltuk a hematokrit, plazma és teljes vér viszkozitás, a vörösvérsejt aggregáció és deformabilitás változását Raynaud-betegekben egészséges kontroll csoporthoz viszonyítva. Továbbá tanulmányoztuk különböző kóros fehérjék (hideg agglutininek, antifoszfolipid antitestek, krioglobulin) jelenlétét Raynaudbetegségben és ezek kapcsolatát a hemoreológiai tényezőkkel.
3. Módszerek
3.1. Betegek
Vizsgálatunkban 51 Raynaud-jelenséget mutató beteg vett részt (átlagéletkor: 46,8 év; nők/férfiak: 41/10). A résztvevők angiológiai szakrendelésre érkeztek, ahol anamnézis felvétel, általános belgyógyászati és angiológiai vizsgálatok és vérvétel történt. A laboratóriumi vizsgálatokat az Angiológiai útmutatónak [4] megfelelően végeztük (rutin labor paraméterek, speciális vizsgálatok). Vizsgálatunkat a Regionális Kutatásetikai Bizottság engedélyezte (engedély szám: 4428).
3.2. Kóros fehérjék vizsgálata
A speciális vizsgálatok közül a kóros fehérjék jelenlétét vizsgáltuk, az alábbi módon:
- krioglobulin (PTE KK Laboratóriumi Medicina Intézet): Li-heparinos vérvételi cső (4,0 ml) + natív géles cső (5,0 ml) + Na-citrátos vérvételi cső (2,7 ml)
- hideg agglutinin (Országos Vérellátó Szolgálat Pécsi Regionális Vérellátó Központ): 2 db natív gél nélküli vérvételi cső (2x6,0 ml)
- antifoszfolipid antitestek (PTE ÁOK Immunológiai és Biotechnológiai Intézet): natív gél nélküli vérvételi cső (5,0 ml)
3.3. Hemoreológiai mérések
A hemoreológiai méréseket a PTE KK I. sz. Belgyógyászati Klinika Haemorheologiai Kutató - laboratóriumban végeztük. A vizsgálatokhoz egyénenként 2 db 4 ml-es Li-heparint tartalmazó vérvételi csőbe vettünk vért. A méréseket a vér levétele után 1 órán belül el végeztük. A hematokrit (Htk) értékeket Haemofuge (Heraeus Instruments GmbH, Osterode, Németország) kapilláris centrifugával állapítottuk meg. A plazma (PV) és teljes vér viszkozitást (VV) Hevimet 40 kapilláris viszkoziméterrel (Hemorex Kft, Budapest, Magyarország) mértük meg 37°C-on. A vörösvérsejt (vvs) aggregációt és deformabilitást LORCA-val (Laser-assisted Optical Rotational Cell Analyzer, R&R Mechatronics, Hoorn, Hollandia) határoztuk meg 37°C-on. A hematokrit és a teljes vér viszkozitás értékekből kiszámítottuk a Htk/VV hányadosát, amely megmutatja a vér oxigén - szállító kapacitását. Munkacsoportunk egy előző tanul - mányában megmutatta, hogy az arányszám csökkenése növelheti az iszkémiás szívbetegség mortalitásának rizikóját [24].
3.4. Kontroll csoport
A hemoreológiai vizsgálatok eredményét 58 fős, egészséges önkéntesekből álló kontroll csoporthoz hasonlítottuk (átlagéletkor: 31,5 év, nők/férfiak: 35/23). Az önkéntesektől a fent részletezett módon vettünk vért és végeztük el a hemoreológiai méréseket.
3.4. Statisztikai elemzés
A hematokrit, plazma és teljes vér viszkozitás illetve a Htk/VV paraméterek elemzésénél először a teljes vizsgált Raynaud csoportot hasonlítottuk a teljes kontroll csoporthoz, majd a férfiakat kivettük mindkét csoportból és csak nőket hasonlítottuk össze. Erre azért volt szükség, mert míg a kontroll csoportban a férfiak száma magasabb volt a nőkhez képest, addig a Raynaud csoport négyszer több nőt tartalmazott, mely nemi különbség befolyásolja a fent említett paramétereket.
Az adatokat átlag ± SEM formában tüntettük fel. Az eredmények kiértékelését kétmintás Student-féle t-próbával végeztük el.
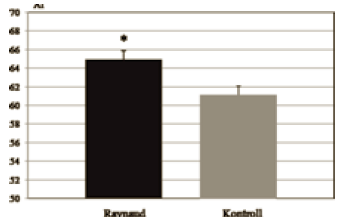
1. ábra.
Az aggregációs index értékek (* = p<0,01).
Ennek megfelelően a Raynaud csoportban szignifikánsan alacsonyabb t1/2 érték értéket mértünk (Raynaud: 2,11 s ± 0,16;
Kontroll: 2,47 s ± 0,12) (2. ábra).
4. Eredmények
Ezidáig a betegek 46,6%-ában találtunk a Raynaudjelenség hátterében álló okot, tehát ezek a betegek a szekunder Raynaud csoportba kerültek besorolásra. A talált alapbetegségek kb. 2/3-át neurovaszkuláris kompressziós szindrómák, kb. 1/3-át pedig autoimmun kórképek képezték.
4.1. Kóros fehérjék
A laboratóriumi mérések alapján a betegek 74%-ában találtunk hideg agglutinin pozitivitást. A krioglobulin 42%-ban, az antifoszfolipid antitestek pedig a betegek 17%-ában voltak jelen.
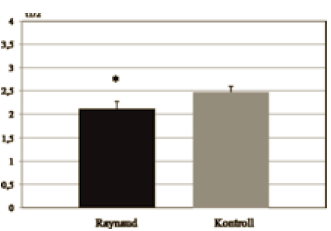
2. ábra.
A t1/2 értékek átlaga a Raynaud és kontroll csoportban (* = p <0,01).
4.2. Vörösvérsejt aggregáció
A LORCA-val mért aggregációs értékek (aggregációs index: AI, az aggregátumok kialakulásához szükséges idő fele: t1/2) között szignifikáns eltérést találtunk a kontroll és Raynaud csoport között. A kontroll csoporthoz képest a Raynaud-os betegek AI értéke szignifikánsan magasabb volt (Raynaud: 64,92 ± 1,39; Kontroll: 61,11 ± 0,92) (1. ábra).
4.3. Vörösvérsejt deformabilitás
A Raynaud-betegségben szenvedőkben a vörösvérsejt deformabilitást jellemző elongációs index (EI) értékek szignifikánsan alacsonyabbnak bizonyultak a magasabb nyírófeszültségeken, amely nyírófeszültség értékek főként a kis erekben illetve a kapillárisokban uralkodó viszonyokat jellemzik.
Kiszámítottuk az EImax értéket (egy végtelen nyíró - feszültséghez tartozó maximális EI érték), ami szintén szignifikánsan alacsonyabbnak bizonyult Raynaudbetegségben (Raynaud: 0,672 ± 0,002; Kontroll: 0,681 ± 0,001) (3. ábra).
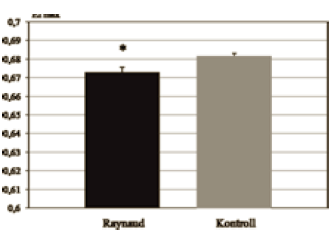
3. ábra.
Az EI max értékek átlaga a Raynaud és kontroll csoportban (* = p<0,01).
4.4. Hematokrit
A hematokrit értékekben szignifikáns eltérést nem találtunk a mindkét nemet tartalmazó csoportok között (Raynaud: 43,08% ± 0,44; Kontroll: 44,10% ± 0,48). A női Raynaud csoport Htk értéke azonban szignifikánsan magasabb volt a női kontroll csoporthoz képest (Raynaud nők: 42,18% ± 0,42; Kontroll nők: 40,27% ± 0,43) (4. ábra).
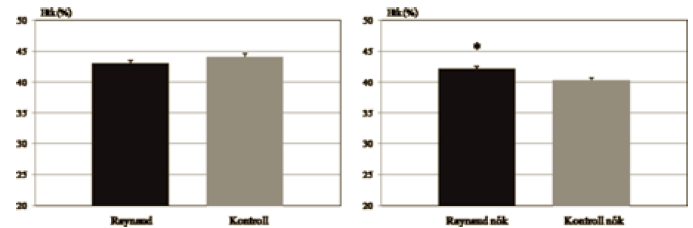
4. ábra.
A hematokrit értékek átlaga a Raynaud, a kontroll, a női Raynaud és női kontroll csoportokban (* = p<0,01).
4.5. Teljes vér viszkozitás
A Raynaud-betegségben szenvedőkben szignifikánsan alacsonyabbnak bizonyult a VV, mint a kontroll csoportnál (Raynaud: 4,07 mPas ± 0,06; Kontroll: 4,25 mPas ± 0,06). A női csoportok összehasonlításánál nem találtunk eltérést (Raynaud nők: 3,95 mPas ± 0,05; Kontroll nők: 3,90 mPas ± 0,05) (5. ábra). .
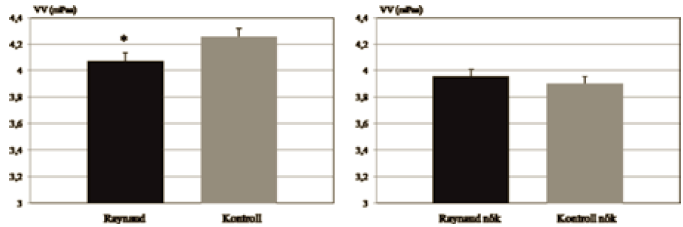
5. ábra.
A teljes vér viszkozitás értékek átlaga a Raynaud, a kontroll, a női Raynaud és női kontroll csoportokban (* = p<0,05).
4.6. Plazma viszkozitás
A plazma viszkozitás értékekben szignifikáns különbséget nem találtunk a csoportok között
4.7. Htk/VV
A Htk/VV hányados mind a Raynaud, mind a női Raynaud csoportban szignifikánsan magasabbnak bizonyult (Raynaud: 10,70 ± 0,10; Kontroll: 10,40 ± 0,08; Raynaud nők: 10,77 ± 0,12; Kontroll nők: 10,36 ± 0,13) (6. ábra).
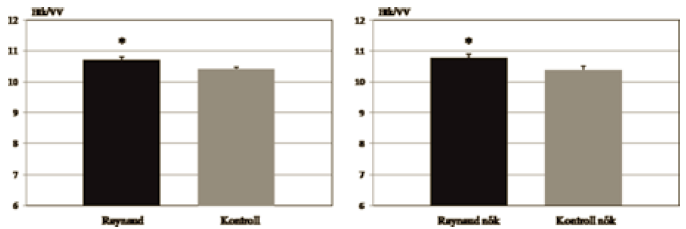
6. ábra.
A hematokrit/teljes vér viszkozitás értékek átlaga a Raynaud, a kontroll, a női Raynaud és női kontroll csoportokban (* = <0,05).
5. Megbeszélés
Vizsgálataink során megfigyeltük a Raynaud-jelenséget mutató betegeknél a kóros fehérjék felszaporodását a vérben. A betegek mintegy háromnegyedénél hideg agglutinin pozitivitást találtunk, majdnem felénél pedig krioglubulinok jelenléte volt kimutatható. Az antifoszfolipid antitestek 17%-ban voltak jelen, habár antifoszfolipid szindróma csak két betegnél igazolódott. Feltételezzük, hogy ezek a kóros fehérjék szerepet játszhatnak a tünetek kialakulásában, a betegség progressziójában és súlyosságában.
A mikroreológiai paraméterek közül vizsgáltuk a vvs aggregációt és deformabilitást. A vvs aggregációs indexek szignifikánsan nagyobbak voltak, az aggregátumok képző - déséhez szükséges idő pedig szig - nifikánsan kevesebb volt a Raynaud-jelenséget mutató betegeknél a kontroll csoporthoz viszonyítva, tehát a vvs aggregáció fokozottnak bizonyult Raynaud-betegségben. A jelenség hátterében a vérben felszaporodó kóros fehérjék szerepét feltételezzük. Az egyik aggregációs elmélet, a „bridging” teória szerint a vvs aggregáció a vérben fiziológiásan jelen lévő makromolekulák miatt következik be, amelyek mintegy hídként kapcsolatot létesítenek a sejtek közt, így összekötve azokat [25]. A vvs deformabilitás szingi - fikánsan alacsonyabb volt a Raynaud csoportban. A deformabilitás romlása a közepes és nagy nyírófeszült - ségeknél bizonyult a legnagyobbnak, mely nyírófeszültségek a mikro - cirkulációra jellemzőek. A deforma - bilitás romlása következtében a vvs-k alakváltoztatási képessége romlik, így a kis kapillárisokon való átjutásuk nehezített. A vvs aggregációs és deformabilitás értékek alapján Raynaud-betegségben romlik a mikro cirkuláció, mely a szöveti oxigenizáció elégtelen séghez vezet, ami hozzájárulhat a betegség rosszabbodá sához, a fekélyek és gangrénák kialakulásához. Ezek alapján feltételezzük, hogy a jelenség patomecha nizmusában nem csupán a vazospazmus játszik szerepet, hanem komplex keringési zavarról van szó. A makroreológiai paraméterek közül a hematokrit értékek nem mutattak különbséget a teljes vizsgálati csoportok tekintetében, azonban a Raynaud- jelenségben szenvedő nőknél szignifikánsan magasabb hematokrit értékeket mértünk a kontroll csoporthoz képest. A teljes vér viszkozitása pedig a női Raynaud csoportban nem mutatott eltérést, azonban a teljes populációt jellemző Raynaud csoportban szignifikánsan alacsonyabb értéket mutatott. A Htk/VV hányados mindkét Raynaud csoportban szignifikánsan magasabbnak bizonyult. A Htk/VV hányados a vér oxigénszállító kapacitását mutatja. Anémia, azaz alacsony hematokrit esetén a vér nem tud megfelelő mennyiségű oxigént felvenni és szállítani, a hematokrit csökkenésével a szív eredetű halálozás nő. A hematokrit emelkedésével az oxigénkötő kapacitás lineárisan, míg a vér viszkozitása exponenciálisan nő, és bár a vér oxigénben gazdagabb lesz, a megnövekedett áramlási ellenállás, a véráramlás lelassulása miatt az eredő oxigénellátás romlik. Kutatócsoportunk egy korábbi tanulmányában megmutatta, hogy a hematokrit- vérviszkozitás arány segítséget nyújthat a kardiális morbiditás és mortalitás előrejelzésében [24]. A magas Htk/VV arány hátterében kompenzációs mechanizmust feltételezünk a Raynaud csoportban.
Összességében vizsgálatunk arra utal, hogy a Raynaudjelenség kialakulásában nem egyszerűen vazokonstrikció játszik szerepet, hanem összetett keringési zavar alakul ki, amiben a hemoreológiai tényezők is jelentős szerepet játszhatnak.
Irodalom
- Czirják L (szerk.): Klinikai Immunológia. Medicina Könyvkiadó Zrt. Budapest 2006.
- Tulassay Zsolt (szerk.): A belgyógyászat alapjai I-II. Medicina Könyvkiadó Rt., 2007.
- LeRoy EC, Medsger TA Jr. Raynaud's phenomenon: a proposal for classification. Clin Exp Rheumatol, 10 (1992), 485-488.
- Nemes A (szerk.):A Magyar Angiológiai és Érsebészeti Társaság Irányelvei. Angiológiai Útmutató. Medition Kiadó, Budapest, 2007.
- Heidrich H. Functional vascular diseases: Raynaud's syndrome, acrocyanosis and erythromelalgia. Vasa, 39 (2010), 33–41.
- Herrick AL. Pathogenesis of Raynaud's phenomenon. Rheumatology (Oxford), 44 (2005), 587-596.
- Takáts A, Garai I, Papp G, Hevér T, Csiki E, Csilla A, Csiki Z. Raynaud-szindróma. Orv Heti, 153 (2012), 403-409.
- Takáts A, Garai I, Papp G, Hevér T, Csiki E, Csilla A, Csiki Z. Raynaud-szindróma. Orv Heti, 153 (2012), 403-409.
- Kaheleh B, Matucci-Cerinic M. Raynaud's phenomenon and scleroderma. Dysregulated neuroendothelial control of vascular tone. Arthritis Rheum, 38 (1995), 1–4.
- Edwards CM, Marshall JM, Pugh M. Cardiovascular responses evoked by mild cool stimuli in primary Raynaud's disease: the role of endothelin. Clin Sci, 96 (1999), 577-88.
- Bukhari M, Herrick AL, Moore T, Manning J, Jayson MIV. Increased nailfold capillary dimensions in primary Raynaud's phenomenon and systemic sclerosis. Br J Rheumatol, 35 (1996), 1127-31.
- Al-Allaf A-W, Belch JJF. Raynaud's phenomenon. In: Rheumatology, 3rd edn. Ed.: Hochberg MC, Silman AJ, Smolen JS, Elsevier, Edinburgh, 1507-1512, 2003.
- Freedman RF, Girgis R, Mayes MD. Endothelial and adrenergic dysfunction in Raynaud's phenomenon and scleroderma. J Rheumatol, 26 (1999), 2386-8.
- Reilly IA, Roy L, Fitzgerald GA. Biosynthesis of thromboxane in patients with systemic sclerosis and Raynaud's phenomenon. Br Med J, 292 (1986), 1037-9.
- Kallenberg CGM, Vellenga E, Wouda AA, The TH. Platelet activation, fibrinolytic activity and circulating immune complexes in Raynaud's phenomenon. J Rheumatol, 9 (1982), 878-84.
- Lau CS, O1Dowd A, Belch JJF. White blood cell activation in Raynaud1s phenomenon of systemic sclerosis and vibration white finger. Ann Rheum Dis, 51 (1992), 249–52.
- Herrick AL, Matucci Cerinic M. The emerging problem of oxidative stress and the role of antioxidants in systemic sclerosis. Clin Exp Rheumatol, 19 (2001), 4-8.
- Baumkahel M, Böhm M. Recent achievements in the management of Raynaud's phenomenon. Vasc Health and Risk Manag, 6 (2010), 207-214.
- Thompson AE, Pope JE. Calcium channel blockers for primary Raynaud's phenomenon: a meta-analysis. Rheumatology (Oxford), 44 (2005), 145-150.
- Teh LS, Manning J, Moore T, Tully MP, O'Reilly D, Jayson MI. Sustained-release transdermal glyceryl trinitrate patches as a treatment for primary and secondary Raynaud’s phenomenon. Br J Rheumatol, 34 (1995), 636-641.
- Stosić-Grujicić S, Maksimović D, Badovinac V, Samardzić T, Trajković V, Lukić M, Mostarica Stojković M. Antidiabetogenic effect of pentoxifylline is associated with systemic and target tissue modulation of cytokines and nitric oxide production. J Autoimmun. 16 (2001), 47-58.
- Schiopu E, Hsu VM, Impens AJ, Rothman JA, McCloskey DA, Wilson JE, Phillips K, Seibold JR. Randomized placebo-controlled crossover trial of tadalafil in Raynaud's phenomenon secondary to systemic sclerosis. J Rheumatol, 36 (2009), 2264-2268.
- Wang WH, Lai CS, Chang KP, Lee SS, Yang CC, Lin SD, Liu CM. Peripheral sympathectomy for Raynaud's phenomenon: a salvage procedure. The Kaohsiung Journal of Medical Sciences, 22 (2006), 491-9.
- Kenyeres P, Juricskay I, Tarsoly P, Kesmarky G, Mühl D, Toth K, Bogar L. Low hematocrit per blood viscosity ratio as a mortality risk factor in coronary heart disease. 38 (2008), 51-56.
- Baskurt OK: Mechanisms of blood rheology alterations, in: Handbook of Hemorheology and Hemodynamics, Baskurt OK, Hardeman MR, Rampling M W, Meiselman HJ, eds, IOS Press, Amsterdam, 170-190, 2007.
PAPP JUDIT1, BÓTOR DÁVID1, SÁNDOR BARBARA1, TÓTH ANDRÁS1, BIRÓ KATALIN1, CSERNUS ZITA2, TÓTH KÁLMÁN1, KÉSMÁRKY GÁBOR1
Érbetegségek: 2013/2. - 33-39. oldal


