Ma már ismert a thrombocyták pathofiziológiai szerepe az arteriosclerolicus érbetegség kialakulásában és progressziójában. Az is elfogadott, hogy a thrombocyta aggregatio gátlása késlelteti a throniboticus szövődmények fellépését. Vizsgálataink során 60 érbeteget monitoroztunk egy hónapon keresztül. A betegeinket két csoportba osztottuk aszerint, hogy volt-e megelőző érmutét, vagy nem, illetve ezen beliil több helyen is előfordult-e az érszűkület.
A vizsgálatba azon érbetegek kerültek be, akiknél az első méréssel (MAI>2), hvperaggregabilitast találtunk. Ezt követően 100 mg acetilszalicilsavat szedtek a betegek, és vizsgáltuk a thrombocyta aggregatios rendszer és coagulatios rendszer több paraméterét.
Eredményeinket értékelve megállapítottuk, hogy az érbetegek többsége a megelőző műtéttől függetlenül is fokozott thrombocyta aggregatióval él. Mind a műtét előtt álló, mind az operált betegek gátló kezelésre szorulnak, és 100 mg acetilszalicilsav már az első hét napon belül eredményesen csökkenti a llirombocyták aktiválódását, és ezzel a thronibolicus rizikót.
Érbetegségek: 1998/4. - 145-150. oldal
KULCSSZAVAK
thrombocyta funkció, hyperaggregabilitas, acetilszali- cilsav, aggregatio gátlás
Bevezetés
A civilizált országok nagy részében népbetegségnek számító érszűkület műtéti kezelésében az intervencionális radiológia, valamint az egyre korszerűbb érprotézisek alkalmazása, az egyre tökéletesebb műtéti technikák lényegesen csökkentették a posztoperatív komplikációk arányát, növelve ezzel a végtagok megtarthatósági rátáját. A ma már közismert és széles körben alkalmazott trombózis profilaxis kísérletekkel és klinikai vizsgálatokkal alátámasztott módszerekkel történik az artériás rendszeren végzett különböző invazív beavatkozások után. Kevéssé ismertek és publikáltak azonban azon betegek alvadási paraméterei, akik még nem kerültek az operáló kés közelébe, "csak claudikálnak", vagy már nem operáihatók. Szükséges-e ezeket a betegeket is - a szintén már általánosan alkalmazott mikro cirkuláció javítása mellett - thrombosis profilaxisban és/vagy thrombocyta aggregatio gátló kezelésben részesíteni?
Pathológiás körülmények között fokozódik az endothelium áteresztőképessége, mely által beinduló folyamatok eredménye az arteriosclerosis kialakulása. Erről az irodalomban különböző elméletek léteznek. Jelen esetben a thrombogén elmélet játszik fontos szerepet. Az érfal belfelületén létrejövő mikrosérüléseken mikrothrombusok keletkeznek. E mechanizmus által létrejött koagulum kalcifikálódhat, bevérezhet, vagy el is tűnhet. Mindez jól jellemzi a vascularis remodellinget. (15, 21) Az így létrejött sclerotikus plakk belsejében macrophagok és lipophagok - módosult LDL révén - képesek újabb szöveti faktor szintézisre és felszabadításra, aminek thrombin lokális és masszív felszabadulása a következménye. A thrombin a legerősebb thrombocyta aktivátor, melynek újbóli keletkezését - intakt endothelen - ellenregulálő faktorok, mint pl. a "Tissue-Factor-Pathway-Inhibitor" ellensúlyozzák. Ez a folyamat a scleroticus endothellaesioban zavart. (16, 17)
Az arteriosclerosis mai szemléletében a megváltozott endothelstruktúrán és az alvadási plasmafaktorokon kívül a thrombocytáknak is fontos szerepük van, melyek aktiválódva aggregálódnak és az endothelen megtapadva a folyamatot lépcsőszerűen katalizálják. Az aktivált thrombocytákból különböző mediátorok szabadulnak föl:
- α-granulákból: P-selectin, thrombocyta növekedési faktor, fibrinogén, von Willebrand-faktor, V-faktor, fibronektin, (ß-thromboglobulin, 4-thrombocyta-faktor, thrombospondin.
- Az elektrodenz szemcsék termékei a serotonin, Ca-ionok, ADP és ATP,
- míg a lizoszomális szemcsékből savi-hydrolase válik szabaddá.
Élettani szempontból az endotheliumot mint önálló orgánumot kell szemlélnünk, mivel felépítő sejtjei egymással szoros kapcsolatban állnak. (8) Funkcionálisan pedig igen fontos anyagokat termel, illetve tárol: pl. Prostaglandin-I2 (PGI2), Antithrombin-III (AT-III), Interleukin-1 (IL-1) stb.
Az ép endothelből felszabaduló nitrogén-monoxid és prosztaciklin a kóros folyamatot fékezi, akárcsak az adenozin-difoszfátok. Abban az esetben, ha az endothel károsodik, mindezek termelése visszaszorul, aminek következtében a vérlemezkék aggregatioja során thrombus keletkezik. A fentiekből értelemszerűen következik, hogy pathologiás állapotok (érséríilés, stasis, thrombocyták aktiválódása) szükségessé teszik az antithrombotikus terápiát. Erre a gyakorlatban az alábbi lehetőségek kínálkoznak:
- heparin készítmények (Heparin, kis molekulasúlyú he- parin készítmények),
- heparinoid készítmények [Pentosan Polyszulfát (SP54)],
- kumarinszármazékok (Syncumar),
- haemodilutio,
- thrombocyta funkciójának gátlása.
Tulajdonképpen valamennyi módszerrel célunk a végső lépés, a thrombocyták aktivációjának megakadályozása, mivel a thrombus kialakulása ezek aggregációjának és adhéziójának következménye. A megfelelő ligandok és receptorok biztosítják a thrombocyták egymáshoz és az endoüielhez való kapcsolódását.
Fontosabb in vivo thrombocyta aktivátorok: az ADP, adrenalin, maga az adhézió, melyek képesek az arachidonsav (AS) release reakciót kiváltani. Az AS a ciklooxigenáz (COX) és thromboxánszintetáz enzimek thromboxán A2-t (TXA2) formálnak. A TXA2 kiüríti a denz granulumok termékeit, úgymint ADP, szerotonin, kalcium, ATP, anorganikus foszfátok és katekolaminok. Az ADP, szerotonin, adrenalin, thrombin és kollagén közvetlenül, másrészt az AS- TXA2 aktivációs úton keresztül képesek a GP Ilb/IIIa receptor expozícióját létre hozni. Az aktív GP Ilb/IIIa receptor természetes ligandja közül legfontosabb a fibrinogén. (11, 15.)
Módszerek a thrombocyta funkció gátlására
A fentiekből látható, hogy a thrombocyta funkció gátlásának legjobb módszere a végső közös lépés, azaz a GP llb/IIla receptív expozíció gátlása. Ennek több módja lehetséges:
A. Indirekt módszer:
- thromboxán szintetáz inhibitor és TXA2 receptor inhibitor együttesen. Pl. RIDOGREL.
- A ciklikus AMP (cAMP)-szint emelkedésével a GP IIb/IIIa receptor expozíciója gátolható egyrészt az adenilát cikáz működésének elősegítésével (PGE1) vagy a foszfodi- eszteráz gátlásával (METHYLXANTIN). (20.)
- A TICLOPIDIN a thrombocyták ADP rendszerén keresztül gátolja az aggregációt. Alkalmazására elsősorban szalicilát intolerancia esetén kerül sor. (9.)
- Az ACETILSZALICILSAV (ASA), mely a thrombocyták TXA2 képzését gátolja a COX enzim irreverzibilis bénításával, miközben az endothel PGI2 termelése nem sérül. (COLFARIT, ASTRIX, ASP1R1N.)
- Az RGD REPTIDEK, melyek természetben előfordulnak (pl. kígyómérgek formájában: trigramin, kistrin stb.)
B. Direkt módszer:
Az ABCIXIMAB, ami a GP Ilb/IIIa receptor ellen termelt ellenanyag, melynek Fc fragmentumát pepszines emésztéssel eltávolították, így a lép nem szűri ki.
Ezek alapján könnyen belátható, hogy valamennyi érbetegünk potenciálisan thrombosis veszélynek van kitéve. Ezen elmélet gyakorlati bizonyítása volt a célja annak a munkának, melyet részletesen ismertetünk. A vizsgálat megtervezése során a következő kérdésekre akartunk választ kapni:
- Észlelhető-e thrombocyta aktiválódás, hyperaggregabilitás alsóvégtagi érszűkületes betegekben?
- Van-e különbség a műtétre váró és operált betegekben az alvadási, aggregációs paraméterek és haemostatus tekintetében?
- Ha van thrombocyta aktiválódás, hyperaggregabilitás alsóvégtagi érszűkületes betegekben, akkor 100 mg acetil- szalicilsav kezelés hogyan befolyásolja ezt?
- 4. A thromboxán-B2 (TXB2), valamint a PG1-2 plazminogének mérésével meg akartunk győződni a készítmény szelektivitásáról.
- 5. Okoz-e szignifikáns változást a 100 mg-os acetilszalicilsav tartós szedése a koagulációs rendszerben?
A vizsgálandó betegek kiválasztása
A különböző súlyosságú alsóvégtagi keringészavarban szenvedő betegek, akik klinikailag három csoportba sorolhatók.
- Részletes anamnézis és fizikális vizsgálat során alsóvégtagi érszűkületes, Fontaine II. stádiumban lévő, nem operált betegek.
- Azon betegek, akiknél az arteriosclerosis multilocalisatio jelenléte klinikailag is nyilvánvaló (angina, stroke, AMI).
Miután eredményeinket értékelve e két első csoporton belül lényeges különbségeket nem találtunk, úgy a későbbiekben ezeket együtt nem operált csoportként kezeltük. - Alsóvégtagi érszűkület miatt műtéten (rekonstrukció és/vagy amputáció) átesett betegek csoportja. A későbbiekben operált csoportként említjük.
Beteganyag és módszer
Vizsgálatunkat a DOTE I. sz. Sebészeti Klinikáján végeztük. Összesen 60 érszűkületes beteget vizsgáltunk szűrő jelleggel hyperaggregáció irányában. Közülük 39 operált, 21 nem operált beteg volt.
Valamennyien érsebészeti szakrendelésünk gondozása alatt álltak. Átlagéletkoruk: 58 év. Közülük 49 férfi, 11 nő. Az alsóvégtagi érszűkület mellett multiplex localisatiot 20 betegben észleltünk.
Az anamnaestikus adatok alapján betegeink az alábbiak szerint oszlottak meg:
terhelő családi anamnesis: 23 betegben,
cukorbetegség 6 betegben,
magas vérnyomás 20 betegben,
kóros EKG görbe 12 betegben,
dohányzás 43 betegben,
rendszeres alkoholfogyasztás 29 betegben,
kóros lipid értékek (chol. > 5,7) 37 betegben.
Az átlagos claudicatios távolság 200 méter körül volt, de 11 betegben 100 méter alatt észleltük.
A vizsgálat menete
Az első vérvizsgálat során a 60 beteg közül 40-ben találtunk hyperaggregabilitást (MAI>2), így a továbbiakban csak őket vontuk be további vizsgálatba és csak ők szedtek gyógyszert. A 40 továbbkövetett érszűkületes beteg - akinél az első vérvizsgálat hyperaggregabilitást talált - napi 1 kapszula ASTRIX/100 mg acetilszalicilsavot szedett négy héten keresztül. A kezelés előtt (0. nap), a kezelés közben 1 hét után (7. nap), majd a kezelés végén (28. nap) végeztünk laboratóriumi vizsgálatokat.
Vizsgáltuk a thrombocyta aktivációs rendszert: multipa- rametrikus aggregációs index (MAI), diszaggregációs ráta (DR), egyéb induktorokkal végzett aggregációs vizsgálat (cöllagen 2 µ/ml) segítségével.
A koagulcitios rendszert csak a kezelés előtt és a végén vizsgáltuk: protrombin idő (Pl), parcialis thromboplasztin idő (PTI), trombin (TI), Fibrinogén.
A lipideket: cholesterin, triglycerid.
A vérképet: Hgb, Htc, thrombocyta szám.
A vizsgálatból azokat a betegeket zártuk ki, akik anamnaesisében ulcus betegség, allergiás hajlam, terhesség, szoptatás, alkoholizmus, vagy Ca-antagonisták, nem-szteroid gyulladáscsökkentők, heparin, kumarin származék, szalicilátok minimum két héten belüli szedése szerepelt.
A gyógyszert szedő és a vizsgálatba ezek után is bevont 30 beteg kezelése utáni laboratóriumi adatait táblázatokban összegeztük.
Módszer az aggregabilitas vizsgálatára
Megállapítható, hogy a legjobb egyénileg meghatározni a haszon/kockázat figyelembe vételével a megfelelő gátlószer adagolást. Így még kiszűrhetők azok a személyek, akik a genetikai polimorfizmusnak köszönhetően részleges vagy teljes ASA rezisztenciával rendelkeznek (7). Az egyéni érzékenység megállapítására, a vérlemezke elleni készítményekkel történő kezelés monitorozására, illetve diagnosztizálásra legalkalmasabbnak az aggregométerrel meghatározható multimetríkus aggregációs index (MAI) értékelése bizonyult. Igen érzékeny módszer, mely a kezelésben nem részesülő, ugyanazon betegekben ismételt meghatározás során közel azonos értéket mutat. A magasabb MAI érték fokozott in vitro thrombocyta aggregabilitást jelez.
Az in vitro thrombocyta aggregáció a következőképpen értékelhető:
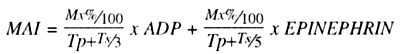
Tp: az induktornak az a legalacsonyabb koncentrációja (epinephrin, ADP µM-ban), mely alkalmas primer aggregációs hullám indukálására.
Ts: az induktornak az a legalacsonyabb koncentrációja (epinephrin, ADP µM-ban), mely alkalmas release reakcióra, szekunder irreverzibilis aggregációt eredményezve.
Mx%: a fény transzmisszió maximális százalékának századrésze az egyes induktorok optimális (2 és 10 µM) koncentrációnál. (4, 6.)
Az index értéke alapján kialakítható thrombocyta aggregábilitás kategóriák: (3)
- normoaggregábilis állapot (0.2-2),
- mérsékelt hyperaggregábilis állapot (2-5),
- közepes hyperaggregábilis állapot (5-10),
- erősen hyperaggregábilis állapot (10 felett).
Az egyedi monitorozás révén lehetőség nyílik az ASA- terápiára reagálók és nem reagálók kiszűrésére és hatástalanság esetén a terápia módosítására (12, 13).
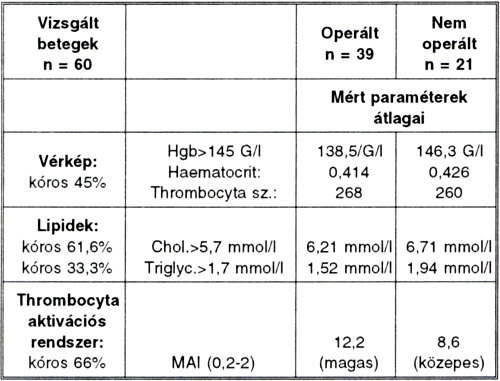
1. táblázat.
A vizsgálatba bevont betegek laboratóriumi paramétereinek megoszlása a kezelés előtt.
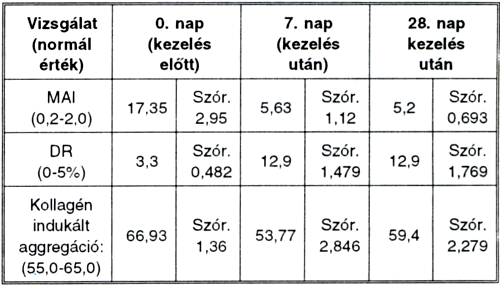
2. táblázat.
Aggregatiós paraméterek változása 100 mg. acetilszalicilsav szedése után. (A vizsgálatban bennmaradt, gyógyszerrel kezelt 30 beteg adatai.) Szór = szórás.
Eredmények
A vizsgálat befejezése után adatainkat feldolgoztuk, és a következő eredményeket kaptuk.
A 60 érbeteg kezelés előtti első vérvizsgálata során kóros értékeket mértünk a vérképben, mivel 45%-ban 145 mmol/1 fölötti haemoglobin és 0,4 1 fölötti haematocrit értéket találtunk. A thrombocytaszám mindkét csoportban a normál tartományban mozgott. Kóros, 5,7 mmol/1 fölötti széaim cholesterin értéket mértünk betegeink 61,6%-ában. Ehhez csak 33,3%-ban tartozott 1,7 mmol/1 fölötti szérum triglycerid érték.
Fokozott aggregabilitást (MAI>2) 66,6%-ban észleltük. Az operált csoportban ez a normál érték hatszorosát, a nem operált csoportban a négyszeresét haladta meg (1. táblázat).
A vizsgálatban a kizárások után 30 érbeteg maradt, akik egy hónapon át gyógyszert szedtek, az ő eredményeiket elemeztük tovább (2. táblázat).
A multiparametrikus aggregációs index (MAI) érték 17,35 volt a kezelés előtt, 5,63 az első hét után, majd 5,20 a 28. napon. Az eltérés p<0.01 szignifikáncia szint esetén szignifikáns, míg a 7. és 28. nap között már lényegesen nem változott.(2. táblázat.) A diszaggregációs ráta (DR) értéke a 0. napon 3,3%, 7. napon 12,9%, majd 28. napon 12,9% volt.
A különbség itt is szignifikáns p<0,01 esetén a gyógyszer alkalmazása előtt és után. A 7. és 28. napon mért értékek azonosak.
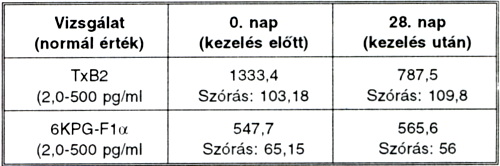
3. táblázat.
Thrombocyta aktivációs rendszer változása 100 mg acetilszalicilsav szedése után. (A vizsgálatban bennmaradt, gyógyszerrel kezelt 30 beteg adatai.)
A kollagén indukálta aggregatio során a 0. napon 66,93 a 7. napon 53,76 mértünk, 28. napon 59,4-nek bizonyult. P<0,01 esetén a gyógyszer szedése előtti és utáni értékek szignifikánsan különböznek, míg a szedés alatt nincs már különbség.
A thromboxan B2 (TxB2) mérése során a 0. napon 1333,4 pg/ml a 28. napon 787,53 pg/ml eredményt kaptunk. P<0,01 szignifikancia szintnél ezek is szignifikáns különbséget képeznek.
A 6KPG-Fly (prostacyclin) értéke 0. napon 547,06 pg/ml a 28. napon 565,6 pg/ml volt. Nem találtunk lényeges változást, ami a gyógyszer szelektivitását igazolja (3. táblázat).
A koagulációs rendszer vizsgálatánál a rendszer valamennyi paraméterét p<0,01 szignifikáncia szintnél vizsgálva nem találtunk különbséget a kezelés előtt mért adatokhoz képest. Hasonlóképpen nem változott a gyógyszer szedése alatt a lipidek értéke és a vérkép általunk vizsgált paraméterei sem.
Megbeszélés
Magyarországon népbetegségnek számít az érrendszer arteriosclerotikus megbetegedése, melynek legsúlyosabb szövődménye a thrombosis. A thrombusból származó embolusok is súlyos, sokszor maradandó károsodás forrásai lehetnek és legrosszabb esetben a beteg életét veszélyeztetik.
Az érelmeszesedés igen gyakran fordul elő az alsó végtagon. A megrepedő plakkra rakódó thrombusok olyan mértékben szűkíthetik az ér lumenét, hogy akár throphicus zavart okozhat a végtag distalis részén. A végtag megmentése érdekében végzett műtét tovább fokozza az aggregációra való hajlamot, mivel a sérült endothel újabb thrombogén felületként szolgál.
A thrombus kialakulásának gátlására, illetve a folyamat fékezésére több lehetőség is szolgál a gyakorlatban. Valamennyi módszerrel tulajdonképpen a célunk a thrombocyta funkciójának megakadályozása. A thrombus kialakulásáért felelős thrombocyta aggregatioban és adhézióban egyaránt lényeges szereplő a thrombocyták felületén elhelyezkedő GPllb/IIIa receptor. E receptor működését gátolhatjuk különböző módszerekkel.
Az ismertetett módszerek közül a klinikus és az alapellátás számára egyaránt legelérhetőbb, az egyik legeffektívebb és legolcsóbb gyógyszer az ACETILSZALICILSAV. Nézzük meg, hogyan hat ez a vegyület? (1. ábra.)
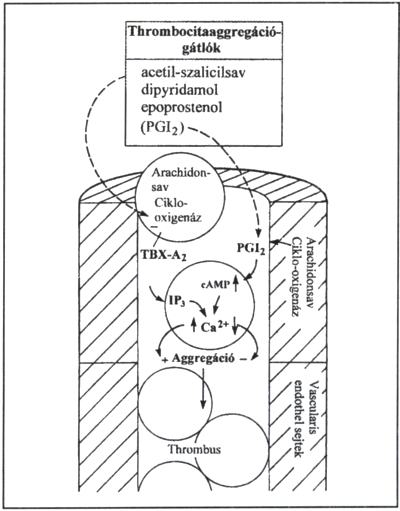
1. ábra.
Thrombocyta aggregatio gátlása sejtszinten.
Az acetilszalicilsav hatásmechanizmusát tekintve a COX irreverzibilis acetilálása révén jön létre. Ez az acetiláció megakadályozza az enzim (COX) és szubsztrát (AS) kötődését, mivel az acetilszalicilsav kovalensen kötődik a Ser530-hoz, ami tulajdonképpen nem a katalitikus centrum. Katalitikus szempontból fontos csoportnak a Tyr385 aminosavat állapították meg (23). A reakció következtében gátlódik a thrombocyta thromboxán szintézise.
A szintézishez szükséges COX enzimnek két izoformája van. A COX-1 folyamatosan termelődik, felügyeli a prosztaglandinok fiziológiás működést, szabályozza a helyi szöveti perfúziót, a hemosztázist és megvédi a gastrointestinalis traktus nyálkahártyáját.
A COX-2 citokinek, immunológiai stimulusok és növekedési faktorok hatására kezd el termelődni. Felel a gyulladásos folyamatokért, az immunreakciókért és a mitogenezisért. (19) Az acetilszalicilsav kb. 150-200-szor hatékonyabban gátolja a COX-1 izoformát. Ebből következik, hogy dózisfüggően cintithrombotikum (COX-1-re hatva) illetve gyulladáscsökkentő (COX-2). (10, 14.)
Legveszélyesebb mellékhatása a vérzés, ezért hipertóniában (200/100 Hgmm felett), vérző, vérzékeny vagy ulcusos beteg esetén célszerű minimális dózisban vagy kombinálva adni (22).
Az acetilszalicilsav optimális dózisát illetően még nem alakult ki egységes vélemény. Akkor megfelelő az adagolása, ha a szelektív dózisa a TXA-2 képzését kifejezettebben gátolja, mint az endothel prosztaciklin képzését. (5)
Egy 1983-ban végzett kísérlet szerint az ASA optimális dózisa napi 20-80 mg tartományban van. A vizsgálatok azt bizonyították, hogy ugyan kifejezettebb a TXA-2 gátlása, mint a prosztacikliné, de az alacsony ASA adagok kumulatív gátló hatást fejtettek ki a prosztaciklin képzésére. A vizsgálatot végzők az egyéni érzékenységben igen nagyfokú variábilitást tapasztaltak. A thromboembóliás betegek az egészségesekhez képest kisebb érzékenységet mutattak az ASÁ-val szemben.
Más kísérletek szerint napi 50-100 mg ASA adása után észleltek release zavart. Ezzel szemben 20 mg-nál a betegek közel felében változatlan volt a thrombocyta funkció.
Az egyhetes kis dózisú ASA (50-100 mg) hatása a vérlemezke funkciókra látványos volt: a vérzési idő megnyúlt, a thrombocyta aggregációs vizsgálatok során a thrombocyta releaseben zavart észleltek és jelentősen csökken a thrombocyták MDA képzése is (2).
A fenti kísérletek elméletileg megalapozták a vérlemezkék működésének szelektív gátlását: a thrombocyták COX enzime érzékenyebb az ASA acetiláló hatására, mint az érendothel COX enzime, másrészt a vérlemezke nem képes az acetilálás felfüggesztésére, sem új fehérje szintézisére, míg az endothel sejt órákon belül elkezdi az új enzim képzését (24).
Az általunk végzett vizsgálat bebizonyította, hogy az ér szűkületes populáció kétharmadának 4-6-szor olvadékonyabb a vére, mint az egészségeseké. A betegek csaknem fele haemoconcentrált is. 30-60%-ban fordul elő bennük emelkedett szérum zsírsavszint. A vizsgálatban résztvevő 60 betegnél figyelembe vettük a rizikófaktorokat, operált-e vagy sem, klinikailag igazolódott-e a multilokalizációs érszűkület, ha igen, annak lokalizációi. Figyelmünk az ASA (Astrix) hatékonyságára, szelektivitására és optimális dózisára is kiterjedt.
Az általunk követett labor paraméterek pozitív változása a kezelés szükségessége mellett szól. A thromboxán-B2 szintjének szignifikáns csökkenése változatlan prostacyclin szint mellett mindenképpen a készítmény szelektivitása mellett szól az alkalmazott dózisban. A kezelés alatt a koagulációs rendszerben szignifikáns változás nem történt. 2 beteg tett említést arról, hogy a gyógyszer szedése alatt járótávolsága nőtt, közérzete javult. A hosszú távú bypassát- járhatóság vizsgálata nem volt jelen munkánk célja.
Összefoglalás
Az alsó végtagi, illetve multilokalizációs érszűkületes betegekben már az esetleges későbbi műtétet megelőzően is jelentős hyperaggregabilitás mérhető. A 100 mg acetilszalicilsavval végzett (ASTRIX) kezelés első 7 napján is látványosan és eredményesen csökkenti a thrombocyták aktiválódását.
A gyógyszer alkalmazása alatt betegeinkben a claudicatios távolság csökkenését, vagy alsó végtagi panaszok fokozódását nem észleltük.
A kezelést megelőzően helyreállító érmiítéten átesett betegekben a bypass átjárhatóságának hosszú távú elemzésére a kezelés relatíve rövid időtartama miatt nem került sor.
Vizsgálatunk és az általunk kapott eredmények szerint megalapozott a betegeknél nemcsak post-, hanem már preoperatíve is elkezdeni a thrombocyta aggregatio gátlást az egyéb kóros paraméterek korrigálása mellett, mivel a multilokalizációs érbetegekben mérhető hyperaggregabilitás az operált egyénekben még kifejezettebb. Ezzel késleltethetjük a műtét előtt álló claudicaló érszűkületes beteg állapotának rosszabbodását, mely a relatív korai artériás thrombosis miatt következne be, másrészt egy viszonylag rosszabb kiáramlási pálya mellett növelhetjük a bypass-műtétek átjárhatósági rátáját, emelve ezzel az operált végtagok megtart- hatóságának arányát.
Irodalom
- Bán A.: Aktivált thrombocyták és thrombocyta aggregatio az atherosclerotikus endothelen. Patofiziológiás szemlélet és új therapias koncepciók. Orvosi Hetilap. 136/49: 2688-2689. (1995.)
- Boda Z.. Pfliegler Gy., Udvardy M.. Rák K.: Kis dózisú Aspirin hatása a vérlemezkék működésére coronaria-scleroticus betegekben. Magyar Belorvosi Archívum. 44: 19-24. (1991.)
- Bordánné Jenes E.: Az in vitro vérlemezke aggregáció tanulmányozása multiparametrikus aggregációs index segítségével. Laboratóriumi Diagnosztika, XXI. 4: 274-280. (1994.)
- Gazzaniga, P. P. Ferroni. P. el al.: A Multiparametric Index of Piatelet in vitro Aggregation in Cerebrovascular Disease. Ital. J. Neural. Sci. 8: 561-566. (1987.)
- Grotemeyer. K.H.: Der Eintluss der aspirindosis und des Do- sis-Intervalls aut' die Pláttchen-Reaktivitat. Plattchenfunktion und Gefasswand TM-Verlag: 187-197. (1989.)
- Ferroni. P., Gazzaniga, /P. P.: Evaluation of the Clinical Utilitiof Piatelet Aggregation Studies in the Long-Term Follow-Up of Patient with Atherosclerotic Vascular Disease. .J. of Clinical Laboratory Analysis, 6: 257-263. (1992.)
- Helgason. C. M.. Bolin. K. M.. Hoff, J. A.: Development of aspirin resistance in persons with previous ischemic stroke. Stro- ke 25: 2331-2336. (1994.)
- Káli A.: Vaszkuláris integritás és vaszkuláris remodelling. Érbetegségek, 1/2: 1-6. (1994.)
- Káli A.: Antithrombocyta gyógyszerek új lehetőségei a glocoprotein IIb/IIIa receptor-blokkolók. Cardioscan 1: 19-20. (1996.)
- Karsten. S..: Aspirin and platelets: The antipiatelet action of aspirin and its role in trombosis treatment and prophylaxis In.: Seminars in thrombosis and haemostasis Vol. 23: No. 4: 349- 356. (1997.)
- Kiss R.: Eredmények és lehetőségek a thrombocyta-gátló kezelésben. Orvosképzés, 68: 437-447. (1993.)
- Kyrle, P. A. Minar. E.. Brenner. B.. Eichler. H. G. et al.: Thromboxane A2 and prostacyclin generation in the microvas- culature of patients with atherosclerosis-effect of low-dose aspirin. Thromb. Haemostasis, 61: 374-377. (1989.)
- Misselwitz. F.. Norden. C.. Heine. H.: Individually controlled aspirin in the long-term treatment of patients with chronic ar- terial disease. Angiology 40: 464-471. (1989.)
- Mitchel. .J. A.. Akarasercenont. P.. Thiemennann. C.. Flower. R. J.. Vane. .J. R.: Selectivity of nonsteroidal antiinflammatory drugs as inhibitors of constituve and inducible cyclooxigenase. Proc. Natl. Acad. Sci. USA 90: 11693-11697. (1993.)
- Monos E.: Az érrendszeri krónikus adaptáció mechanizmusai. Érbetegségek 4/3: 1-6. (1997.)
- Moore. S.: Die Rolle der Plattchen in den frühen Stadien der Arteriosclero.se. Plattchenfunction und Gefasswand TM-Ver- lag: 9-21. (1989.)
- Müller. T. H.. Rühr. K. Eisert. W. G.: Wechselwirkungen von Thrombozyten im Vollblut mit subendothelialer Mátrix: Wir- kungen von Acetylsalicylsaure und Dipiridamol ex vivo. In: Plattchenfunktion und Gefasswand TM-Verlag: 61-69 (1989.)
- Neal. M. J.: Véralvadásra ható szerek. In: Rövid farmakológia. Springer Verlag: 46-47. (1996.)
- Otto. J. C.. Smith, J. W.: Prostaglandin endoperoxide syntheta- ses - 1 and - 2. J. Lipid Med. 12: 139-156. (1995.)
- Pfliegler Gy.. Bas El-Gamal: Thrombocytákba zárt prostacyclin (Iloprost) hatása az adhézióra és az aggregációra kollagénen és sérült aortán in vitro, valamint angioplasztikát követően in vivo. Magyar Belorvosi Archívum, 6: 453-459. (1994.)
- Ross. R.: Hypothesis of atherogenesis In.: Schlant R. C., Alexander R.. The Heart, arteries and veins. 8. Ed. Mc-Graw-Hill Inc. Health Professions Divison New York St. Louis. San Eransisco: 994-1008.
- Sas G.: Az aszpirin-dilemma mai állása. Gyógyszereink. 33: 398-405. (1983.)
- Shimokawa, T., Kulmacz. R. J., Tyrosine 385 of prostaglandin endoperoxide-synthase is requiied for cyclooxigenase cataly- sis J. Biol. Chem., 265: 20073-20076. (1990.)
- 24. Sinzinger. M., Virgolini, I., Deskar, A.: Optimál dose of aspirin as antithrombotic agent Thromb. Haemostasis. 62: 24-28. (1989.)
Dr. Olvasztó Sándor
DOTE I. sz. Sebészeti Klinika
4026 Debrecen, Bethlen u. 39.
Érbetegségek: 1998/4. - 145-150. oldal


