Az alsó végtagi nagyérműtétek során a posztoperatív szövődmények két csoportra oszthatók: lokális és szisztémás kórfolyamatokra. Az előbbiek közvetlenül az ischaemiás-reperfúziós (IR) károsodás következményei, ami az izomszövet funkciójának csökkenéséből, izomsejt necrosisból, rhabdomyolysisből, valamint a folyamatok végeredményeként létrejövő compartment-syndromából áll. Számos gyógyszerkészítmény került kifejlesztésre, és sebésztechnikai módszerekkel is sikeres próbálkozások történtek. Az IR károsodások kórtani hátterét és a gyulladásos folyamatok csökkentését eredményező klinikai alkalmazásokat hivatott jelen közleményünk összefoglalni. Bemutatásra kerül az IR károsodások morfológiai, celluláris és subcellularis háttere, illetve ezen károsodások mértékét csökkentő sebészi és nem sebészi eljárások jelenleg rendelkezésre álló tárháza, úm. különböző farmakológiai előkezelések, „gradual, staged” reperfúzió, kontrollált reperfúzió, ischaemias pre-, és postconditionálás.
Érbetegségek: 2009/4. - 113-120. oldal
KULCSSZAVAK
ischaemia, reperfúzió, ischaemia-toleracia, endotheldiszfunkció, ischaemiás preconditionálás, ischaemias postconditionálás.
Alsó végtagi nagyérműtétek során az operálandó erek, így az általuk ellátott igen nagy tömegű alsó végtagi izomzat is kirekesztésre kerülnek a keringésből. A kirekesztés alatt az izomszövet ischaemiás károsodást szenved. A sejtek életben maradásához elengedhetetlen - az adott szerv ischaemia-toleranciájának megfelelő időn belül - a vérkeringés és az oxigenizáció helyreállítása. Ismert tény ugyanakkor, hogy paradox módon az anaerob metabolizmusra áttért sejtek reperfúziója újabb károsodást okoz ezen sejtekben. Az ischaemiás-reperfúziós (IR) károsodás mértéke alapvető meghatározója a kirekesztett szerv posztoperatív regenerációjának, a műtét kapcsán megjelenő komplikációknak, így a betegek életkilátásainak. Jelen közlemény célja, hogy bemutassa az alsó végtagi IR károsodás lokális hatásait, mind cellularis, mind subcellularis szinten, illetve egy összefoglaló áttekintést adjon a jelenleg elérhető, a károsodás mértékének csökkentését célzó eljárásokról.
Az ischaemia-reperfúzió során fellépő károsodások következményei lokális és szisztémás szinten jelennek meg. Az izomszövet lokális károsodását több tényező is okozhatja. Egy szerv ischaemia-toleraciája változik a szövetek természetével, illetőleg a collateralis keringés meglététől is függ. A humán harántcsíkolt izomszövet tolerancia ideje kb. 4 óra (1). A sejtekben létrejött károsodások egy része az ischaemia ideje alatt visszafordíthatatlan jelenségként lép fel, egy másik része viszont a reperfúzió során a már említett paradox károsodás eredményeként jelenik meg. Az ischaemiás sérülés lényege, hogy csökken az ionhomeostasis fenntartáshoz szükséges energia. Kiürülnek a nagy energiájú foszfát-raktárak, károsodnak a membránfunkciók, az enzimrendszer zavara végül sejthalálhoz vezet. A mikrocirkuláció és homeostasis finom egyensúlya megbomlik. Az ischaemia következtében anaerob folyamatok indulnak el az izomszövetben, melyek hatására acidosis alakul ki. A membránfunkciók sérüléséből fakadóan a Na+/K+-pumpa működése is zavart szenved, mely következményeként Na+, vele párhuzamosan víz beáramlás, sejtduzzadás indul meg, ezzel egyidejűleg K+ kiáramlás észlelhető. A pumpa további hatására megemelkedik a lokális protonkoncentráció, ami serkenti a Na+/H+-antiporter 1-es típusát (NHE-1), mely egy H+-t szállít kifelé a sejtből egy Na+-ért cserébe. Ez nettó Na+- felhalmozódást jelent intracellulárisan, mely lelassítja a Na+/Ca++-kicserélő rendszert, sőt meg is fordíthatja működésének irányát, ennek hatására Ca2+ áramlik a sejtbe. Az intracelluláris Ca2+ megemelkedésének több következménye is van: (1.) A megnövekedett intracelluláris Ca2+-koncentráció kontrollálatlan izomösszehúzódásokhoz vezet, mely összefüggésbe hozható a sejtek necrosisával. (2.) A mitochondrium felveszi a beáramlott Ca2+ egy részét. A megnövekedett mitochondriális Ca2+ szint oxidatív stressz jelenlétében az mPTP nevű nem specifikus óriáscsatorna megnyílásához vezet, ezen körülményeket a reperfúzió korai szakában figyelhetünk meg (2). Ez a csatorna teljesen felborítja a belső membrán szigorúan szabályozott szelektív permeabilitását, mely a mitochondrium duzzadását okozza, a protongrádiens megszűnik, ez szétkapcsolja az oxidatív foszforilációt. A csatornának szerepe van a necrosis, ill. apoptosis pathogenesisében, és kulcstényező lehet a reversibilis és irreversibilis sejthalál, illetve az apoptonecrosis közti váltásban. Végeredményben az egész sejt intracelluláris organizációja felbomlik.
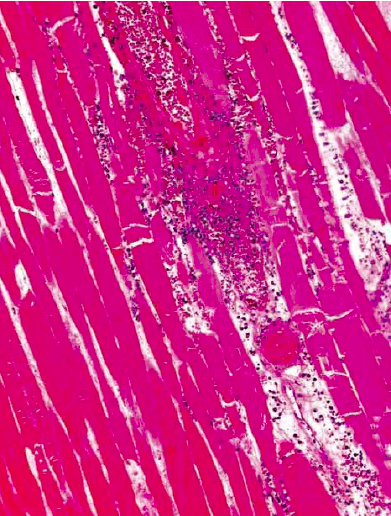
1. ábra:
Infrarenális aorta abdominalis 3 órás kirekesztését követő 1 napos kifejezett gyulladásos szöveti reakciók, neutrophil infiltrációval a m. rectus femorisban, patkány modellben. HE festés 200x nagyítás
Morfológiailag ezek a változások rutin festési eljárással a folyamat csak egy viszonylag későbbi időpontjában detektálhatóak, amikor a subcelluláris folyamatok jelentős része már lezajlott (1. ábra). A morfológiai elváltozások között említhető a sejtek duzzadása, karyopicnosis, karyorrhexis, a sejtek széttöredezése, valamint - izomszövet esetén - a harántcsíkolat elvesztése.
Az ischaemiás-reperfúziós károsodás nem csak a szöveti - jelen esetben izom - sejteket érinti, hanem az endothel sejteket is. Subcelluláris károsodások jelentkeznek, úm: az energiaraktárak kiürülése, egyes bioaktív anyagok csökkent produkciója (pl. prosztaciklin, NO), és más anyagok fokozott képződése (pl. endothelin, tromboxán A2), illetve a sejtek felszíni molekuláinak megváltozása (pl. P-selectin megjelenése). Ezzel egy időben a traszkripció szintjén is változások játszódnak le a hypoxiás sejtekben, egyes gének indukálódnak (pl. adhéziós molekulák, citokinek), míg mások szuppresszálódnak (pl. cNOS, thrombomodulin) (3). A paradox módon „gyógyító” hatást hozó reperfúzió a folyamat progresszióját okozza. Morfológiailag megfigyelhető az endothel sejtek elemelkedése a bazális membránról, és aktivált, elsősorban neutrophil granulocyták kitapadása az sejtek felszínéhez. Összefoglalóan a folyamatot az endothel sejtek dysfunctiojának nevezzük.
Az elhalt sejtekből kiszabadult intracitoplazmatikus komponensek, valamint - főként a venulák területén létrejövő - az endothel dysfunctio a továbbiakban gyulladásos folyamatokat indítanak be. Ennek fő elemei a leukocyták érfalhoz való adhesiója, transendothelialis leukocyta-migráció, vérlemezke-fehérvérsejt aggregáció, albumin-extravasatio, és fokozott reaktív szabadgyök felszabadulás. A válaszreakció létrehozásában a lokálisan szintetizálódott citokineknek (pl. TNFá, IL-1, IL-6) is nagy szerepe van. A postcapilláris venulákkal szomszédos interstitialis területen elhelyezkedő mastocyták és macrophagok szintén aktiválódnak az IR-károsodás kapcsán, szerepük van a gyulladásos reakció amplifikációjában és környező szövetek közé való terjesztésében. A nagymértékű leukocyta migráció és kitapadás a kapillárisokban, amihez hozzájárulhat még a vörösvértestek összetapadása, a kialakuló microthrombusok és a megnövekedett extravasculáris nyomás a reperfúzió alatt lokálisan a véráramlást megnehezítheti, így az úgynevezett „no-reflow” jelenség keretében a lokális ischaemiát prolongálhatja (2. ábra).
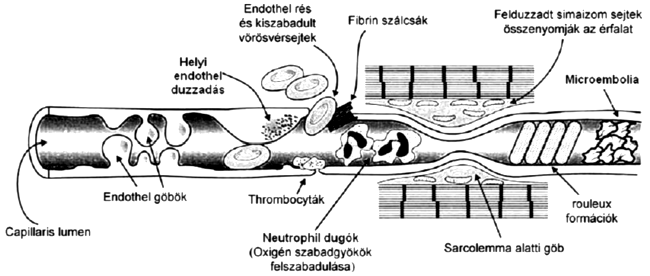
2. ábra:
Az ábra az ischeamiás reperfúziós károsodás kapillárisokra gyakorolt hatását szemlélteti.
Legnagyobb jelentőségű sejtszintű válasz a reaktív oxigéngyökök fokozott képződése, melyhez hozzájárul a granulocytákban a gyulladás hatására indukálódott iNOS enzim, illetve a NO csökkent felszabadulása az endothel sejtekből. Az IR megváltoztathatja a NO és szuperoxidok termelése közti egyensúlyt, ennek következménye lehet az arteriolák relaxációs zavara, valamint a venulákban lejátszódó gyulladásos válasz. A ma leginkább elfogadott nézet szerint normál körülmények között a NO-képződés mértéke messze meghaladja a reaktív szabad gyök felszabadulás ütemét. Ez lehetővé teszi, hogy a NO a./ hatékonyan pufferolja, megkösse a minimális mennyiségű intracelluláris szabad gyököket, b./ csökkentse az arteriolák tónusát a simaizomzat guanilát-cikláz aktivációján keresztül, c./ megakadályozza a vérlemezkék aggregációját és thrombus képződését, végül, d./ minimálisra csökkentse az adhezív interakciókat a leukocyták és az endothel sejtek felszíne között.
Ezzel szemben ischaemia után, a reperfúzió első perceiben az egyensúly hamar felborul és a szuperoxidok oldalára billen. Ebben szerepet játszik mind az excesszív szabadgyökképződés (endothel és fehérvérsejtek részéről egyaránt), mind a NO-termelés csökkenése. A maradék kevés termelt NO szabad gyökökkel reagál, ezáltal nem tudja kifejteni említett jótékony hatásait, sőt igen agresszív NOO- képződik belőle szabadgyökök jelenlétében.
A szuperoxid a későbbi folyamatok során tovább alakulhat hidrogén-peroxiddá. A két reaktív oxigéngyök (O2 -, H2O2) hatására nagy sebességgel kialakul a gyulladásos válasz a venulákban. Ennek mechanizmusában a következő folyamatok szerepelnek:
A. Foszfolipáz aktiváción keresztül a PAF (thrombocyta- aktiváló faktor) termelése fokozódik.
B. Complement-aktiváció és -lerakódás történik az endothel sejtek felszínén.
C. P-szelektinek helyeződnek ki az endothel-sejtek felszínére.
A szabad gyökök hosszú távon serkentik egyes adhéziós molekulák (E-szelektin, ICAM-1) génátírását, fenntartva a leukocyta-endothel kapcsolatot órákkal a reperfúzió után is. Ezen folyamatok hatására szöveti ödéma képződik, mely ronthatja a szövet véráramlását, és a szöveti hypoxia hosszabb idejű fenntartásához járulhat hozzá. Az alsó végtagon a fasciarekeszek zártsága miatt az ödéma és a sejtek intracelluláris duzzadása egy speciális helyzethez vezet, mely sokkal súlyosabb myopathiát okozhat egy fasciarekeszekbe nem szorított ischaemiás-reperfúziós modellhez képest. Ezt a folyamatot a klinikumban compartment-syndromaként ismerjük.
Alsó végtagi compartment-syndromáról beszélünk, ha az adott fasciarekeszben a nyomás annyira megnő, hogy a keringés romlása miatt az izomszövetek oxigénellátása elégtelenné válik (4). Klinikai diagnózisát hat vezető tünet alapján állíthatjuk fel:
- A végtagfájdalom aránytalanul nagy a sérüléshez vagy a végtag állapotához képest.
- Az izmok passzív nyújtása fájdalmas az adott compartmentben.
- A végtagizomzat paralysise vagy paresise jelentkezik az érintett rekeszben.
- Az adott compartment (területe) felett a bőr hypesthesiás vagy paraesthesiás.
- Az érintett compartment indurált, inflammált.
- A distalis pulzus csökkent vagy hiányzik.
A folyamat végeredménye az izomtömeg megnagyobbodása a zárt fasciarekeszben és az intracompartmentalis nyomás (ICP) fokozódása akár a kritikus 35–40 Hgmm-ig. Ilyen nyomás mellett a kapillárisok nutritív funkciója megszűnik, az izom perfusiója elmarad. Amennyiben ezt az öngerjesztő folyamatot dekompressziós fasciotomiával nem szakítjuk meg, az ischaemiás események tovább folytatódnak, egészen az irreverzibilis elváltozások kialakulásáig (5,6), végül a végtag elvesztéséhez vezetnek.
Mind az állatkísérletben létrehozott alsó végtagi ischaemia, mind nagyobb verőeres érsebészeti műtétek, mind kiterjedtebb trauma után megemelkedik a plazma TNF-á, ill. IL-6 koncentrációja, tehát egy szisztémás gyulladásos reakció veszi kezdetét (7, 8). Ezen citokinek felszabadulása adaptív védelmi mechanizmus, az akut fázis reakció elindításával előnyös a szervezetre nézve, a károsodást követő túlélést szolgálja. Kevésbé ismert mechanizmusok révén, illetve egy ponton túl azonban a folyamat kontrollját veszti, túlzott mértékben képződnek a gyulladásos citokinek, mely azután SIRS-hez (systemic inflammatory response syndrome), majd MODS-hoz (multiple organ dysfunction syndrome) vezetnek. Ezt támasztja alá, hogy kedvezően alakulnak a posztoperatív szövődmények szteroidok, immunmodulánsok, anticitokin antitestek alkalmazása során. A SIRS és a MODS mortalitása még a mai fejlett intenzív ellátás ellenére is nagyon magas.
Az ischaemiás-reperfúziós károsodás súlyos következményeinek felismerése után születtek az első elképzelések a különböző terápiás lehetőségekről, melyek főleg a károsodás mértékének csökkentésére törekednek, hiszen ezzel a szövődmények kialakulásának valószínűsége is mérsékelhető. Számos gyógyszerkészítmény került kifejlesztésre, és sebésztechnikai módszerekkel is sikeres próbálkozások történtek.
IR károsodást mérséklő nem sebészeti eljárások:
1. Hypothermia és szöveti perfúzió konzerváló oldatokkal való kombinációja során az alsó végtagi kirekesztéseket, embolectomiát követően a hypoxiás szöveteket először, gyakran hűtött heparinos fiziológiás sóoldattal perfundálva csökkentehető az IR károsodás (9).
2. Farmakológiai előkezelések során számos farmakológiai és immunológiai hatóanyagot próbáltak már ki az IR-károsodás mérséklésére, ennek ellenére a perifériás keringésfokozók kivételével ezidáig egyik sem került be a rutin klinikai gyakorlatba. Fő terápiás célpont a szuperoxid gyökök szintjének mérséklése, ill. a neutrophil migráció-, és adhézió gátlása. A következőkben a teljesség igénye nélkül bemutatunk néhányat a legjelentősebb ilyen kezelések közül:
- Antikoaguláns kezelés, - érsebészetben az optimális antikoaguláció szükségessége egyértelmű. Az antithromboticus profilaxis/terápia célja viszont a primer, vagy szekunder thrombosis, ill. thromboembolia megelőzése, a thrombosis kiterjedésének gátlása, ritkábban a trombolyticus kezelés. Érkirekesztések kapcsán fontos hatása, hogy a mikrocirkulációra nézve is protektív, mert az ún. no-reflow jelenséget is csökkenti a leukocyta-endothelium interakció, a thrombocyta-aggregáció és a mikrotrombusok kialakulásának megakadályozásával (10).
- Leukocyta-gátlás: A reperfúziós károsodás tekintetében kedvező eredmények olvashatók különböző kísérleti modellben alkalmazott leukocyta-endothel adhéziót gátló vegyületek, antitestek (anti-Mo1, anti-CD11b, anti- CD18) használatáról (11).
- Szabadgyökfogó vegyületek, antioxidánsok: Régóta ismert, és kedvező hatású terápiás megközelítés az IRkárosodások mérséklésére a szabadgyökfogó vegyületek alkalmazása. Az A-, C-, E-vitaminok antioxidáns hatással is rendelkeznek. Önmagukban nem annyira hatékonyak, mint a szabadgyökfogó vegyületek, de együtt alkalmazva ezeket a vitaminokat, illetve más farmakológiás szerrel (pl. iloprosttal, mely egy prosztaciklin-analóg (12)), képesek szinergistaként jobb hatásfokkal csökkenteni az IRkárosodást (13). Az allopurinol, a xantin-oxidáz nonkompetitív gátlószereként csökkenti a ROS-képződést (14).
Fontos, hogy az oxigéntartalmú szabad gyökök gátlásával lehetőség nyílik a következményes folyamatok gátlására is, mint pl. a leukotriének, thromboxán szintézise, ezzel meg lehet akadályozni a neutrophilek akkumulációját a célszervben és a távoli szervekben egyaránt (15). - Értágítók: Elterjedt módszer a végtagi ischaemia, obliterativ atheroclerosis kezelésében, ill. ezen betegek műtéti premedicatiójában a különböző vazodilatátorok használata (16, 17, 18, 19, 20). Konzervatív kezelésként enyhítik a betegek panaszait, és lassítják a betegség progresszióját.
- A vér rheológiai tulajdonságaira ható szerek: a vér kóros rheológiai tulajdonságainak (viszkozitás, súrlódás) előnyös befolyásolásával fejtik ki hatásukat (21). A vér reológiai korrekcióját szolgálja nem farmakológiás terápi- aként az isovolaemiás haemodilutio (22). Áttételesen szintén a vér rheológiai tulajdonságainak befolyásolásán fejtik ki hatásukat az alvadásgátlók és az arteriosclerosisban alkalmazott szerek is.
- A vér alakos elemeire ható szerek: A thrombocytaaggregációt gátló, valamint a vörösvértestek alakváltozását befolyásoló szerek sorolhatók ide (23 ,24, 25).
Az IR károsodást mérséklő sebészeti eljárások közé tartozó technikák egy része, mintegy előkészíti a keringésből kirekesztett szerv nagyobb ischaemiás tűrőképességét (ischaemiás preconditionálás), míg más módszerek ("gradual, staged" reperfúzió, kontrollált reperfúzió és a postconditionálás) a műtét során az érkirekesztés felengedése után a kezdeti reperfúziós károsodás mérséklését veszik célba.
1. Fokozatos ("gradual, staged") reperfúzió
Alkalmazhatunk a kirekesztés után fokozatos, "óvatos" felengedést, amikor is a véráramlást fokozatosan állítjuk vissza a nulla szintről a "kontrollálatlan", autoregulációs szintre (26). Ez a módszer 30-60%-kal képes csökkenteni a szívizom-ischaemia után kialakuló infarktus kiterjedését. Ez az alsó végtagi verőér rekonstrukciók bevált napi módszere. Azonban a coronaria endothel-functiójára nincs kedvező hatással (27), ezen kívül a fokozatos felengedés további neutrophil accumulációval jár az ischaemiának kitett területen. Hátránya még, hogy nem szabályozható pontosan a felengedés mértéke az egyes kirekesztések során, még azonos operatőr esetében is változik a felengedés dinamikája, így hatásának mértéke széles határok között változhat.
2. Kontrollált reperfúzió
Az eljárás a kezdeti perfúzió egyes aspektusainak változtatásával próbálja kiküszöbölni, ill. enyhíteni a reperfúziós károsodásban szerepet játszó tényezőket. Kontrollált reperfúzió során az ischaemia végén nem rögtön kerül felengedésre a kirekesztés, hanem először, az első 30 percben a kirekesztéstől proximális érszakaszból vett, majd 6:1 arányban összesen mintegy 500 ml speciális összetételű oldattal hígított vér kerül beadásra a disztális, ischaemizált érszakaszba. A technikai kivitelezés tökéletesítése még napjainkban is folyik (28). A módszer további előnye, hogy kontrollálhatjuk a kezdeti perfúziós nyomást is. Ezt 60 Hgmm alatt tartva megelőzhető a postischaemiás ödéma kialakulása. A kontrollált reperfúzió alkalmazását myocardialis ischaemiánál írták le először (29), de használhatónak bizonyult alsó végtagi kirekesztés után is, sőt, ezen műtétek posztoperatív szövődményei, a reperfúziós szindróma súlyossága is mérsékelhetők kontrollált reperfúzióval (30). A módszer hátránya, hogy megvalósítása körülményes, az alkalmazásához új eszközök beszerzése szükséges, ami anyagilag is megterhelő, valamint az operatőrnek technikai nehézségekkel is szembe kell néznie, hiszen a technika még kísérleti stádiumban van.
3. ábra:
Az ischaemias preconditionalas folyamatábrája (43).
3. Ischaemiás preconditionálás
Egy szerv kirekesztése előtt, egy vagy több ciklusban alkalmazott rövid, ischaemiás-reperfúziós periódusokat ischaemiás preconditionálás (IP) néven ismerjük. (3. ábra) Védő hatását először 1986-ban Murry és munkatársai myocardiumban írták le (31). Megfigyeléseik szerint állatmodellben, a többszörösen, rövid ideig alkalmazott ischaemiás periódusok megóvták a szívizomzatot egy ezt követő hosszabb ischaemiás periódustól. Miután a módszer hatásossága kutyaszíven, majd más állatfajokon is igazolódott, 1993-ban megkezdődtek az első humán alkalmazások (32). Ezt követően hamarosan az eljárás hatásos voltát, illetve kísérletes alkalmazhatóságát vázizmokban, agyban, vesében, bélben és májban is felismerték (33). Az IP módszere ígéretes lehetőségnek bizonyult különböző szervek transzplantációja, illetve hosszan tartó, kirekesztéssel járó beavatkozások klinikai alkalmazása kapcsán. A pontos biokémiai, (pato)fiziológiai háttér megismerésével pedig lehetőség nyílik az egyes lépések farmakológiai befolyásolására is.
Alkalmazhatóságát egy fontos idő-függés jellemzi. IP során egy korai, három órán belül észlelhető, és egy késői, hosszútávú, 24 órán túl megjelenő hatás fejlődik ki ("second window of protection"). A kettő közötti időtartam viszont egy "védelem nélküli ablak". Az idő az általunk elindított biokémiai folyamatok kifejlődéséhez kell. Az állatkísérletekben nyert kitűnő eredmények ellenére az ischaemiás preconditionálás orvosi gyakorlatban való használhatósága meglehetősen szűk körű, ugyanis a beavatkozás szükségszerűen csak előre várható ischaemiás esemény kapcsán, vagy még inkább tervezett érkirekesztések előtt alkalmazható (pl. CABGbeültetésnél).

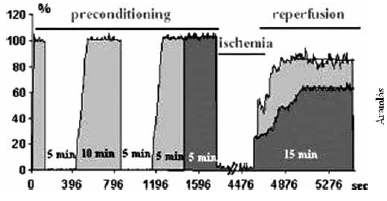
4. ábra:
Az ischaemias postconditionalas folyamata áramlási görbéken demonstrálva (44).
4. A postconditionálás
A postconditionálás meghatározása a reperfúzió kezdetén a szöveti véráramlás ismételt, rövid, több ciklusban alkalmazott megszakítása (4. ábra). Csak ezen ismételt ischaemiás-reperfúziós epizódokat követően jön létre a szerv szabad perfúziója. Az IR-károsodások jelentős része a reperfúzió kezdeti perceiben alakulnak ki, ill. ez az időintervallum az, amelyben a legtöbb folyamat beindul. Innen ered az elképzelés, hogy az ischaemizált szerv vérkeringésének helyreállítását módosítva talán kedvező hatást gyakorolhatunk a káros folyamatokra.
A postconditionálás koncepcióját először Vinten- Johansen fogalmazta meg 2002-ben. A témában született első közleményeket ugyanez a munkacsoport publikálta (34,35), összehasonlítva a postconditionálást az ischaemiás preconditionálás jól bevált cardioprotectív hatásával. Kutyában a postconditionálás az ischaemiás preconditionálással összehasonlítható mértékben csökkentette az infarktus méretét. A reperfúzió első pillanatai kritikusak abban, hogy a postconditionálás kifejthesse cardioprotectiv hatását, ha a postconditionálást 1 perccel később kezdjük a reperfúzió megindulása után, az infarktus-csökkentő hatást elvesztjük (36). A ciklusok száma sokkal kisebb szerepet játszik, mint a beavatkozás azonnali megkezdése (37). Ezzel szemben az időtartama egy-egy ciklusnak fontosabb a cardio- és vasculoprotectiv hatás szempontjából, mint a ciklusok száma (35,38), amit valószínüleg egy szerv metabolikus rátája határoz meg. Postconditionálás során tehát elengedhetetlen, hogy közvetlenül a reperfúzió legelején történjen, illetve fontos a megfelelően rövid ciklushossz. A kórfolyamat saját időfüggő mechanizmusába való beavatkozáshoz csak egy szoros időkeret áll a rendelkezésre.
Klinikai alkalmazhatóság terén a postconditionálás tűnik az alkalmazhatóbb módszernek, hiszen a szöveti ischaemia után hozható létre, tehát megfelelő eszközös háttérrel össze lehet kapcsolni tulajdonképpen minden revascularizációt célzó orvosi beavatkozással. Ígéretes lehetőségnek tűnik használata coronaria-elzáródást megszüntető angioplastica alkalmával, különböző szervtranszplantációkkor a szerv recipiens keringésébe való bekapcsolásakor, illetve minden vértelenségben végzett műtét során, így az alsó végtagi kirekesztéssel járó műtétek esetén is, a keringés visszaállításához kapcsolva.
Az IR károsodást mérséklő "hibrid" eljárás:
Farmakológia postconditionálás
Bármely beavatkozás, melyet a reperfúzióval egy időben vagy az előtt közvetlenül alkalmazunk, hatással lehet a reperfúziós károsodás eseményeire. Ez lehet mechanikai (mint pl. a postconditionálás ill. a fokozatos reperfúzió, vagy a lokális hypothermia), vagy pedig gyógyszeres. Számos farmakoterápiás próbálkozásról (pl. adenosin, inzulin, NO, statinok, opioidok) olvashatunk, ahol különböző anyagokkal kísérelték meg befolyásolni a reperfúzió eseményeit (39,40,41). Egyes források szerint a szöveti acidosis fenntartásával imitálni lehet a postconditionálás hatását. Klinikai gyakorlatban ez pl. coronaria-thrombosis PTCA-s thrombylysisével egyidőben, alacsony pH-jú, pl. magas CO2-tenziójú perfúziós oldat lokális katéteres adagolásával kivitelezhető. Vagy akár elképzelhető, hogy egyszerűen a reperfúzió megindulásakor a beteg CO2-dal dúsított gázkeverékkel való lélegeztetésével is megoldható a fenntartott szöveti acidosis (42).
Összefoglalásként elmondható, hogy az alsó végtagi verőérműtétek során a végtag IR-károsodást szenved, amely függ a kirekesztés idejétől és magasságától. Amennyiben ez a károsodás nagy mértékű, nem csak az adott végtag elvesztéséhez vezethet, hanem távoli szervi hatások is jelentkezhetnek (pl. veseelégtelenség, ARDS), melyek a lokális folyamatok generalizálódása során kialakuló SIRS, majd MODS következményei, és akár a beteg halálát is okozhatják. Ezért az IR-károsodások csökkentésének klinikai igénye nagy. Számos próbálkozás történt az ezt megcélzó módszerek kifejlesztésére, azonban ezek közül kevés az, amelyik a klinikai gyakorlatban is alkalmazható.
Klinikai szempontból a legalkalmasabb beavatkozási idő a reperfúzió kezdetekor kínálkozik, így azon eljárások lehetnek a legalkalmasabbak, amelyek ezt az időpontot célozzák meg. További fontos szempont a módszer kivitelezhetősége és sajnos az anyagi vonzata is. Tehát egy olyan technika tűnik a legalkalmasabbnak arra, hogy a klinikai gyakorlatban rutinszerű alkalmazására sor kerüljön, amely a reperfúzió kezdetén avatkozik be, kivitelezése egyszerű, kevés gyakorlás mellett is elsajátítható és kis anyagi terhet ró az alkalmazó intézményre.
Közleményünkben összefoglaltuk a jelenlegi ischaemiás-reperfúziós károsodást mérséklő eljárásokat, ezen módszerek nagy része azonban még kísérleti stádiumban van ezért rutinszerű alkalmazásuk előtt további kísérletek elvégzése szükséges, hogy megbizonyosodjunk alkalmasságukról. Ezen eljárások közül a postconditionálás tűnik a legalkalmasabb módszernek, hogy rutin klinikai alkalmazása során az IR-károsodás mértékét és rettegett szövődményeinek kialakulását érdemben mérsékelje, ezáltal csökkentve a posztoperatív mortalitást.
Irodalom
- Harman JW. The significance of lacal vascular phenomena in the production of ischemic necrosis in sceletal muscle. Am J Pathol. 1948; 24: 625-641.
- Crompton M. The mitochondrial permeability transition pore and its role in cell death. Biochem J. 1999; 341: 233–249.
- Davies MG, Juynh TTT, Hagen PO. Endothelial physiology. In Ischemia-Reperfusion Injury. In: Grace PA, Mathie RT (eds). Blackwell Science: London, 1999; 157-179.
- Matsen FA, Winquist RA, Krugmire RB. Diagnosis and management of compartmental syndromes. J Bone Joint Surg. 1980; 62: 286–291.
- Haimovici H. Myopathic-nephrotic-metabolic syndrome and massive acute arterial occlusions. Arch Surg. 1973; 106: 628–633.
- Haimovici H. Myopathic-nephrotic-metabolic syndrome and massive acute arterial occlusions. Arch Surg. 1973; 106: 628–633.
- Punzi L, Podswiadek M, Sfirso P, et al. Pathogenetic and clinical rationale for TNF-blocking therapy in psoriatic arthritis. Autoimmunity Review. 2007; 6: 524-528.
- Clark I. How TNF was recognized as a key mechanism of disease. Cytokine and Growth Factor Reviews. 2007; 18: 335-343.
- De Groot H, Rauen U. Ischemia-reperfusion injury: Processes in pathogenetic networks: A Review Transplantation Proceedings. 2007; 39: 481-484.
- Khalil AA, Aziz FA, Hall JC: Reperfusion Injury. Review. Plast Reconstr Surg. 2006; 117: 1024-1033.
- Simpson PJ, Todd RF III, Fantone JC, et al. Reduction of experimental canine myocardial reperfusion injury by a monoclonal antibody (anti-Mo1, anti-CD11b) that inhibits leukocyte adhesion. J Clin Invest. 1988; 81: 624.
- Bozkurt, AK. Alpha-tocopherol (vitamin E) and iloprost attenuate reperfusion injury in skeletal muscle ischemia/reperfusion injury. J Cardiovasc Surg. 2002; 43: 693.
- Bilgin-Karabulut, A., Ademoglu, E., Aydin, I., et al. Protective effects of vitamins A and E pretreatment in venous ischemia/ reperfusion injury. J Reconstr Microsurg. 2001; 17: 425.
- Rees, R., Smith, D., Li, T., et al. The role of xanthine oxidase and xanthine dehydrogenase in skin ischemia. J Surg Res. 1994; 56: 162.
- Welbourn CRB, Gideon G, Paterson IS, et al. Neutrophil elastase and oxygen radicals: synergism in lung injury after hindlimb ichemia. Am J Physiol Heart Circ Physiol. 1991; 260: 1852-1856.
- Sako H, Hadama T, Miyamoto S, et al. Effect of prostaglandin E1 on ischemia-reperfusion injury during abdominal aortic aneurysm surgery Surg Today. 2006; 36: 140-146.
- Emanuel MB, Will JA: Cinnarizine in the Treatment of Peripheral Vascular Disease. Mechanisms Related to its Clinical Action Proc R Soc Med. 1977; 70(Suppl 8): 7–12.
- Smith FB, Bradbury AW, Fowkes FGR: Intravenous naftidrofuryl for critical limb ischaemia. 2000; 2: CD002070
- Tóth E.: The effect of bencyclane on peripheral vascular diseases. 1970; 20 (10): 1430.
- Bieroń K, Swies J, Kostka-Trabka E, Gryglewski RJ. Thrombolytic and antiplatelet action of xanthinol nicotinate (Sadamin): possible mechanisms. J Physiol Pharmacol. 1998; 49(2): 241-249.
- Menanteau B, Gausserand F, Marcus C, et al. Pentosan polysulfate, adjuvant treatment in transluminal angioplasty of arteries of the legs. Presse Med. 1986; 15(5): 213.
- Poli de Figueiredo LF, Mathru M, Tao W, Solanki D, et al. Effect of prostaglandin E1 on ischemia-reperfusion injury during abdominal aortic aneurysm surgery. Surg. 1997; 122(1): 32-38.
- Quiroli A.: Short-term and long-term results of treatment of chronic arteriopathies of the lower limbs with nicergoline. Importance of intensive medical therapy. Minerva Cardioangiol. 1980; 28(12): 793-804.
- Collins P, Ford I, Greaves M, Macaulay E, Brittenden J. Surgical revascularisation in patients with severe limb ischaemia induces a pro-thrombotic state. Platelets. 2006; 17(5): 311-317.
- Haustein KO. State of the art-treatment of peripheral occlusive arterial disease (POAD) with drugs vs. vascular reconstruction or amputation. 1997; 35(7): 266-274.
- Okamoto F, Allen BS, Buckberg GD, Bugyi H, Leaf J. Studies of controlled reperfusion after ischemia. XIV. Reperfusion conditons: Importance of ensuring gentle versus sudden reperfusion during relief of coronary occlusion. J Thorac Cardiovasc Surg. 1986; 92: 613–620.
- Sato H, Jordan JE, Zhao ZQ, Sarvotham SS, Vinten- Johansen J. Gradual reperfusion reduces infarct size and endothelial injury but augments neutrophil accumulation. Ann Thorac Surg. 1997; 64: 1099–1107.
- Schlensak C, Doenst T, Bitu-Moreno J, Beyersdorf F. Controlled limb reperfusion with a simplified perfusion system. Thorac Cardiov Surg 2000; 48: 274-278.
- Allen BS, Buckberg GD, Fontan FM, Kirsh MM, Popoff G, Beyersdorf F, et al. Superiority of controlled surgical reperfusion versus percutaneous transluminal coronary angioplasty in acute coronary occlusion. J Thorac Cardiovasc Surg. 1993; 105: 864-884.
- Mitrev Z, Beyersdorf F, Hallmann R, Polokczek Y, Ihnken K, Herold H, et al. Reperfusion injury in sceletal muscle: controlled limb reperfusion reduces local and systemic complications after prolonged ischemia. Cardiovas Surg. 1994; 2: 737-748.
- Murry CE, Jennings RB, and Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 1986; 74: 1124-1136.
- Yellon DM, Alkhulaifi AM, and Pugsley WB. Preconditioning the human myocardium. Lancet 1993; 342: 276-277.
- LlorisCarsi JM, Cejalvo D, ToledoPereyra, et al. Preconditioning: effect upon lesion modulation in warm liver ischemia. Transplant. Proc. 1993; 25: 3303-3304.
- Zhao ZQ, Corvera JS, Halkos ME, Kerendi F, Wang NP, Guyton RA, Vinten-Johansen J. Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am J Physiol (Heart Circ Physiol). 2003; 285: 579–588.
- Halkos ME, Kerendi F, Corvera JS, Wang NP, Kin H, Payne CS, Sun HY, Guyton RA, Vinten-Johansen J, Zhao ZQ. Myocardial protection with postconditioning is not enhanced by ischemic preconditioning. Ann Thorac Surg. 2004; 78: 961–969.
- Kin H, Zhao ZQ, Sun HY, Wang NP, Corvera JS, Halkos ME, Kerendi F, Guyton RA, Vinten-Johansen J. Postconditioning attenuates myocardial ischemia-reperfusion injury by inhibiting events in the early minutes of reperfusion. Cardiovasc Res. 2004; 62: 74–85.
- Kin H, Zatta AJ, Lofye MT, Amerson BS, Halkos ME, Kerendi F, Zhao ZQ, Guyton RA, Headrick JP, Vinten- Johansen J. Postconditioning reduces infarct size via adenosine receptor activation by endogenous adenosine. Cardiovasc Res. 2005; 67(1): 124-133.
- Philipp SD, Downey JM, Cohen MV. Postconditioning must be initiated in less than 1 minute following reperfusion and is dependent on adenosine receptors and P13-kinase. Circulation. 2004; 110: III-168
- Vinten-Johansen J, Zhao ZQ. Cardioprotection from ischemic-reperfusion injury by adenosine. In: Abd-Elfattah AS, Wechsler AS (eds) Purines and Myocardial Protection. Kluwer Academic Publishers Boston, MA, 1995; 315–344.
- Johnson G III, Tsao PS, Lefer AM. Cardioprotective effects of authentic nitric oxide in myocardial ischemia with reperfusion. Crit Care Med 1991. 19: 244–252.
- Schultz JE, Gross GJ. Opioids and cardioprotection. Pharmacol Ther. 2001; 89: 123–137.
- Cohen MV, Yang X, Downey JM. The pH hypothesis of postconditioning. Staccato reperfusion reintroduces oxygen and perpetuates myocardial acidosis. Circulation. 2007; 115: 1895-1903.
- Szijártó A, Hahn O, Lotz G, Schaff Z, Madarász E, Kupcsulik P: Effect of ischemic preconditioning on rat liver microcirculation monitored with laser doppler flowmetry. Journal of Surgical Research 2006; 131: 150-157.
- Vinten-Johansen J, Zhao ZQ, Zatta AJ, et al. Postconditioning: A new link in nature’s armor against myocardial ischemiareperfusion injury. Basic Res Cardiol. 2005; 100: 295–310.
Dr. Szijártó Attila
Semmelweis Egyetem I. sz. Sebészeti Klinika
1082 Budapest, Üllői út 78.
+36-20-825-89-25
Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2009/4. - 113-120. oldal


