Amikor endothelről beszélünk általában, egynemű sejtpopulációra gondolunk. Azonban az érbelhártyát eltérő fajokban, eltérő szervekben, eltérő életkörülmények közt és eltérő helyzetekbcn találjuk. Ugyanazon fajon belül is eltérő endothel sejteket találunk a különböző érszakaszokat vizsgálva. Az endothel sejtek felszínén számos adhéziós, kommunikációs és egyéb molekula található meg egyedidejűleg. A megoldandó feladat, hogy a folyékony és gél állapotú vízterek közti határhelyzetben a folyton változó számos elvárásnak paralell eleget tudjon tenni. Ennek optimális ellátása végül a belső és külső környezeti hatásokra adott adaptív válaszban nyilvánul meg. Főbb hatáskörök: vasculáris homeosztázis, gyulladás, immunitás, vér-fluiditás.
Érbetegségek: 2003/4. 103-110. oldal
KULCSSZAVAK
endothel, funkció, molekuláris biológia
1. Bevezetés
Tágabb értelemben a medicina célja, hogy feltárja és alkalmazza azokat a feltételeket, szabályokat, melyek lehetővé teszik a sejtek és sejtrendszerek (szövetek), illetve a szervezet (az egyén) túlélését abban a magasabb szintű rendszerben, amit általában környezetnek szoktunk hívni. Cikksorozatunk a vízterek recirculáltatásának gondolatkörét tolmácsolja.
Úgy érezzük, erre nagy szükség van, mert a "publikációs kényszer" a vonatkozó részismeretek exponenciális mennyiségi bővülését eredményezte. Ugyanakkor ezt nem követte hasonló léptékű fejlődés az összefüggésrendszerre vonatkozó lényeglátásban (pontosabban annak publikációs gyakorlatában). Úgy tűnik, hogy a vasculáris medicina egésze - mint a célt és eszközét összekapcsoló szemlélet - légüres térbe került. Ezáltal a különböző részismeretek továbbra is csak elemenként léteznek. Ez sem klinikai, sem elméleti szempontból nem kedvező.
Értelmezésünk szerint az endothel sejtet - mint "állatorvosi lovat" - rivaldafénybe állítva jó esély van a diverz klinikummal bíró betegségek kórtani közös nevezőjének felkutatására. Munkánk során a hypertonia, a diabetes, a toxikus (alkoholos) angiopathia, az idült vénás megbetegedés (CVI) és az ischemia-reperfusiós károsodás mögötti közös motívumokra fókuszálunk.
2. Általános áttekintés
Miközben sejtjeink szerveződése (a szervezet) szárazföldi lényekké tett bennünket, addig egyes sejtjeink elemi életének közvetlen színtere továbbra is a víz.
Ez a víztér összetételében - például a Na+ koncentráció tekintetében - még ma is hordozza a lenyomatát annak az ősóceánnak, ahol pár milliárd évvel ezelőtt a lubickoló élet hódító útját megkezdte. A sejtek körül még ma is megtaláljuk az ősóceán kicsinyített változatát. A világegyetem meghódításában ez stratégiailag igen hasznos húzásnak bizonyult, mert a szervezet így bárhova magával viheti közvetlen életterét, s ezzel szinte bárhol életképessé is válik. Más megfogalmazásban: az extracelluláris mátrix (ECM) víztere egy organizált öntözőrendszer része, melyet sós vizű folyók táplálnak (vér-, illetve nyirokerek) és átemelő-keringető szivattyúk (a légzőkészülék, a szív és a vénás pumpa közösen!) tartanak mozgásban.
A hordozható, instant ősóceán kialakítását az a korszakos vívmány tette lehetővé, hogy a sejtek - immár szövetként szerveződve - egymás közelében maradtak, miáltal közvetlen környezetük folyékonyból gél halmazállapotúvá vált. Ez előnyös, mert nem akadályozza az oda-vissza oldódást a "külvilág" és a sejtek közt, ugyanakkor a részfolyamatok egy kijelölt eseménytérbe vannak belekényszerítve. Vagyis az adott élettér (a mátrix) felépítése elsősorban azoktól a sejtektől függ, akik ebben élnek.
Minél jelentősebb egy sejtcsoporton belül a feladatmegosztás - vagy egy szervre a speciális működés - annál többféle és annál bonyolultabb lesz az extracelluláris víztér. (Tehát az ECM, a keringető szivattyúk és az erek együttesen!)
Emberben ezt a félfolyékony életteret mindenütt (például a vénák falában is!) finom erek szövik át. Ennek elemi mintázata - kb. 200 µm-enként egy kapilláris - úgy értelmezhető, mint az oxigén diffúziós kapacitása (mint fizikai korlát) és az adott szövetre jellemző anyagcsere (mint gyakorlati igény) közti kompromisszum.
A funkcionális egységet nem a kapilláris maga, hanem ennek a prekapilláris arteriolával és a postkapilláris venulával alkotott triásza, mint anatómiai egység jelenti. Vagyis kb. 300 µm-enként találkozni fogunk egy prekapilláris arteriolával és egy postkapilláris venulával is. Amik nem egyszerű közlekedőedénykék. (Erről később még lesz szó!)
A zárt keringésű élőlények anyagcseréje bonyolult logisztikai és disztribúciós problémájának megoldására három vezetékrendszer - egy, a szöveti sejtek felé haladó és két, a szöveti sejtek felől jövő - fejlődött ki. A rendszerbe belső forrásból származó mechanikai energiát is be kell vinni - fenntartandó a folyadékáramlást biztosító nyomáskülönbséget. Ezt egyirányító billentyűk és izomköpenyek funkcionális egységei: a pumpák hozzák létre. A szervezet nettó anyagcsereigénye által megkövetelt keringési adaptációt a szív és a légzőkészülék, a fizikai aktivitáshoz kapcsolódó gyors kompenzációt a vénás pumpa látja el.
A szervezet minden (!) szervének minden(!) szövetében újra és újra felbukkanó hajszálérhálózatot belül endothel, kívül basalmembrán borítja. Az endothel egyrétegű köbös laphám (2030 µx 20-30 µm), a sejtek száma kb 1011-re tehető, an : hozzávetőleg 1,5 kg össztömeget és több mint 100 m2 összfelületet jelent.
Jelen dolgozat témája a normofunkciós endothel. További dolgozatainkban térünk ki a vasculáris homeostasis, a díszfunkciós endothel, az egyes klinikai entitások és a terápiás effektivitás sejtbiológia kérdéseinek áttekintésere.
3. A normál endothel sejt
3.1 Az alkalmazkodás kényszere és az endothel sokfélesége
Amikor endothelról beszélünk, általában (1. fenn: méretek stb.) egynemű sejtpopulációra gondolunk. Azonban az érbelhártyát eltérő fajokban, eltérő szervekben, eltérő életkörülmények közt és eltérő helyzetekben találjuk.
A medicina teleologikus magyarázatokkal nem szokta beérni, s a kutatók úgy találták, hogy a vélelmezett heterogenitás valós: strukturális és funkcióbeli különbségekben is tetten érhető! Az egyes szervek azonos érszakaszai közt is nagy különbség van; például más funkciójú és szerkezetű a máj, az izom és az agy kapilláris endothelje. A fajok közti különbségeken túl egyazon egyedben is jelentős eltérések vannak az egyes érterületek, érszakaszok vonatkozásában. A diverzitás tér és időbeli. (10) Magyarázatára - szokás szerint - intrinsic és extrinsic hypotézist állítottak fel. [Ti.: genetikai programozottság vs. környezeti kényszer (9.).]
Intrinsic hypothesis: az artériás ésvénás endothelium közt mutatkozó különbségek a keringés effektív beindulása előtt már kimutathatóak. Eszerint a sejtekben már a mezodermából való kivándorlás előtt determinálódik a specifikus fenotípus.
Extrinsic hypothesis: specifikus endothel differenciáció in vitro is elérhető extracelluláris mátrix összetevők, illetve mediátorok alkalmazásával. Az endothel sejteket érő specifikus környezeti hatások nyomán kialakuló fenotípust hangsúlyozza.
Az "arany középút" teória: a fenotípus nem lehet sem több, sem kevesebb, mint környezeti hatások - tér és időbeli integráltjának - a genetikai alapprogram keretein belüli dinamikus átirata.
3.1.1 Strukturális különbségek
Fajon belül is eltérő endothel sejteket találunk a különböző érszakaszokat vizsgálva. Sejt alkotók helyzete
A sejtmag az aortában a középvonal alatt, a v. cava inferiorban a sejt középvonalától luminális irányban található.
Microvillusok
Legnagyobb számban az arteriolákban és a venulákban találhatók, a kapillárisokban már lényegesen kevesebb van.
Tight junction hálózat
Az arteriolákban ez folytonos, míg a venulákban már teljesen dezorganizált.
Gap junction
Ezek az interendotheliális kommunikációs csatornácskák az arteriolákban jól, az artériákban viszont esetlegesen szervezettek. A kapilláris területében pedig egyáltalán nincsenek is ilyen kapcsolatok
3.1.2 Expressziós mintázatban mutatkozó különbségek
Az endothel sejtek felszínén számos adhéziós, kommunikációs és egyéb molekula található meg egyidejűleg. Az egyes érszakaszok statikus, illetve dinamikus eltérést is mutatnak egymáshoz képest, például a hemostasisra ható faktorok, az a2 receptorok (conductancia erek), a CD34 (High Endoihelial Venula) és a madCAM- 1 (intestinális erek) expressziójában.
Az endothel sejten aktivációs szignálok hatására bekövetkező szerv- és stimulus specifikus dinamikus különbségek megfigyelhetőek a molekuláris mintázat szintjén is. A különböző érszakaszok specialitását ugyanis nemcsak egy-egy meghatározott molekula önmagában vett denzitása, hanem az ún. macromolekuláris mintázat is hordozhatja.
(Ha a molekulákat önmagukban betűkként képzelnénk el, akkor a mintázatuk egy-egy mondatnak felelne meg. Pl. a High Endothelial Venula (HEV) sejtfelszíni molekuláris mintázatának változatai teszik lehetővé a lymphocyták hazatalálási (honring) reakcióját. Vagyis az érhálózat meghatározott területén bizonyos sejtek - anélkül, hogy ezt a környezet gyulladásos jelenségként értékelné - átléphetik a bazálmembránt).
3. 1.3 Funkcionális különbségek
Régóta ismert a vasomotor tonus regulációs mechanizmusaival szemben mutatott különbség. Általában is elmondható, hogy az egyes szervek ereiben a keringés arteriális oldalán a NOS expresszió magasabb.
(Igy például ugyanaz a nyíróerő az epicardiális arteriolákban jóval erősebb NO mediált dilatációt okoz, mint az epicardiális venulákban. Ez részben magyarázhatja az a. mammaria interna és a v. saphaena bypass graftok elzáródási hajlamában mutatkozó klinikai különbségeket.)
A normofunkciós és diszfunkciós endothelt viszonylag éles jegyek különböztetik meg. Igy például ép artériákban az acetylcholin és az ADP is endothel mediált vasodilatatiot okoz, míg diszfunkciós endothel esetén csak az acethylcholin-válasz lesz pozitív. (8)
3.2 Az endothel funkciója
A megoldandó feladat, hogy a folyékony és gél állapotú vízterek közti határhelyzetben a folyton változó számos elvárásnak paralell eleget tudjon tenni. Ennek optimális ellátása végül a belső és külső környezeti hatásokra adott adaptív válaszban nyilvánul meg.
Főbb hatáskörök: vasculáris homeosztázis, gyulladás, immunitás, vérfluiditás.
(Chemotactikus szignálok termelése-integrálása révén szabályozza az érfal tónusát, illetve összetevőinek proliferációját. A leukocytákon hatva finomhangolta a gyulladásos és immunválasz sajátságait. Szabályozza a vér fluiditását és a coagulációt. Növekedési faktorokat termel a szövetek sejtjei számára stb.)
Ezek kivitelezése az adott érterülethez tartozó - nagyobb funkciós egységbe szerveződő - endothel foltok sensor, modulátor, kommunikátor, iniciátor, controller, barrier és transzportér feladatainak összehangolt ellátását tételezi fel. (Továbbra se tévesszük szem elől, hogy élőben egyetlen sejt sem önmaga által - és főleg nem önmagában - létezik. Minden sejt egyrészt az adott lokális compartment homeostatikus igényének, másrészt a még nagyobb egységekbe szervezett sejtközösségeket is összefűző szükség és szabályrendszerek konkrét elvárásainak próbál megfelelni. Vagyis általában minden sejt állapotát elsősorban a közvetlen lakótársai integrált állapota jellemzi legjobban.)
Bármilyen bonyolultnak is tűnik - és valószínűleg tényleg az - végül mindennek kérlelhetetlenül le kell fordítódnia az adott sejt által felfogható limitált utasításkészlet szókincsére. Ez a jelkészlet a mi esetünkben az endothel által termelt és érzékelt anyagok egymáshoz viszonyított arányának megváltozásával egyenlő.
3.3 Az endothel által termelt anyagok
3.3.1 NO
1980-ban Furchgott és Zawadski írta le (5) eredetileg, mint "endothelial derived relaxing factor"-t (EDRF). Csak hat év elteltével tudták egyértelműsíteni, hogy a relaxációs tulajdonságú anyag nem más, mint nitrogénmonoxid. Ennek egyik oka, hogy az NO igen labilis molekula.
(Így például szulthidril tartalmú proteinekkel, haemmel, szabad gyökökkel stb. is reagálhat. Az oxyhaemoglobinhoz nagy affinitással kötődik (nitrosothiol képződik), míg a deoxyhaemoglobin forma inkább a dissociaciónak kedvez).
A lebomlás során az NO elsősorban reaktív oxygengyökök semlegesítési folyamatai révén depletálódik. (11) (Vagyis oxidatív környezetben az acethylcholinra adott csökkent dilatatív válasz nem csak a csökkent termelés, hanem a fokozott NO lebomlás következménye is lehet.)
Főbb hatások: az NO az eddig ismert legerősebb endogén vasodilatator (simaizom relaxáns). Emellett gátolja az ET-1 (endothelin-1) termelést, a simaizom proliferációt, a thrombocyta adhéziót és aggregációt. Visszafogja az LDL oxidációt, bizonyos adhéziós molekulák expresszióját és a monocyta adhéziót.
3.3.1.1 A nitrogén-ovid biológiája, a nitrogenl-ovid szintetáz (NOS)
Jelenleg három isoformájáról tudunk: neuronális (nNOS), indukálható (iNOS) és endotheliális (eNOS). Azonos isoenzimet tekintve a fajok közti genetikai homológia kb. 90%-os. Fajon belül az egyes isoenzimek közt ez már csak 50-55%.
Mindhárom izoenzim azonos doménekből áll, így flavin adenin dinukleotid (FAD), flavin mononukleotid (FMN), tetrahydrobiopteren (BH4), ha-em (H) és calmodulin (CaM) régiókat különböztetünk meg.
Reguláció
Az iNOS nyugvó endothelben nem mutatható ki, viszont bizonyos hatásokra indukálódik. [Az iNOS függő NO szintézis regulációja meghatározóan transzkripciós szintű, mivel az iNOS kalcium szignál nélkül is köt calmodulint, vagyis az NO termelése folyamatos. Az iNOS ennek ellenére - meglehetősen szigorú körülmények közt - konstitutívan is expresszálódhat. (4).]
Az eNOS és regulációja elsősorban cofactorok és phosphorilatió útján zajlik. Szerepének megértéséhez érdemes konstitutívként látni. [Annak ellenére, hogy az eNOS szintén indukálható. (7., 3.).] (I. és II. táblázat.)
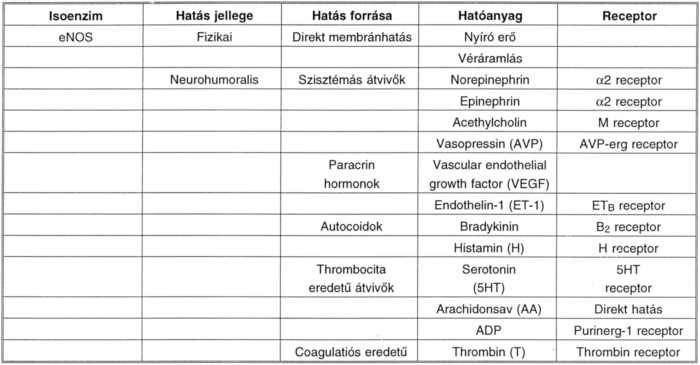
I. táblázat.
Az eNOS induktorai.

II. táblázat.
Az iNOS induktorai.
3.3.1.2 Az eNOS enzim működése és sematikus struktúrája (Behrendt) (1. ábra)
- Az eNOS a sejtmembrán belső oldalán - caveolához kötve - található. Az optimális működéshez palmitoylatio is szükséges.
- A caveola állandó fehérjeösszetevője; a caveolin-1 gátolja az eNOS működését.
- A calmodulin (CaM) allosterikus aktivátora az eNOS-nak.
A megváltozott térszerkezet gyorsabb elektrontranszportot tesz lehetővé a katalitikus központ felé. - 90kDa hősokk fehérje segítségével az aktín kináz a serotorin 1177. helyen phosphorilálva aktiválja, a threonin 495. helyen phosphorilálva viszont inaktiválja az eNOS-t.
- A NOS aktív centrumában 1-arginint köt, és ennek amino csoportját oxidálja. Vagyis a substrat (l-arginin) kötését egy, az endothel által termelt kompetitív antagonista, az aszimmetrikus dimetil-arginin (ADMA) gátolni képes.
- Tetrahidrobiopterén (BH4) hiányában az eNOS superoxid gyököt ter mel (02-)
- Az eNOS normál működése mellett, oxidatív környezetben peroxynitrit (ONOS) normál működése mellett, oxidatív környezetben peroxynitrit (0N00-) képződik. (1)
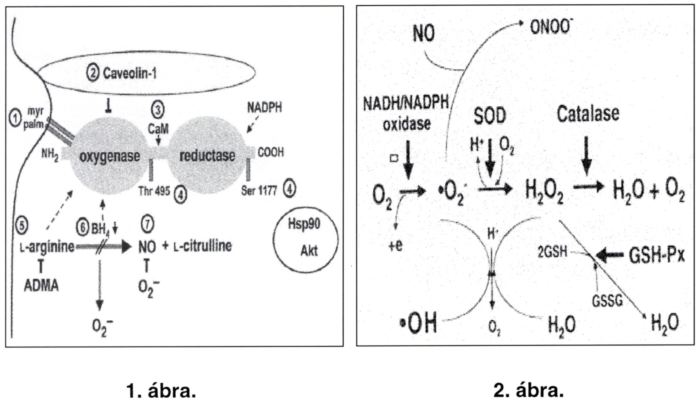
3.3.2 Reaktív oxigéngyökök (Reactive oxvgerl species - ROS) (2. ábra)
Az oxidatív alapon működő élettel - és a nélkülözhetetlen enzimrendszerekkel - a szabadgyökök (ROS) állandó ostroma jár együtt. A ROS képzésében meghatározó szerepet játszanak a mitokondrális elektron transzport, a xanthyn oxidase, a cyclooxygenase, a lipoxygenase, a haemoxygenase, a NOS és a NADH/NADPH oxidase.
A ROS triggerelt termelése már csak kevesek kiváltsága. Erre legnagyobb mértékben a neutrophyl granulocyták képesek. Emellett a macrophágok, endothelsejtek, simaizomsejtek és a kötőszöveti strómasejtek is rendelkeznek ilyen kapacitással.
Ha az endothel környezetében előforduló szabadgyököket reaktivitás szerint rangsoroljuk, akkor az 02- < H202 < OONO- sorrend alakul ki. Ugyanakkor az N0+02 →OONO- (peroxynitrit) reakció sebessége 6,7x 102 M/sec. Ami 10 000-szer gyorsabb, mint az, ami 02- és más antioxidáns közt mérhető és kb. 3-szor gyorsabb, mint a superoxid-dizmutáz (SOD) által katalizált reakció.
A peroxynitrit elég stabil ahhoz, hogy nagyobb távolságba diffundálva is képes legyen kifejteni szerteágazóan káros hatását. Például a SOD peroxynitrit jelenlétében a cytosceletális proteinek tyrozin tartalmú részeinek 3-nitrosillatióját is katalizálja.
Ez alapján mondhatjuk azt is, hogy a SOD által katalizált reakció evolúciós értelme nem az 02 átalakítása a sokkal reaktívabb H2O2-vé, hanem valójában a peroxynitrit (OONO-) képződés szubsztátjának elfogyasztása.
Az egy kompartmentben jelen lévő N0, 02 és SOD optimális arányának változása végül a sejt NO tartalmának csökkenéséhez vezet. Normál érben a folyamatok eredője a NO termelődés; a vasodilatatio és az antiproliferatív hatás irányába mutat. Hypertonia, atherosclerosis, diahetes mellitus és dohányzás esetén egyaránt kimutatható mindennek az előnytelen irányú változása. Ezt jelzi például a Zn-finger fehérjék és thiolok oxidálásának, illetve a tyrosin-nitrálódásának fokozódása, valamint a cytosceleton átrendeződés és a következményes morfo-funkcionális sejtkárosodás. (11)
3.3.3 Haemostaticus faktorok
Az endothel sejt egyik fő feladata, hogy biztosítsa általában az érpálya - különösen a hajszálerek - átjárhatóságát. Ehhez vasoprotectív, thromboresistens molekulákat kell hogy termeljen, és ki kell hogy pufferolja azokat a hatásokat, amelyek a thrombogenesis és a gyulladás irányába tolnák el a folyamatot.
3.3.3.1 Anicoaguláns faktorok
3.3.3.1.1 Solubilis anticoaguláns faktorok
- prostacyclin (PGI2),
- nitrogén-monoxid (NO)
- tissue factor pathway inhibitor (TFPI),
- direkt fibrinolytikus hatású szöveti-plazminogen aktivátor (tPA),
- urokinase-típusú plazminogen aktivátor.
3.3.3.1.2 Sejtfelszínhez kötött anticoaguláns faktorok
- ecto-adenosin difoszfatáz (ADPa se),
- thrombomodulin (TM),
- heparinszerű molekulák,
- protein S.
3.3.3.2 Procoaguláns faktorok
3.3.3.2.1 Solubilis procoaguláns faktorok
- von Willebrand faktor (vWf),
- plazminogén aktivátor inhibitor-1 (PAI-1).
3.3.3.2.2 Sejtfelszinhez kötött procoagulárls faktorok
- szöveti faktor (TP),
- Va faktor.
3.3.4 Endothelinek
3.3.4.1 Bioszintézis (3. ábra)
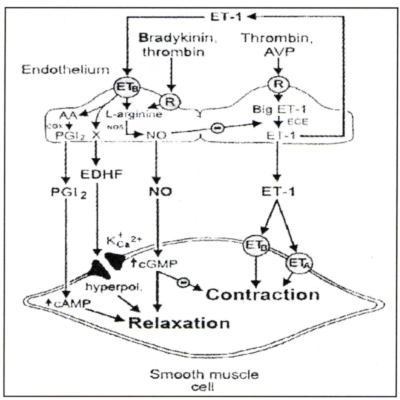
3. ábra.
Bizonyos hatásokra (például thrombin, AVP stb.) az endothelben preproET transzlálódik (212 AA).
Ez convertase enzimek hatására 38 AA-as pro-ET-né, majd a 21 AA-as ET-1-é alakul.
A plazmaszint physiológiásan alacsony. (Például azért is, mert 4-7 perc alatt - a plazma, a vese és a tüdő endopeptidázainak hatására - az ET-1 több mint fele elbomlik!)
Receptora jelenleg kettő ismert az ETA éS ETB. A receptorok közti funkcionális különbség még nincs teljesen feltárva.
Főbb hatások: a 21 aminosavas ET1 az endothel által termelt - abluminálisan szekretált - autokrin regulációs anyag. Az endothelialis ETB receptoron hatva N0, PgI2 és EDHF válaszra fordítódik át. Mint parakrin hormon a normál endothelre relaxánsként, a lobsejtekre kemoattraktánsként (monitoring), a simaizomra proliferális szignálként (neo-angio genesis) ETA és ETB receptoron), illetve potencírozza az endothel reaktivitását a kontraktilis hatásokra (pl.: norepinephrin) (9).
3.3.4.2 Receptor eloszlás
A koronáriákon az ETB receptorok normálisan hiányoznak, ugyanakkor például a veseartériában az ETB receptor mennyisége meghaladja az ETA-ét. Atherosclerosisban a humán coronariákban az addig teljesen hiányzó ETB receptorok expressziója egyértelműen megnő, bár továbbra is az ETA dominál. Az ET-bioszintézis gén-promoter szintű szabályozását a III. táblázat mutatja.
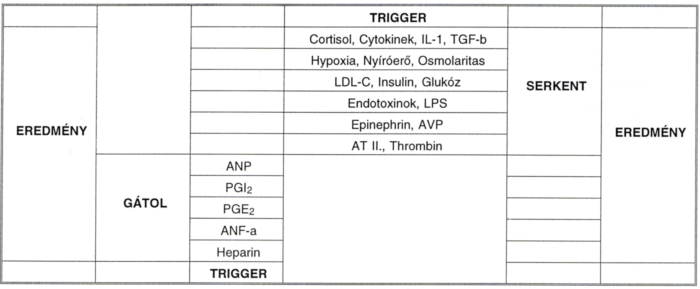
III. táblázat.
Az ET-bioszintézis gén-promoter szintű szabályozása.
3.3.5 Adhéziós molekulák
3.3.5. l Integrinek
A különféle alfa és béta alegységek valamilyen heterodimerjébó1 állhatnak. Transzmembrán glycoprotein család, melyeknek a sejt-sejt és a sejt-matrix kapcsolatokban is szerepük van. Minthogy extracelluláris és intracelluláris effektor funkciójuk is lehet, az általuk befolyásolt folyamatok széles spektrumon mozognak.
3.3.5.2 Selectinek
Szénhidrát ligand felismerésre (CRD-carbohydrate recognition domain) specializált adhéziós receptorok. A transzmemrán régió mellett "komplement regulátor"-szerű részük is megkülönböztethető:
E-selectin: TNF és IL-1 hatására expresszálódik, NE, M0, EO adhéziót segít elő.
P-selectin: konstitutívan expresszálódik, endotheliális és thrombocyta granulumokban tárolódik, aktivációs jelre kerül a membránba.
L-selectin: a legtöbb fehérvérsejten konstitívan expresszálódik.
3.3.5.3 1mmoglobulin család
ICAM-1: transmembrán glycoprotein, 5 lg domént tartalmaz, inaktív sejten alig expresszálódik, de aktiváció hatására drámaian megugrik a mennyisége.
ICAM-2: 2 Immunglobulin szerű extracelluláris doménja van. Konstitutív, cytokinek nem befolyásolják expresszióját.
PECAM-1: konstitutívan expresszálódó molekula, mely homofil (PECAM-PECAM) vagy heterofil (PECAM-aVß3 integrin, PECAM-CD38 stb.) interakcióban kapcsolódhat. Intracytolasmaticus immunoreceptor tyrosine inhibitor motívum (ITIM) egységeket tartalmaz, ezért foszforilációt követően gátló hatást is közvetíthet (b, 2). Az endothelium integritásában (a sejtek egymás felőli oldalukon koncentrálják), illetve a leukocyta transzmigrációban van kitüntetett szerepe.
VCAM-1: szintén aktiválható adhéziós molekula, kinetikája hasonló az ICAM-1-hez, de a neutrofil intreakcióban nem játszik szerepet. Expresszióját az IL-4 növeli, de az E-selectinét nem.
3.3.6 Cytokinek
Az endothel az IL-1 és TNF-alfa mellett képes IL-6, IL-S, MCP-1 és PAF kiválasztására is. Az eredmény szerteágazó lehet, például adhéziós molekulamintázat változás, leukocyta adhézió és migráció, thrombocyta aktiváció stb.
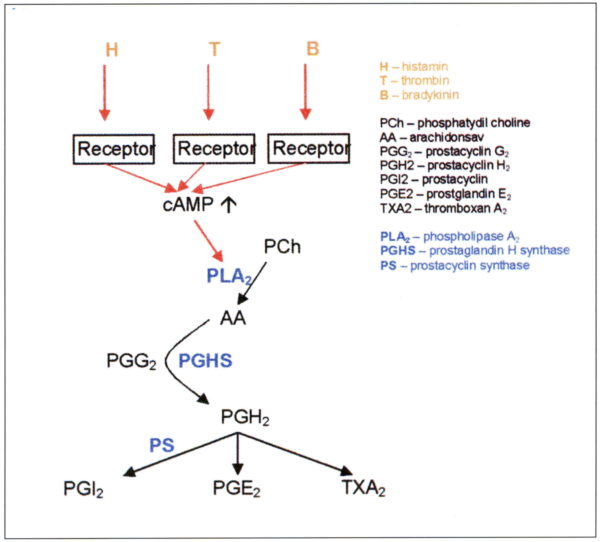
4. ábra.
3.3.7 Lipoid mediátorok/l prostnoidok (4. ábra)
Aktivációs jel hatására az endothel - valószínűleg a thrombocytákon leírt cAMP függő úton keresztül - aktiválja a cytoplasmaticus PLA2-t, ami arachidonsavat (AA) szabadít fel phosphatidyleholinból. Ez jó szubsztrátja a prostaglandin H2 szintáznak (PGHS), mely enzim két lépésben prostaglandin H2-t (PGH2) állít elő, ami a prostacyclin és a thromboxán közös előanyaga. A PGHS olyan bifunkcionális enzim - cyclooxigenase és egyben per-oxidase 1S - melynek két izoformája van. (PGHS-1 és PGHS-2). Ezek féléletideje 10 perces nagyságrendben mozog. Vagyis az aktivációs szignálra adott válasz mértéke csak a de novo PGHS enzimszintézis sebességétől függ.
PGHS-1. Fiziológiásan ez felel a vasoprotectív hatású PGI2 termelésért. Konstitutívan expresszálódik, szintézise nyíróerő, cytokinek és mitogén faktorok hatására fokozódik.
PGHS-2. Főként az intlammációban és a prolifcrációban van szerepe. Cytokinek és mitogén faktorok által erősen indukálható. Endotheliális stressz esetén az autoinaktiválódó PGHS-1 helyett ez az isoenz:in termeli a PGI2-t.
3.3.7.1 Prostacyclin (PGI2)
PGH2-ből (trombin, bradykinin, nyíróerő, hypoxia stb. trigger hatására) a membránkötött prostacyclin szintőz termeli (10). Ismert a PGI2 transcellularis szintézise is, ennek során az aktivált thrombocyták által felszabadított PGH2 az endothelbe jutva alakul prostacyclinné. Hatásának lényege a thrombocyta aggregatio gátlása, melyben szinergistaként hat az NO-val. A simaizom contractio és lipid accumulatin gátlása, illetve a MO-EC interakció gátlása másodlagos. (A simaizom relaxációban valójában csak potencírozza az NO hatását. Ennek főleg olyan kórállapotokban van jelentősége, ahol az NO-ból már nincs elegendő, mert szintézise sérült, illetve eliminációja fokozódott.)
3.3.7.2 TXA2
Endothel sejtet aktivál, simaizom sejten konstriktor hatású. Aktivált thrombocytákon kívül az endothel is képes termelésére. Ép endothel esetén a TXA2 (hasonlóan az ET-1-hez) végül átfordítódik NO és LDHF szignállá. Sérült vagy hiányzó endothel esetén csak a direkt simaizom konstriktor hatás érvényesül.
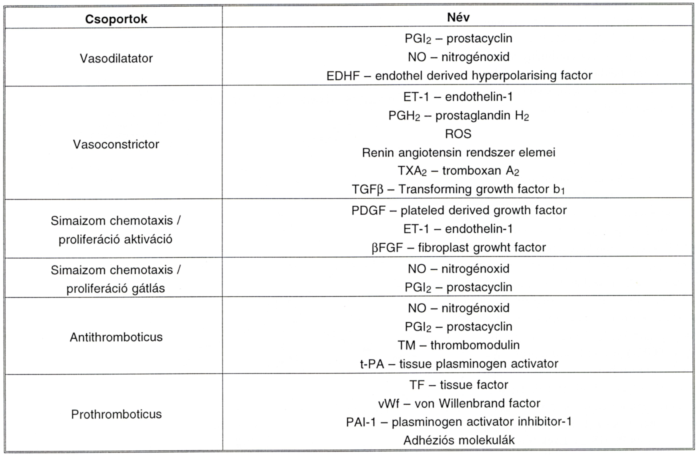
IV. táblázat.
Az endothel által termelt anyagok, biológiai hatás szerint csoportosítva.
3.3.8 Az endothel által termelt anyagok biológiai hatás szerint csoportosítva
A csoportosítást a IV. táblázat mutatja, az általánosan használt angol nyelvű rövidítések és azok feloldásai szerint. (Az összetett hatású anyagok több helyen szerepelnek.)
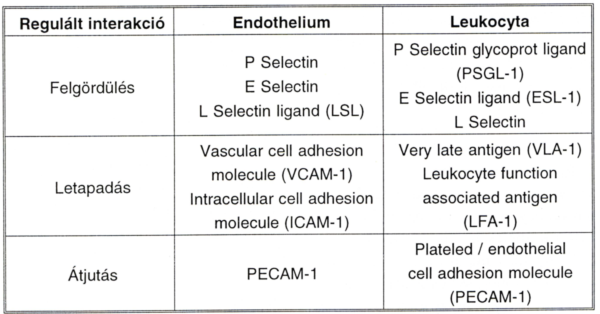
V. táblázat.
Az endothel szerepe a sejtadhézióban.
3.3.9 Az endotlhel szerepe a sejtadhézióban
E tárgykört - vázlatosan - az V. táblázatban foglaltuk össze, szintén angol nyelvű rövidítések és azok feloldásai szerint.
4. Következtetés
Normálisan az endothel képes a folyamatok eredőjének a nyugalmi állapot felé való visszafordítására. Ezt az értónus, a véralvadás, a proliferáció, az érintegritás és a gyulladásként ismert állandó immunrendszeri aktivitás egyidejű és koherens mediálásával teszi lehetővé.
Az endothel alapvető feladata a vascularis és perivascularis homeosztázis fenntartása.
A mi alapvető feladatunk annak vázolása, hogy ezt az endothel hogyan teszi, és hogy mindennek milyen jelentősége lehet a gyakorlatban. Célunk, hogy felismerhetővé váljék a közös momentum a különbözőképpen kezelt betegségben is: ez pedig maga a sérült, beteg endothel.
Az egyes funkciók és a kimerült - diszfunkcionális - endothel, illetve ennek klinikai entitásokban való értelmezése az Érbetegségek következő számaiban megjelenő dolgozatok témája. Sorra kerül majd a hypertoniás, a diabeteses, a pangásos és a ischemiás-reperfusiós vasculopathia is.
Irodalom
- Bechrenet, D.: Endothelial function: from vasculai biology to clinical applications. Ám. J. Cardiol. 2002.90 (Suppl.): 40-48
- Bevilaqua, M. P. et al.: Endothelial-leukocyte adhesion molecules in human disease. Ann. Rev. Md. 1994.45:361-378).
- Cooke et al.: Nitric oxide synthase: Role in genesis of vasculai disease. Ann. Rev. Med. 1997.48:489-509.)
- Dawson, T. M., Snyder, S. H.: Gases as biological messengers: nitric oxide and tarbon monoxide in the órain. J. Neurosci. 1994. 14.5147-59.
- Furchhgott, R. F., Zawadski, J. V.: The obligatory role of endothelial teli in the relaxation of the arterial smooth mucle by acethylcholine. Natura, 1980.373-376.
- Luscinskas, F. W. et aL: Endothelial-dependent mechanism in chronic inflammatory leukocyte recruitment. Ann. Rev. Med. 1996.47:413-421.
- Shaul, P. W.: Ragulation of endothelial nitric oxide syntase. Ann. Rev. Physiol. 2002.64:749-74
- Taddei, S., Virdis, A., Mattei, P. et al.: Vasodilatation to acethylcholin in primary and secondary forms of human hypertension. Hypertension. 1993.21.929-933
- Vanhoutte, P. M.: Endothelial dysfunction and vasculai disease. Endothelium nitric oxide and atherosclerosis. Futura Publishing Co. Inc., Armonk, NY. 1999.
- William, C.: Crit. Care Med. 2003. 11. Zafari, A. M. et al.: Vascular oxidant stress and nitric oxide bioactivity. Endot helium, nitric oxide and atherosclerosis. Futom P. Co. Inc., Armonk. NY. 1999.
Dr. Hamar Péter
SOTE Kórélettani Intézet,
1089 Budapest, Nagyvárad tér 4.
Érbetegségek: 2003/4. 103-110. oldal


