Ebben a részben a ragasztásos éregyesítéssel és a lézeres érösszeolvasztással foglalkozunk. (Felhívjuk a figyelmet, hogy az ábrák és az irodalom számozása az egész, ötrészes munkában folyamatos.)
Érbetegségek: 2020/4. 115-122. oldal
Figyelem: a letölthető és nyomtatható PDF fájlok időben egymás után tartalmazzák a téma I., II., III. ls IV. részét.
Ebben a részben a ragasztásos éregyesítéssel és a lézeres érösszeolvasztással foglalkozunk. (Felhívjuk a figyelmet, hogy az ábrák és az irodalom számozása az egész, ötrészes munkában folyamatos.)
6. Érragasztás: E téma hazai alkalmazásáról korábbi munkánkban már részletesen beszámoltunk (4). E helyen a kérdés további vonatkozásait ismertetjük, és ismét utalunk a hazai szerzőkre is.
A szövetragasztókat a múlt század hatvanas éveiben kezdték alkalmazni, azóta több sebészeti szakágban használatosak. Ezek sokoldalú kísérletes és klinikai alkalmazásáról, így az ereken végzettekről is, többek között Vasko írt, 1965-ben (118). Mi a továbbiakban az érsebészeti vonatkozásokkal foglalkozunk. Az érragasztással kapcsolatban elmondható, hogy ma még nem az érfal folytonossági hiányának helyreállítása, ill. a megszakadt érvégek egyesítése a fő klinikai alkalmazási terület. Kiterjedten inkább az ér varratvonalának vérzéscsillapítására és biztosítására (70. ábra), ill. más, nem éregyesítő célokra használják. Ezekről érintőlegesen később lesz szó. Mindezek ma, a gyakorlatban fontosabbnak bizonyultak, mint az érfal folytonosságának ragasztással való helyreállítása.
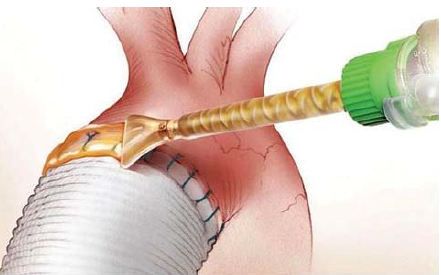
70. ábra.
Varratvonal biztosítása szövetragasztóval
A ragasztásos éregyesítés történeti ismertetése előtt magukkal a ragasztóanyagokkal foglalkoznánk. A legelsők, különböző cyanoacrylat vegyületek voltak. Ezek kémiai és egyéb tulajdonságairól Coover írt 1959-ben (119). Közülük a metyl-2-cyanoacrylat a legismertebb. Gyári neve: Histoacryl Blue®, Eastmann 910. Az anyag bactericid, önsterilizáló. Ez a vegyület monomer, amely az élő szöveten polymerizálódik és erős, tapadó filmet képezve tömít és ragaszt, majd felszívódik. Ennek időtartama különböző lehet. Gyurkó emberi alkalmazásnál maradványokat még közel egy év múlva is talált (120).
Később, más, részben biológiai eredetű anyagokat is alkalmaztak szövetragasztásra pl. gelatin-resorcinolformaldehid, albumin-glutaraldehid, fibrin-thrombin, stb. Az egyik legismertebb az 1998 óta használt BioGlue® (121), amely bovine albuminból és glutaraldehydből készül. Ezt az anyagot varratbiztosítás mellett dissecaló aneurysmáknál is kipróbálták. Ugyanakkor a jelenlegi gyári használati utasításban óvnak attól, hogy varratok, vagy kapcsok helyett éregyesítést végezzenek vele. Teljesen biológiai eredetű anyag a Fibrin glue, vagy Fibrin sealent, (122) amelynek alapanyaga emberi fibrin és bovine thrombin.
Visszatérve a módszer klinikai történetére, a korábbi vélekedésektől eltérően, jelen vizsgálataink szerint úgy tűnik, hogy a cyanoacrylat ragasztót először Inou alkalmazta emberen, 1961-ben, többek között ereken is (123). Bőrt ragasztott, beleken, ill. ereken anastomosist készített.
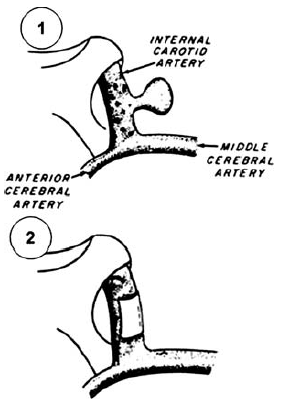
71. ábra.
Carton emberi érragasztásának vázlatos képe
Más, korábban közölt irodalmi adatok szerint Carton alkalmazott szövetragasztót először az érsebészeti klinikumban, 1962-ben (124). Az artéria carotis interna intracranialis szakaszán foltplasztikát végzett vele: Histoacryl Blue®, Eastman 910 cyanoacrylat ragasztóval dura foltot tapasztott az éren lévő aneurysma eltávolítása után keletkezett defektusra (71. ábra).
Az érragasztó első, hazai kísérletes alkalmazásáról 1967-ben Gyurkó György (72. ábra) tudósított (125). Nem sokkal ezután, még 1967-ben, Nemes Attila (72. ábra) számolt be említésszerűen, egyébként más szövetek ragasztásával foglalkozó cikkük függelékében, 15 kutya hasi aortáján végzett foltragasztásról (126). Az első, klinikai alkalmazásáról: artéria femoralison és artéria radialison, összesen 10 esetben végzett sikeres érragasztásról Nemes Attila 1968-ban, éppen az első hazai Angiológiai Napokon, Szegeden számolt be (72. ábra) (127).
Nemzetközi vonatkozásban is jelentős Gyurkó (72. ábra) experimentális és klinikai munkássága (cit 4). Dolgozata 1975-ben jelent meg (120), amelyben 1972 és 1974 között végzett 193 emberi érműtét során készített 500 érragasztás (arteriotomia, varrathermetizálás, folt, intimalépcső leragasztás, punctio helyének elzárása, vénás graft leszakadt kis oldalágának vérzéscsillapítása) tapasztalatairól ír. Ezek a műveletek ma is az érragasztás indikációját képezhetik. Klinikai éregyesítő ragasztást viszont nem végzett. Ilyen tudósítást a hazai szakirodalomban azóta sem találtunk.

72. ábra.
Balról Nemes Attila, jobbról Gyurkó György
A továbbiakban a kísérletes munkákat is figyelembe véve, a részleteket, s bizonyos értelemben az időrendet is mellőzve, vázlatosan leírjuk a tényleges érragasztás módszereit:
Az első kísérletes érragasztást Carton, ill. Natham munkacsoportjai végezték 1960-ban (128, 129). A legegyszerűbb érragasztás a művi arteriotomia egyszerű bekenése hosszanti oldalsérülésnél (73. ábra). Ily módon végezte Nathan egyik legelső ragasztását. Bár ez a módszer az esetek jelentős részében bevált, s a ragasztás mechanikailag elég szilárdnak mutatkozott, az esetek kisebb részében álanerysma alakult ki (74. ábra). Ezt a gondot autoplasticus, vagy alloplasticus szövetfolt ráragasztásával igyekeztek kiküszöbölni (129). Azonban ez sem bizonyult teljesen megbízhatónak. Ezért az oldalsó érsérülést úgy ragasztották meg, hogy az eret ragasztóval bekent csíkkal (véna, fascia, műérdarab, stb.) körbetekerték (75. ábra) (130).
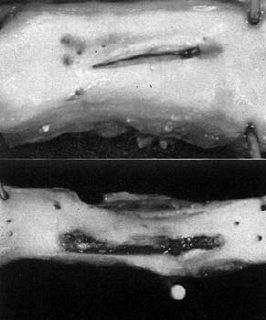
73. ábra.
Kísérletes arteriotomia megragasztása a ragasztó egyszerű rákenésével. Egyhetes kutya aorta explantatum nézete belűlről
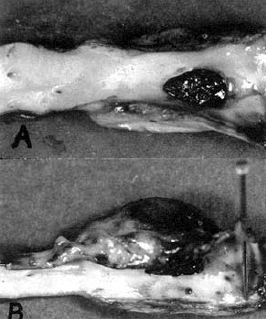
74. ábra.
Álaneurysmaképződés egyszerű ragasztás után. A. Belső nézet. B. Külső nézet
Vég-a-véghez ragasztást többféleképpen is végezték:
1. Egymástól a szokásosnál ritkábban behelyezett, négy, csomós öltéssel egyesítették az érvégeket (132), majd a fonalak meghúzásával az érszéleket közelítve, ragasztóval bekenték azokat. Ezt azzal a feltevéssel is végezték, hogy a kis átmérőjű ereken kisebb legyen a varratok által indukált szöveti reakció. Ez a feltevés nem vált be teljesen, mivel az adhezív anyag is gyulladásos reakciót vált ki.
2. A következőkben már csak három, vagy akár, csupán két irányöltést helyeztek be (133). Az öltéseket meghúzva szorosan egymás mellé illesztették az érszéleket és így kenték fel a ragasztót. Ennek a kísérletnek az volt a célja, hogy összehasonlítsák a hagyományos és a ragasztott érszakasz szakítási szilárdságát. Általában kedvező eredményeket kaptak.
3. A következőkben ugyanezt tették, de a ragasztást követően eltávolították az irányöltéseket. A varratszilárdság funkcionális szempontból, általában így is megfelelő volt, de abszolút értékben, legalábbis a korai posztoperatív időszakban, a ragasztott anasztomózis szakítási szilárdsága gyengébb volt, mint a hagyományos varraté.
4. Végeztek vég-a-véghez egyesítést irányöltések nélkül is (134) úgy, hogy az adaptált érvégeket ragasztóval bekent véna, fascia, műér, stb. csíkkal körkörösen összeragasztották. Az érvégek adaptációját külön oldalnyíláson ideiglenesen bevezetett fémrúd (stent) (135, 136), műanyagcső (131), vagy ballon katéter (134) segítségével érték el (76. ábra).
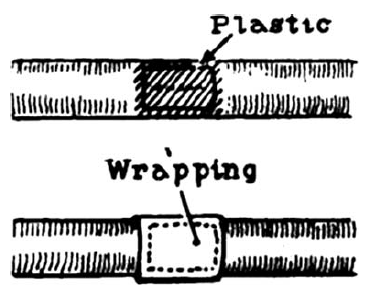
75. ábra.
Sérült érfal ragasztása beburkolással
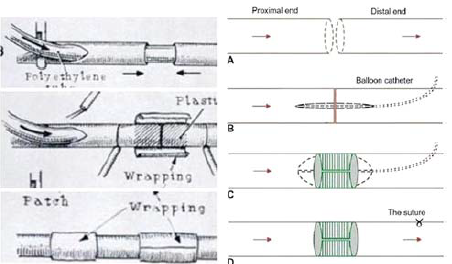
76. ábra.
Polietilén csővel, ill. ballonkatéterrel adaptált érvégek ragasztása
Használtak adaptációs célra szövetbarát, nem mérgező műanyagokat is, mint pl. Polaxamert (137). Erre jellemző, hogy testhőmérsékleten folyékony, de néhány fokkal magasabban megszilárdul. Érragasztásnál a folyadékot az üres érvégekbe töltötték (77. ábra), majd azokat egyeztették. Ekkor, a környezetet kissé felmelegítve az anyag megszilárdulása következtében az érvégek pontosan adaptálódtak. Ezután elvégezték a ragasztást, majd a környezetet kissé lehűtve a polaxamer elfolyósodott, s a véráram kimosta. Ily módon fél-egy mm átmérőjű ereket is sikeresen megragasztottak.
Az eddig ismertetett módszerek segítségével end to side összeköttetéseket is készítettek (78. ábra).
Gyurkó 1968-ban, invaginációval készített end to end és end to side kísérletes, mikrovaszkuláris, ragasztott anasztomózisokat (79. ábra) (cit. 4).

77. ábra.
Polaxannal megtöltött érvégek sematikus bemutatása
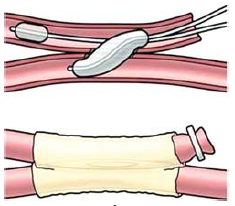
78. ábra.
Érragasztás ballonkatéterek segítségével
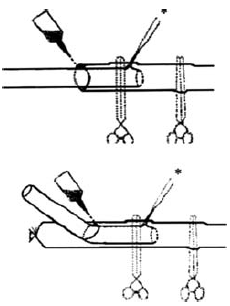
79. ábra. Gyurkó ragasztással készített invaginációs éranastomosisainak vázlatos rajza
Bármely alternatív éregyesítési módszer fő célkitűzése, hogy legyen egyszerűbb és kisebb manuális jártassággal is elvégezhető, mint az adott ér kézi varrata. Az is fontos, hogy a művelet legyen gyorsabb. Számos vizsgálat eredménye alapján mondhatjuk, a ragasztásos éregyesítéssel ezek a célok elérhetőek (138, 139). A posztoperatív átjárhatóság szempontjából nagyszámú közlés alapján, nincs lényeges különbség a ragaszott és a kézzel készített anasztomózisok között. További követelmény a ragasztott éranastomosis megfelelő szakítási szilárdsága, amely ne legyen kisebb, mint a kézzel varrotté. E tekintetben, nagyszámú vizsgálat szerint a korai posztoperatív időszakban a ragasztott egyesítések gyengébbek, különösen az irányöltés nélküliek. Az is fontos tényező, hogy a ragasztóanyag által okozott szöveti reakció (thrombocyta aggregatio, gyulladásos reakció, intimahypertrofia, esetleges későbbi szűkület az anastomosis vonalában) ne legyen kedvezőtlenebb, mint a hagyományos érvarratnál. A sok vizsgálat alapján úgy tűnik, a ragasztó anyagok ilyetén hatása kedvezőtlenebb, mint a bevált érvarró anyagoké, de vannak ellenkező tapasztalatok is (133, 140). Külön tényezők a ragasztó degradációja, ill. eltakarítása idején létrejövő hisztológiai folyamatok, s mindennek lezajlási ideje. Kevés vizsgáló állítja, hogy e tekintetben a ragasztók hatása kedvezőbb lenne.
Ha figyelembe vesszük, hogy az eljárás több, mint 50 éve ismert, és még mindig ott tartunk, hogy a kísérletes vizsgálatok száma többszöröse a klinikai alkalmazásról szóló közléseknek, úgy gondoljuk, ez a módszer még mindig nem kiforrott. Ugyanakkor a mikrovaszkuláris nagyságrendben elért sikeres klinikai eredmények (133) arra intenek, az eljárás nem egyértelműen elvetendő. Úgy véljük, az eddig ismerteknél jobb ragasztóanyagok felfedezése hatékony eljárássá tehetné a ragasztásos éregyesítést.
Mint a legtöbb alternatív éregyesítésnél, az érragasztással kapcsolatban is kevés a hosszú idejű megfigyelés. Ezek hiányában az eljárás ma még nem tekinthető elfogadott, rutin módszernek.

80.ábra.
Thedore Harold Maiman
81. ábra.
Lézerrel egybeépített operációs mikroszkóp
7. Éregyesítés lézeres összeolvasztással: Az első lézert az amerikai Theodore Harold Maiman (80. ábra) fejlesztette ki 1960-ban. A lézeres összeolvasztás az egyik legfiatalabb éregyesítési módszer. E helyen csupán a legfontosabb kérdéseket próbáljuk ismertetni, s ezeket is nagyon leegyszerűsített formában.
Az első közlés a lézeres éranastomózisról Jain és Gorisch-tól származik 1979-ből (141). Ők 50 patkány 1 mm-nél kisebb átmérőjű erein ejtett arteriotomiát és venotomiát zártak el Neodymium YAG lézerrel 95%-os átjárhatósággal. A műtét operációs mikroszkóp segítségével készült (81. ábra).
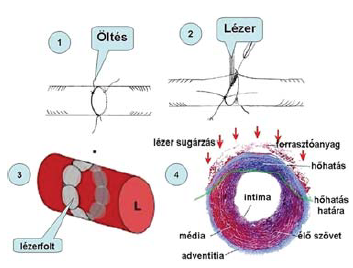
82. ábra.
A lézeres összeolvasztás elvi vázlata
Az idők folyamán többféle lézert alkalmaztak éregyesítésre. Elsőként a Neodymium YAG-ot, majd a CO2-ot, a KTP-t, a Holmiumot. ill. az argont, a diodát, az excimert és egyéb lézerfajtákat (142, 143). A különböző erek lézeres összeolvasztásához más-más lézertípus a legjobb. Ugyanez vonatkozik a fény hullámhosszára, a megvilágítás idejére, stb. Manapság a diódalézer a legnépszerűbb. Mindezek részletesebb tárgyalásától eltekintünk.
A lézeres éregyesítés lényege az érfal fehérjéinek, leginkább a kollagén szövetelemek fotótermikus összeolvasztása, tehát az, hogy a sugár hőenergiájának hatására az érfal szerkezete, főként kollagén állománya destruálódik, megolvad, az érvégek összeolvadnak, s ezáltal jön létre az éregyesítés. A kollagén rendszerben új keresztkötések keletkeznek.
A műveletet általában úgy végzik (142, 143, 144), hogy a leszorított ércsonkokból kimossák a vért, majd két irányöltés behelyezése után azokat meghúzva az érvégeket, pontosabban az érszéleket közelítik egymáshoz, majd lézeres fénypontokkal először az elülső, utána a hátsó falat kezelik (82. ábra). Az összeolvasztás után a véráramot újraindítják.

83. ábra.
End-to-end lézeres microvascularis anastomosis egy órával a műtét után
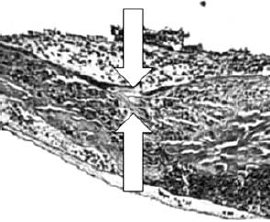
84. ábra.
End-to-end lézeres microvascularis anastomosis szövettani képe egy órával a műtét után
Ilymódon jól készíthetők akár mikrovaszkuláris varratok is (83-85. ábra) (142). Az egyesítés után rögtön megindul az elpusztult szövetrészek eltakarítása és a szöveti regeneráció. A szövettani folyamatok néhány hétig tartanak. Az összeolvasztott érvégeket kötőszöveti kollagén heg köti össze, majd a felszín ismét endothelizálódik (142, 144).
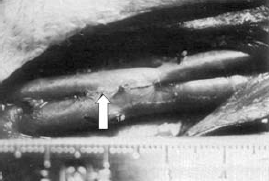
85. ábra
Lézeres oldalegyesítés képe
A lézeres éregyesítés eredményét további ábrákon mutatjuk be (86., 87. ábra). Sokszor azonban nem ilyen szép a kép, mint a, 87. ábrán. Előfordul, hogy hónapok múlva is látható még az összeolvasztás helye, amely nem épült át olyan jól (88. ábra).
A lézeres éregyesítést főként kisállatokon, patkányokon vagy más kísérleti állatokon végezték, akár 1 mm-nél kisebb átmérőjű erektől kezdve, az un. nagyartériákig és vénákig. A malacokon végzett sikeres kísérletekkel kimutatták, hogy a lézeres anasztomózis nem gátolja az ér növekedését.
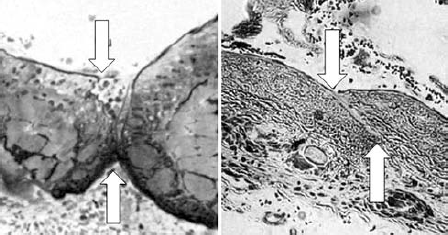
86. ábra.
Lézeres egyesítés szövettani képe egy nappal (bal oldali) és egy héttel (jobb oldali) a beavatkozás után
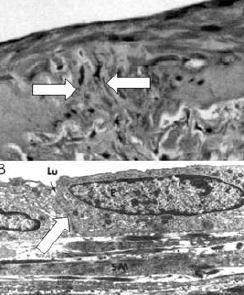
87. ábra.
Háromhetes kép az érvégeket összekötő kollagén kötőszövettel és endothelisatioval
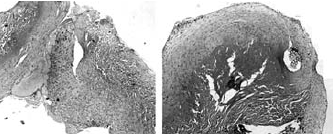
88. ábra.
Összehasonlító szövettani kép két és félhónapos lézeres (bal) és hasonló idővel korábban készült kézi varratról (jobb)
A lézersugár hatására az elhalt és összeolvadt szövetek kezdeti szakítási szilárdsága gyengébb, mint az érvarraté, ezért aneurysma képződésre hajlamosabb. Máskor intima hypertrophia alakul ki az összeolvasztás helyén (89. ábra).
Az eljárás előnyei: A lézeres anastomosisnak főként a mikrovaszkuláris éregyesítésnél van előnye, eleve kisebb átmérőjű ereket lehet így egyesíteni. A 0,5 mm-es vagy annál kisebb átmérőjű ereket kézzel ugyanis nem igen lehet megvarrni, de lézerrel összeolvasztani igen.
Alkalmazása azért is előnyös, mivel elsajátítása egyszerűbb, mint a hagyományos érvarraté. További előnye, hogy sokkal gyorsabb, a leszorítási idő rövidebb. Nincs nagy idegentest reakció. A thrombocyta lerakódás a műtét után kisebb mértékű, mint a hagyományos kézi varratnál.
A módszer hátrányai: Mint ahogy már fentebb volt róla szó, az egyesítési vonal a postoperatív időszak első heteiben gyengébb, mint a hagyományos varraté, ezért az aneurysma képződési hajlam nagyobb. Ide tartozik, a már szintén említett, intima-proliferatio is. További hátránya, hogy drága, továbbá végzésének körülményei elég komplikáltak.
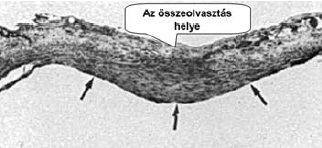
89. ábra.
Intimahypertrophia az összeolvasztás helyén (nyilakkal jelölve)
Az aneurysma veszélyének megelőzésére tett erőfeszítések: megerősíti az összeolvasztás szilárdságát az u.n. "scaffold" és "solder" alkalmazása. (145-149). A scaffold tulajdon képpen támasztóanyag, amely hőre olvadékony, különböző biopolimerekből, pl. polycaprolactonból, vagy polylacto-glycolsavból készülhet. Ezek mikroszkóposan rácsos, porózus szerkezetű anyagok (90. ábra).

90. ábra.
Polycaprolacton scaffold porózus szerkezete
A solder pedig biológiai forrasztóanyag. Először vért használtak soldernek. Készülhet emberi, vagy különböző állati albuminból, fibrinből, tojásfehérjéből, de egyéb anyagokból is. Ezek folyékony, vagy félig szilárd halmazállapotúak. Keverhetnek hozzájuk különböző, az adott lézerfénysugár hullámhosszának megfelelő festékoldatot is, pl. metilénkéket, vagy indocianin zöldet. A soldert külön is alkalmazták, de inkább a scaffoldot a solderbe áztatva vitték fel a két ércsonk találkozási helyére ((91. ábra). A lézersugár hatására ezek is felolvadnak, összeolvadnak, kapcsolatba lépnek az ér szöveteivel, s a képződött koagulumot megerősítik (90., 91. ábra). Ilyenkor a kívülről megerősített érvégek esetén néha el is hagyták az irányöltéseket (150).
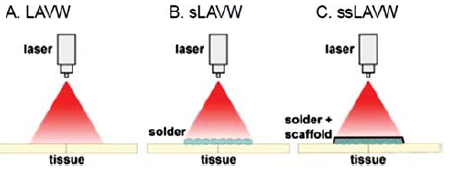
91. ábra.
Vázlatos ábra az u.n. solder és scaffold alkalmazásáról
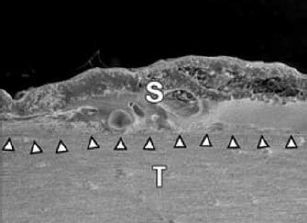
92. ábra.
Solderes megerősítés. (S-megolvadt solder, T-tissue-az érfal szövete)
Az aneurysma képződés megelőzésében nagyon fontos az érvégek pontos adaptációja. Ebben a szövetbarát, nem felszívódó anyagból készült irányöltéseknek van elsődleges szerepük. Ezt szolgálja még pl. a speciális, kompressziós klammerek alkalmazása is (151). (93. ábra). Nakadate (152) szerint ugyanis, amikor az ér egyik oldalán lézer összeolvasztást végeznek, az zsugorodással jár, s a másik, még nem kezelt oldalon széthúzódnak az érvégek. Ezt lehet korrigálni a speciális klammerpárral (93., 94. ábra).

93. ábra.
Kompressziós klammerpár

94. ábra.
Disztrahált és közelített klammerek
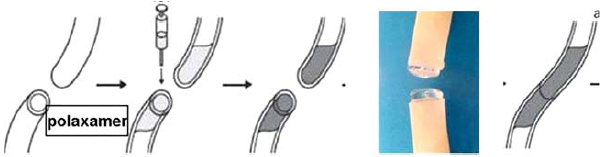
95. ábra.
Ideiglenes, intraluminaris polaxamer rúd készítése
Javítják az adaptációt a különböző intraluminalis egyeztetető eljárások. Ilyen, mint már az érragasztásnál is említettük, az ércsonk oldalán bevezetett, felfújható ballonkatéter, vagy szilikonrúd, amelyeket a lézerkezelés után eltávolítanak. Hasonlóképen eredményesek voltak pl. albuminból, de különböző ártalmatlan műanyagokból pl. polaxamerből készült, nedvességre, vagy hőváltozásra megszilárduló, majd fel oldódó vezetőrudak is (95. ábra), amelyekre felhúzták az érvégeket.
96. ábra.
Lézeres Cimono-shunt
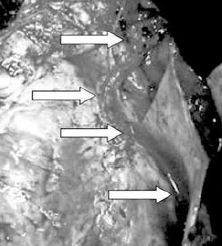
97. ábra.
Lézeres sapheno- coronaria bypass
A lézeses éranastomosist emberen is alkalmazták, de a lézeres klinikai éregyesítés még manapság is elég ritka. Leclére és munkatársai, 2011-ben publikált, 30 éves irodalmi gyűjtőstatisztikájukban, amelyben 354 közlést vizsgáltak meg, mindössze öt ilyen szerzői csoportot találtak (153):
- az első közlés a lézeres ér anastomosis leírójától, Jain-től származik 1984-ből, aki öt extra-intracranialis, microvascularis bypass műtétet végzett tartós quantitatív sikerrel (154).
- a második White és munkatársai voltak Ciminoshunt műtéttel 45 éves nőbetegen, 1985-ben (96. ábra) (155). Összesen tíz ilyen beavatkozást végeztek.
- harmadikként Okada és mtsai (156, 157) 1987-ben 15 sapheno-coronaria bypasst készítettek (97. ábra).
- a perfériás ereken is 35 anastomosist végeztek sikerrel, komplikáció nélkül 1987-ben (98. ábra).
- a negyedik közlés Mordon és munkatársaitól való 2001-ből, ez 12 ujjreplantációról szól (158) (99. ábra).
- az ötödiket Leclére munkacsoportja 2011-ben szintén replantacióról közölte (153).
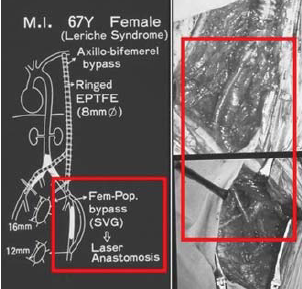
98. ábra.
Lézeres femoro-poplitealis bypass
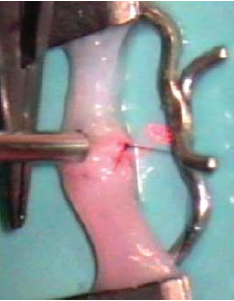
99. ábra.
Lézeres microvascularis anatomosis képe digitális artérián, közvetlenül a műtét után
A lézeres éregyesítés egy sok tekintetben bíztató, több évtizedes kísérleti munka, amelyik az eddigi jó eredmények ellenére még nem tartozik az érsebészet rutin fegyvertárába. Magyar vonatkozású munkáról nem tudunk.
Irodalom
- Vasko J. S., Brockman S.K.: Clinical and experimental experiences with plastic adhesives. Ann. Surg, 1965; 162: 123-129.
- Coover H. W., Joyner F. B., Shearer N. H., Wichner T. H.: Chemistry and performance of cyanoacrylate adhesives. Soc. Plastic. Engineers J. 1959; 15: 413.
- Gyurkó Gy., Nemes Z.: Szövetragasztó alkalmazása a helyreállító érsebészetben. Orvostudomány. 1975; 26: 165-196.
- BioGlue® Summary of Safety and Effectiveness CryoLife, Inc., BioGlue® Surgical Adhesive. h t t p s : / / w w w . a c c e s s d a t a . f d a . g o v / cdrh_docs/pdf/P010003b.pdf
- Spotnitz W. D.: Fibrin Sealant: The only approved hemostat, sealant, and adhesivea laboratory and clinical perspective. Review article. SRN Surgery. Volume 2014 (2014), Article ID 203943, 28 pages. http://dx.doi.org/10.1155/2014/203943
- Inou T.K., Yoshimura T., Furukama T., Hino K. K., Mizuno K., Ota K., Kimoto W., Kimoto D.: Studies on surgical use of plastic adhesive. Bull. 2nd Surg. Klin. Tokyo Univ. Hosp. 1961; 1-15.
- Carton C, A., Heifetz M. D., Kessler L.: Patching of intracranial carotid artery in man using plastic adhesive (Eastman 910 Adhesive) J. Neurosurg. 1962; 19: 887.
- Gyurkó Gy.: Szövetegyesítés ragasztóanyaggal. Orv. Hetil. 1967; 108: 544-546.
- Nemes A., Sótonyi P.: Adatok az "Eastman 910" szövetragasztó monomer sebészeti alkalmazásához. Orv. Hetil. 1967; 108: 2270.2272.
- Nemes A.: Érreconstructio gyorspolymerizáló ragasztóanyag segítségével. Szegedi Angiológiai Napok 1968. A Magyar Angiológiai Társaság kiadványa. 29-30. old.
- Carton C.A, KesslerJ. A., Seidenberg.B., Hurwitt E.S.: Experimental studies in the surgery of small vessels IV. Nonsuture anastomosis of arteries and veins using flanged ring prostheses and plastic adhesives. Surg. Forum. 1960; 11: 238.
- Nathan H. S., Solomon R.D., Halpern R.D., Seligman A.M.: Nonsuture closure of arterial incisions using a polimerising adhesive. Ann Surg. 1960; 152: 648-658.
- Carton C. A. L., Kessler L. A., Seidenberg . S., Hurwitt E. S.: Experimental studies in surgery of small vessels. II. Patching of arteriotomy using a plastic adhesive. J. Neurosurg. 1961; 18: 188.
- Seidenberg B. Hurwitt E. S.: Non-suture technique for vascular anastomosis. Dis. Chest. 1963; 44: 529-532.
- Kim D.V., Jengt J.H., Son E. I., Yim H. B., Kim I. H.: Experimental study of microvascular anastomosis using biological fibrin glue. J. Kor. Neur. Soc. 1989; 18: 262-272.
- Han S. K., Kim S.W., Kim W. K.: Microvascular anastomosis with minimal suture and fibrin glue: experimental and clinical study. Microsurgery. 1998; 18: 306-311.
- Vokrri L., Quavdarbasha A., Ahmetaj H., Manxhuka-Kërliu S., Hysenhi N., Porcu P., Cinquin P., Sesa C.: Experimental study of sutureless vascular anastomosis with glued prosthesis in rabbits. Vascular Health and Risk Management. 2015; 11: 211-217.
- Bauer F., Fichter A., Loeffelbein D., Dietrich K., Schütz K., Mücke T.: Microvascular anastomosis using modified micro stent: a pilot in vivo study. J. Cranio-Maxillofac. Surg. 2015; 43: 204-207.
- Khorgami Z., Shoar S., Nasini S., Mahmoodzadeh H.: Stent-and-glue sutureless vascular anastomoses. Med. Hypoteses. 2011; 77:94-96
- Gurtner G., C., et al.: Vascular anastomosis using controlled phase transitions in polaxamer gels. Nat. Med. 2011; 17: 1147-1152.
- Yohida W.B., Naresse L.E., Rodrigues A. C., Fabris V. E., Angeleli A.Y.: End to end arterial anastomosis with fibrin glue in larger arteries: histology, hydroxyprolin concentration and tensile strength study in carotis of rabbits. Acta Cir. Bras. 2002; 17:
- Qu L.,Jing Z., Wang Y.: Sutureless anastomoses of small and medium sized vessels by medical adehesives. Microsurgery. 1998; 18: 306-311.
- Alvaro C., Mattar R.: Effect of fibrin adhesive application in microvascular anastomosis: a comparative experimental study. Plastic. Reconstr. Surg. 2007; 119: 95.
- Jain K. K, Gorisch W.: Repair of small blood vessels with the Neodynium: YAG laser. Surg. A preliminary study.1979; 85:684-688.
- Hunter J.G, Dixon J. A.: Lasers in cardiovascular Surgery- Current status. Werst. J. Med. 1985; 243? 506-510.
- Wolf-de Jonge I., C. D. Y., Beek J. F., Balm R.: 25 years of laser assisted vascular anastomosis (LAVA) What have we learned? Eur. J. Vasc. Endovasc, Surg. 2004; 27: 466-476.
- Quigley M. R., Bailes J. E., Kwaan H. C., Cerullo L.J. Brown J.T., Lastre C., Monma D.: Microvascular anastomosis using the milliwatt CO2 lazer. Lasers in Surgery and Medicine. 1985; 5: 357-365.
- Chen C., Peng F., Xu D., Cheng Qu.: Laser assisted vascular anastomosis(LAVA) a promising non sutture technique for surgery. Eight International Conference on Photonics and Imaging in Biology and Medicine. Wuhan 2009. Proceedings Volume7519.
- McCarthy W. J., Hartz R.S., Yao S.T., Sottiurai V. S., Kwaan H. C., Michaelis L. L.:Vascular anastomoses with laser energy. J. Vasc Surg, 1965; 3: 32-41.
- Pabittei . R., Heger M., van Tuijl S., Simonet M., de Boon W., van der Val A., Balm R., de Mol B. A.: Ex vivo prof-of-concept o end-to-end scaffold-enhanced laser assisted vascular anastomosis of porcine arteries. J. Vasc. Surg. 2015; 62: 200-209.
- Bregy A., Bogni S., Bernau V. J. P., Vajtai I., Vollbach F., Petri-Fink A., Constantinescu M., Hofman H., Frenz M., Reinert M.: Solder doped polycaprolactone scaffold enalbles reproducible laser tissue soldering. Lasers Surg. Med. 2008; 40: 716-721.
- Mlbaidjol Z., Kiermeir D., Schönfeld A., Arnoldi J., Frenz M., Constantinescu M. A.: Endoluminal laser- assisted vascular anastomosis-an in vivo study in a pig model. Lasers Med. Sci. 2017; 32: 1343-1348.
- Fleming A. F. S., Colles M. J., Guillianotti R., Brough M. D. Brown S. G.: Laser assisted microvascular anastomosis of arteries and veins: laser tissue welding. Brit. J. Plast. Surg. 1988; 41: 378-388.
- Pabittei D. R., de Boon W., van Golen R. F., Balm R., Legemate D. A., de Mol B. A.: Laser assisted vessel welding: state of the art and future outlook. J. Clin. Translaton. Res. 2015; ? 41-67.
- Nakadate R., Omori S., Ikeda, R., Akohoshi T., Oguri S., Arata J., Onogi S., Hashizume M.: Improving thr strength of sutureless laser-assisted vessel repair using preloaded longitudinal compression on tissue edge. Lasers Surg. Med. 2017; 9999: 1-6.
- Leclére F. M., Duquennoy-Martini V., Schoofs M., Mordon S.: Trente ans de microanastomoses vasculaires assistées par laser. Neurochirurgie. 2011; 57: 1.8.
- Jain K. K.: Sutureless extra-intracranial anastomosis by laser. Lancet. 1984; 8406: 816-817.
- White R. A., White G. H., Fujitani R. M., Vlasak R. M., Donayre C. E., Kopchok G. E., et al.: Initial human evaluation of argon laser assisted anastomoses. Surg. 1989; 9: 542-547.
- Okada M., Shimizu K., Ikuta H., Horii H., Nakamura K.: An alternative method of vascular anastomosis by laser: experimental and clinical study. Lasers Surg. Med. 1987; 3: 240-248.
- Okada M.., Yoshida M., Tsui Y., Horii H.: Clinical application of laser treatment for cardiovascular surgery. Laser Ther. 2011; 20: 217-232.
- Mordon S., Schoofs M., Martinot V., Buys B., Patenotre P.,Lesage J. C., et al.: 1.9 m diode laser assisted anastomoses in reconstructive microsurgery: preliminary results in 12 patients. 2001. In: Delacretaz G. (Ed), Laser-tissue interaction, Tissue optics end laser welding, 3195. SPIE, Bellingham, pp. 2-6.
Dr. Bartos Gábor
Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2020/4. 115-122. oldal


