A dyslipidaemia jelentős cardiovascularis rizikótényező. Az atherogen dyslipidaemia, amelyet emelkedett triglicerid, small-dense (low-density lipoprotein) LDL-koleszterin és alacsony (high-density lipoprotein) HDL-koleszterin szint jellemez nem ritka diabeteses, elhízott betegeknél (metabolikus szindróma). Ilyen esetekben gyakori, hogy a plazma LDL-koleszterin szintje normális vagy csak mérsékelten emelkedett. Számos bizonyíték támasztja alá, hogy a magas triglicerid és/vagy az alacsony HDLkoleszterin szint az LDL-koleszterintől független cardiovascularis rizikótényező. Az antilipaemiás kezelés bázisát a sztatin terápia jelenti, ugyanakkor az eredményes LDL-csökkentés ellenére még mindig jelentős marad a cardiovascularis (reziduális) rizikó. A metabolikus szindróma patofiziológiájában meghatározó tényező az inzulin- rezisztencia/hyperinsulinaemia, illetve a visceralis obesitas. Ezek állnak a jellegzetes lipideltérések hátterében. Az atherogen dyslipidaemia kialakulása mellett a reziduális rizikót növelő, nem-fertőzéses, gyulladásos mechanizmusú folyamatok is aktívabbak. A magas triglicerid, trigliceridben gazdag VLDL és az alacsony HDLkoleszterin szint hozzájárul a macro- (myocardialis infarctus, stroke, obliterativ verőérbetegség) és microvascularis (nephropathia, retinopathia, neuropathia) szövődmények kialakulásához.
Érbetegségek: 2010/2. 3-7. oldal
KULCSSZAVAK
atherogen dyslipidaemia, metabolikus szindróma, reziduális kockázat, fibrátok
A dyslipidaemiák és az érrendszeri betegségek közötti összefüggés már több évtizede ismert. E tekintetben először az emelkedett szérum össz-, majd később a kórosan magas LDL-koleszterin került látótérbe (Framingham, MRFIT, PROCAM stb. tanulmányok és epidemiológiai megfigyelések). A koleszterin-háztartás zavarainak jelentőségét még inkább aláhúzta a sztatinok megjelenése, s az általuk kifejtett megkérdőjelezhetetlen terápiás eredményesség (1, 2). Számos nagy nemzetközi tanulmány bizonyította, hogy a cardiovascularis megbetegedések rizikója sztatinok alkalmazásával 20-35%-kal csökkenthető (WOSCOPS, 4S, CARE, LIPID, stb.)( 1. ábra). Ezután logikus volt feltenni azt a kérdést, hogy a fennmaradó 65-80%-nyi ún. maradék (reziduális) rizikó a lipidháztartás egyéb tényezőivel (HDLkoleszterin, triglicerid, apolipoproteinek, stb.) összefüggésben áll-e? Az elmúlt évek nagy vizsgálatai erre is választ adtak. Kiderült, hogy az emelkedett szérum triglicerid, illetve az alacsonyabb HDL-koleszterin szint, függetlenül az össz- és az LDL-koleszterin értéktől önálló rizikótényezők.

1. ábra.
Reziduális rizikó sztatinnal folytatott vizsgálatokban.
(Kék oszlopok = LDL-koleszterin csökkentéssel elért ISZB rizikócsökkenés %-ban)
(Sárga nyilak = Reziduális rizikó)
4S = Scandinavian Simvastatin Survival Study,
CARE = Cholesterol And Recurrent Events,
WOSCOPS = West of Scotland Coronary Study,
LIPID = Long-term Intervention with Pravastatin in Ischemic Disease,
AFCAPS = Air Force/Texas Coronary Atherosclerosis Prevention Study,
HPS = Heart-Protection Study,
PROSPER = Prospective Study of Pravastatin in Erderly at Risk,
CARDS = Collaborative Atorvastatin Diabetes Study,
ASCOT = Anglo-Scandinavian Cardiac Outcomes Trial
Mindezt, többek között a Framingham, VA-HIT, Helsinki Heart study, PROCAM, TNT, PROVE-IT, stb. tanulmányok eredményei erősítették meg. Az elmúlt néhány évben végzett kísérletes és klinikai vizsgálatok arra is rávilágítottak, hogy a dyslipidaemiák patofiziológiája sokkal összetettebb, mint azt két-három évtizeddel ezelőtt gondoltuk.
A dyslipidaemiáknak számos klinikai megjelenési formája ismert (hypercholesterinaemiák, hypertriglyceridaemiák, kombinált hyperlipidaemiák stb.) Ezek közül némelyek ritkábban, mások lényegesen gyakrabban fordulnak elő. Az egyik leggyakoribb lipidháztartási zavar az ún. atherogen dyslipidaemia, egy olyan entitás, amely a metabolikus szindróma egyik klasszikus jellemzője. A metabolikus szindróma diagnózisának felállításához a következő 4 patológiás jelenség közül 3 kimutathatósága szükséges: abdominalis (intraabdominalis vagy visceralis) obesitas, hypertonia, szénhidrát-háztartási zavar, illetve atherogen dyslipidaemia. A metabolikus szindróma fennállása esetén gyakran számos további patológiás paraméter, illetve kórfolyamat is megfigyelhető (1. táblázat). Ezeknek együtthatása eredményezi a metabolikus szindróma mellett gyakran megfigyelhető cardialis, továbbá micro- és macrovascularis szövődményeket.
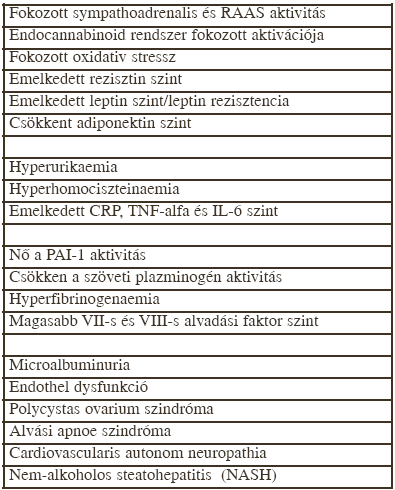
1.táblázat.
A metabolikus szindróma esetén gyakran megfigyelhető kóros paraméterek, kórfolyamatok.
Atherogen dyslipidaemia kialakulásának patomechanizmusa
Hypertriglyceridaemia kialakulása
A metabolikus szindróma patomechanizmusának központjában - a jelenleg leginkább elfogadott elmélet szerint - az inzulinrezisztencia áll. Ennek számos következménye van. Miközben a visceralis zsírszövet rezisztensebbé válik az inzulinra, érzékenyebb lesz a lipolítikus hormonokra. A fokozott lipolítikus aktivitás pedig szabad zsírsav felszabaduláshoz vezet. A szabad zsírsav szint emelkedéséhez a kórképre jellemző fokozott sympathoadrenalis aktivitás is hozzájárul. A máj azonban nem csak a fokozott szabad zsírsav beáramlásnak van kitéve, hanem lényegesen nagyobb a triglicerid terhelése is. Az inzulinrezisztencia, továbbá a máj fokozott apolipoprotein-C-III (apo-C-III) szintézise miatt ugyanis csökken az endothelhez kötött lipoprotein-lipáz aktivitása, aminek következtében pedig nem bomlanak le megfelelően a trigliceridben dús kilomikronok, illetve a trigliceridben ugyancsak gazdag, máj által szintetizált VLDL részecskék. Így a kilomikronok, illetve a VLDL remnantok sok trigliceridet szállítanak a májba. Inzulinrezisztencia fennállásakor a fiziológiás mennyiséget meghaladó szabad zsírsav és triglicerid terhelés a máj bizonyos anyagcsere-folyamatait megváltoztatja. Többek között fokozódik az apolipoprotein-B100 (apo-B100) és apo-C-III, továbbá a VLDL és triglicerid szintézise, valamint a glükoneogenezis. A triglicerid intenzívebb szintézise és elhúzódó lebomlása a trigliceriddús lipoproteinek plazma koncentrációjának növekedéséhez vezet. Ily módon elnyújtottabb lesz a postprandiális hypertriglyceridaemia, ami pedig szorosabb összefüggést mutat az atherosclerotikus folyamatokkal, mint az éhomi triglicerid szint. (3, 4) A fokozott apo-C-III termelés is különleges jelentőséggel bír, miután gyulladásos faktorok és a monocyták aktiválásán keresztül károsítja a vascularis endothelt, valamint a pancreas béta-sejtjeit.
LDL-anyagcsere
A VLDL-IDL-LDL átalakulás is zavart szenved. Az atherogen dyslipidaemia kialakulása a VLDL-IDL-LDL átalakulás viszonylagos lassúságában, elégtelenségében rejlik. Fiziológiás körülmények között az VLDL, IDL, LDL részecskék apo-B100 fehérjét és döntően koleszterinésztert tartalmaznak. Miután ezek a molekulák atherogenek, ebből az is következik, hogy a plazma apo-B szintje nagyon jó markere a cardiovascularis veszélyeztetettség mértékének (5).
A koleszterinészter-transzfer protein (CETP) az LDL-ben, HDL-ben, VLDL-ben és kilomikronban lévő koleszterinésztert trigliceridre cseréli. Ha az enzim aktivitása nő - pl. inzulinrezisztencia esetén - sok, koleszterinészterben szegény és trigliceridben gazdag LDL részecske keletkezik. Ezt a fokozott aktivitású hepaticus lipáz kicsi, sűrű (small- dense) LDL molekulára hidrolizálja. Inzulinrezisztencia esetén tehát kisebb, sűrűbb LDL részecskék jönnek létre, amelyekben kevesebb a koleszterinészter, és viszonylagosan sok a triglicerid. Ez az ún. B típusú LDL. Emellett a plazma LDL koncentrációja normális, vagy csak kis mértékben emelkedett. A kisméretű és nagy sűrűségű LDL részecskék fogékonyak az oxidációra, illetve további jellemzőjük, hogy az ún. scavenger receptorokon keresztül jutnak az intracelluláris térbe. A máj és a perifériás sejtek ugyanis az LDL 70%-át az LDL receptorokon, míg a maradék 30%-ot az ún. scavenger receptorokon keresztül veszik fel. Ezekhez a receptorokhoz azonban nem csak az ép LDL, hanem a módosult (pl. oxidálódott) LDL részecskék is kötődnek. Az ilyen módon sejtbe jutott koleszterin viszont nem gátolja a koleszterin további képződését, s így a sejtekben egyre több koleszterin halmozódik fel ("habossejt" képződés) (6).
HDL-anyagcsere
Az inzulinrezisztencia következtében a HDLanyagcsere jellemzői is megváltoznak. A HDL fő feladata a perifériás koleszterin visszajuttatása a májsejtekhez (reverz transzport). Ezáltal a HDL antiatherogen hatású. A HDL-koleszterin kivételével valamennyi lipidrészecske atherogen. Ezért is vezették be a "nem-HDL-koleszterin" fogalmát (összkoleszterin - HDL-koleszterin). Ez az érték az LDL-koleszterintől kb. 0,8 mmol/l -rel tér el.
A perifériás sejtek koleszterinje egy fehérje, az ún. ATP binding casette protein (ABCA1) segítségével kerül a HDL-re. Inzulinrezisztencia esetén az ABCA1 fehérje aktivitása csökken, míg a CETP-é nő. Ez utóbbi következtében a HDL részecskék is trigliceridben gazdagabbak lesznek, amelyekből a hepaticus lipáz segítségével, az LDL-hez hasonlóan kicsi és sűrű HDL keletkezik. Ez pedig alkalmatlan a koleszterin reverz transzportjára. (7, 8)
Ezeknek a változásoknak az eredménye, hogy kialakul az atherogen dyslipidaemiát jellemző 3 "klasszikus" eltérés: az emelkedett éhomi és/vagy posztprandiális triglicerid szint, az alacsonyabb HDL-koleszterin szint és a kicsi, sűrű LDL-részecskék plazmakoncentrációjának növekedése. Az előzőkben összefoglaltak értelmében, mindezek mellett, a metabolikus szindróma kóros lipidanyagcseréjét jellemzi még: az apo-B100, apo-C-III, szabad zsírsavak, trigliceridben dús "remnantok" emelkedett plazmaszintje is.
Nem szabad elfelejteni, hogy a metabolikus szindrómát nem csak az atherogen dyslipidaemiának nevezett lipidháztartási zavar, hanem, azzal némiképp összefüggésben számos egyéb kóros változás is jellemzi.
Az inzulinrezisztencia-hyperinsulinaemia mellett az utóbbi években egyre inkább látótérbe került a visceralis obesitas kóroki szerepe. Bebizonyosodott, hogy az abdominalis zsírszövet az egyik legaktívabb endocrin/paracrin szervünk. Számos olyan "mediátort" termel, amelyek a szervezet működését jelentősen befolyásolják. Ezek között a faktorok között vannak ún. gyulladásos mediátorok (IL6, C-reaktiv-protein, TNFalfa), a haemostasist befolyásoló vegyületek (VII-es és VIII-as alvadási faktor, fibrinogén, szöveti plasminogen aktivátor, plasminogen-aktivátor inhibitor), a zsíranyagcserére közvetlenül ható anyagok (leptin, viszfatin, retinolbinding protein-4, perilipin, acilációt stimuláló protein), továbbá a sejtproliferációt serkentő ún. növekedési faktorok (9).
Az előzőekben említett, a lipidháztartás részét képező faktorok is érdemi hatással vannak a szervezet számos alapfolyamatára. A trigliceridben dús VLDL particulumok, például az intracelluláris jelátvitel szintjén aktiválnak pro-inflammatorikus géneket, továbbá fokozzák a fibrinolítikus folyamatokat gátló plaminogen aktivátor inhibitor-1 (PAI-1) képződését. Az apo-C-III gyulladásos és pro-atherogen cytokinek termelését serkenti (10). Magasabb triglicerid szint mellett aktívabb a véralvadási rendszer, és kisebb a fibrinolítikus aktivitás. A postprandialisan megfigyelhető trigliceridben dús lipoproteinek pedig aktiválják a VII-s véralvadási faktort (11).
Az LDL-koleszterintől függetlenül a magas triglicerid és/vagy alacsony HDL-koleszterin szint egyértelműen elősegíti a diabeteses proliferativ retinopathia kialakulását (12). Hasonlóan pozitív korrelációt találtak a szérum apo-B szintje és a retinopathia súlyossága között. Ezek után nem meglepő, hogy a magas triglicerid és a trigliceridben gazdag VLDL plazma koncentráció, illetve az alacsony HDL-koleszterin szint gyorsítja a nephro- és neuropathia progresszióját.
Összességében ezek, az előzőekben részletezett változások okozzák azokat, a kezdetben túlnyomórészt funkcionális, majd egyre inkább strukturális eltéréseket, amelyeket a metabolikus szindróma fennállása esetén láthatunk. Ilyenkor ugyanis kedvezőtlen és jelentős változások következnek be a lipid- és szénhidrát-anyagcserében (atherogen dyslipidaemia, dysglykaemia), felerősödnek a nem-infectiv gyulladásos jellegű folyamatok, fokozódik a thrombosis hajlam, romlanak a haemorheologiai viszonyok; funkciójában, majd strukturálisan sérül a cardiovascularis rendszer (endothel diszfunkció, microalbuminuria, majd atherosclerosis), s végül súlyos szervkárosodások következnek be.
A klinikumban ez ún. macro- (ischaemiás szívbetegség, obliterativ verőérbetegség, stroke) és microvascularis (retinopathia, nephropathia, neuropathia) szövődményként jelenik meg.
A metabolikus syndromát jellemző komplex anyagcsereváltozások, amelyeknek csak egy részjelensége az atherogen dyslipidaemia, a szervezet számos szervének, szövetének és sejtjének működését jelentősen befolyásolják. Így áll össze az a klinikai tünetegyüttes, amelynek, a szív- és érrendszeri szövődményeken kívül, további összetevője lehet az alvási apnoe, a polycystás ovarium, a nem-alkoholos zsírmáj, stb.
Therapiás megfontolások
A dyslipidaemiák kezelése során kétség kívül a legtöbb bizonyíték és tapasztalat az LDL-koleszterin csökkentésével, illetve a sztatin terápiával kapcsolatban áll a rendelkezésünkre. A legfontosabb terápiás célkitűzésünk is, az LDL-koleszterin megfelelő csökkentése. Az ún. terápiás célértékeket ld. a III. Magyar Kardiovaszkuláris Konszenzus Konferencia ajánlásaiban (13,14). Azonban, mint az, az eddigiekből is kiderült az atherogen dyslipidaemiára csak kevéssé jellemző az emelkedett összés LDL-koleszterin szint. Éppen ezért, ennél a betegpopulációnál az életmódváltoztatás (rendszeres fizikai aktivitás; mediterrán jellegű, állati zsírban szegény, ugyanakkor telítetlen növényi olajokban, rostban gazdag diéta; dohányzás felfüggesztése, stb.) mellett mindenképpen szóba jön a HDL-szintet emelő, és a trigliceridszintet csökkentő fibrátok (illetve nikotinsav származékok, omega-3-zsírsavak) alkalmazása. Annál is inkább, miután a fibrátok a sejtmag peroxiszóma proliferációt aktiváló alfa-receptorain (PPAR-alfa) keresztül fokozzák a HDL fő apolipoproteinjeinek (apo-AI és apo-A-II) termelődését, továbbá növelik a lipoproteinlipáz aktivitását és gátolják az apo-C-III termelődését. Mindezeknek eredményeképpen a HDL-szint emelkedik, a small-dense LDL szint csökken. Talán kevésbé ismert, hogy a fibrátoknak is van ún. pleiotrop hatása, amellyel összefüggésben bizonyítottan nő az áramlás mediálta vasodilatatio, javul az endothel diszfunkció, csökken a gyulladásos markerek (pl. CRP), a fibrinogén, a PAI-1, a szabad zsírsavak, a TNF-alfa, a leptin, stb. szintje. Összességében pedig nő a sejtek inzulin érzékenysége.
A két leggyakrabban használt és legtöbbet vizsgált fibrát a gemfibrozil és a fenofibrát. Hatásaikat tekintve sok vonatkozásban azonosak, metabolizmusukban és eliminációjukban azonban érdemi különbségek vannak. Ezzel magyarázható, hogy míg a fenofibrát jól kombinálható sztatinokkal, addig a gemfibrozil, - gátolva a sztatinok hepaticus metabolizációját, - sztatinnal együttadva lényegesen gyakrabban okoz myopathiát. Ez pedig azért fontos, mert a jelenleg érvényben lévő hazai és nemzetközi terápiás ajánlások, - szemben a korábbiakkal, - nem tiltják, sőt megfelelő indikáció esetén javasolják a kettős antilipaemiás gyógyszeres kombináció (pl. sztatin+fibrát) alkalmazását. Mindezt figyelembe véve, - javaslataik szerint - fibrát terápia bevezetésének szükségessége esetén elsősorban a fenofibrát ajánlható.(15)
Irodalom
- Baigent C., Keech A., Kearney P.M. et al.: Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90.056 participants in 14 randomised trials of statins. Lancet 366:1267-1278 (2005)
- Karádi I.: Hatékony LDL-csökkentés. Metabolizmus III. évf. (Suppl. A):34-37 (2005)
- Couillard C., Bergeron N., Prud'Homme D. et al.: Prostprandial triglyceride response in visceral obesity in men. Diabetes 47:953-960 (1998)
- Nordestgaard B.G., Benn M., Schnohr P., Tybjaerg- Hansen A.: Nonfasting triglycerides and risk of myocardial infarction, ischaemic heart disease, and death in men and women. JAMA 298:299-308 (2007)
- Jiang R., Schulze M.B., Li T et al.: Non-HDL cholesterol and apolipoprotein B predict cardiovascular disease events among men with type 2 diabetes. Diabetes Care 27:1991-1997 (2004)
- Tchernof A., Lamarche B., Prud'Homme D. et al.: The dense LDL phenotype. Association with plasma lipoprotein levels, visceral obesity, and hyperinsulinemia in men. Diabetes Care 19:629-637 (1996)
- Chan D.C., Barrett H. P., Watts G.F.: Dyslipidemia in visceral obesity: mechanisms, implications, and therapy. Am J Cardiovasc Drugs 4:227-246 (2004)
- Nofer J.R., Kehrel B., Fobker M. et al.: HDL and arteriosclerosis: beyond averse cholesterol transport. Atherosclerosis 161:1-16 (2002)
- Nádházi Z., Hőgye M., Forster T.: Metabolikus szindróma: visceralis obesitas, atherogen dyslipidaemia, diabetes mellitus, hipertónia és a kardiovaszkuláris rizikó. Metabolizmus VI. évf. 3.sz:1-4 (2008)
- Kawakami A., Aikawa M., Alcaide P. et al.: Apolipoprotein CIII induces expression of vascular cell adhesion molecule-1 in vascular endothelial cells and increases adhesion of monocytic cells. Circulation 114:681-687 (2006)
- Miller G.J., Martin J.C., Mitropoulos K.A. et al.: Plasma factor VII is activated by postprandial triglyceridaemia, irrespective of dietary fat composition. Atherosclerosis 86:163-171 (1991)
- Chowdhury T.A., Hopkins D., Dodson P.M., Vafidis G.C.: The role of serum lipids in exudative diabetic maculopathy: is there a place for lipid-lowering therapy? Eye 16:689-693 (2002)
- Karádi I.: Megfontolások a lipidológiai célértékekben és kezelési irányelvekben. Metabolizmus 4 (suppl. A):A34-A38 (2006)
- III. Magyar Kardiovaszkuláris Konszenzus Konferencia Ajánlása. 2007. Metabolizmus 2008 Suppl. 1.
- Paragh Gy., Karádi I.,Palik É., Márk L.: A diszlipidémia kombinált kezelésének lehetőségei. Metabolizmus VI. évf. 3.sz: 5-10 (2008)
dr. Nádházi Zoltán
Semmelweis Egyetem
II. sz. Belgyógyászati Klinika
1088. Budapest, Szentkirályi u. 46.
Érbetegségek: 2010/2. 3-7. oldal


