Hatásos preventív módszerek alkalmazása ellenére a vénás thromboembóliák még mindig gyakran alakulnak ki. A legújabb kutatások során az anticoagulánsok új osztályát fejlesztették ki: ezek az aktivált X faktort (fXa) szelektíven gátló szervek. Kimutatták, hogy a heparin-1ánc legrövidebb szegmentje, egy pentasacharid, kizárólag az antithrombinhoz kötődik. Az így létrejött konformációs változás következtében háromszázszorosra növekszik az alvadásban kulcsszerepet játszó fixa gátlása. A fXa neutralizációja hatásosan gátolja a thrombinképződést,, anélkül, hogy magára a thrombinra hatna. Az antithrombotikusok új oszlályában a fondaparinux az első szintetikusan előállított gyógyszer. Olyan előnyei vannak, amivel más szerek nem rendelkeznek. Kevesebb vérzést. okoz, mint a nemfrakcionált heparin, nem hat sem a vérlemezkékre, sem a thrombocyta 4-es faktorra. 4 nemzetközi, multicentrikus, randomizá1t, kettős-vak vizsgálat, amit több mint 7000 nagy, ortopédiai műtéten átesett betegen végeztek, a vénás thromboemboliák megelőzésében a fondaparinux egyértelműen nagyobb hatását demonstrálta, egy kismolekulasúlyú heparinnal, az enoxaparinnal szemben. A metaanalízis jelentős, 55,2%-os rizikócsökkenést mutatott ki a fondaparinux javára (p<0,0001). A fondaparinux alkalmazásával várhatóan az antithrombotikus profi1axis új korszaka kezdődik.
Érbetegségek: 2002/4. 113-119. oldal
KULCSSZAVAK
vénás thrombosis-profilaxis, anticolaguánsok új osztálya, pentasacharid, szelektív fXa gátlás, fondaparinux
Bevezető
A vénás thromboembólia (VTE) az ischaemiás szívbetegséget és a stroke-ot követő harmadik leggyakoribb cardiovascularis betegség (1). Az Egyesült Államokban évente 2 millió emberen alakul ki mélyvénás thrombosis (MVT) és mintegy hatvanezren halnak meg tüdőembóliában (PE) (2). Az Egészségügyi Világszervezet adatai alapján, Magyarországon a vénás betegségek mortalitása 1970 és 1990 között 100 000 lakosra számítva 10,8-ról 19,8-ra növekedett, tehát gyakorlatilag megduplázódott. Ezt követően a VTE okozta halálozás fokozatosan csökkent, 1999-ben 10,5/100 000 volt. A trend ugyan kedvező, 10 év alatt ledolgoztuk 20 év növekvő mortalitási rátáit. más közép-európai államokkal összehasonlítva azonban - Ausztria 4,2, Németország 4,1, Svájc 1.8/100 000 - eredményeink messze elmaradnak az elfogható adatoktól (3). A hatásos preventív módszerek alkalmazása ellenére, a VTE-k gyakorisága napjainkban is jelentős.
A thromboprofilaktikus módszerek történeti háttere
A MVT a tüdőembólia lehetőségével nemcsak akut életveszélyt jelent. Számolnunk kell a krónikus következlményekkel is, elsősorban a billentyűk és a vénafal károsodása következtében létrejövő subfascialis krónikus vénás elégtelenséggel. Ez a postthrombotikus szindróma rekurrens MVT k veszélyével jár, a végtagokon pedig nehezen gyógyítható lábszárfekély keletkezik. Az ulkus cruris Magyarország egyes vidékein népbetegségnek számít. A VTE-k költséghatása a népegészségügyre, gazdaságra jelentős. Ma már bizonyított tény, hogy a profilaxis olcsóbb, mint a nemmegelőzött VTE-k kezelési költsége. Érthető, hogy a múlt század kezdetétől egyre hatásosabb preventív módszereket kereslek. A thromboprofilaktikus módszerek történeti áttekintését mutatja az I. táblázat.

I. táblázat.
A thromboprofilaktikus módszerek történeti áttekintése. (A táblázatban kerekített évszámokat használtunk.)
A gyúgyszeres profilaxis filozófiája
A véralvadást két úton lehet gátolni.
- A koaguálcíciós faktorok koncentrációjának csökkentésével. Ez a K-vitamin ellenes anyagok alkalmazásával lehetséges. A K-vitamin felelős ugyanis egyes faktorok (II, VII, IX. X. XI. PC. PS) bioszintéziséért. Az ebbe a csoportba tartozó gyógyszerek közül legfontosabbak a kumarinok. Az anti-K-vitaminokat csak oralisan lehet adni. Hatásuk elnyújtott. Túldozírozásuk vérzést okoz. Pontos laboratóriumi ellenőrzést igényelnek. Más gyógyszerekkel, ételekkel gyakran kerülnek interakcióba.
- Az alvadási faktorok gátlásával. Ez a gátlás történhet:
- Direkt úton. A direkt inhibitor ilyenkor a gátlandó enzim aktív részéhez kötődik. Így hat a hirudin, ami a thrombinhoz kötődik. A hirudint régebben a pióca nyálmirigyéből készítették, ma genetikai módszerekkel állítják elő. Mivel fehérje, csak injekcióban adható. Ebben a csoportban a kutatók ma a hirudinnal rövidebb láncú anticoagulans peptideket keresnek. Szúnyogok, kullancsok véréből, denevér nyálából előállítható anyagokkal végeznek kísérleteket.
- A másik lehetőség az indirekt gátlás. Az indirekt inhibitorok az anthitrombinon keresztül hatnak. Az antithrombin a természetes alvadásgátló rendszer legfontosabb komponense. Egy különleges protein, aminek sajátos tulajdonsága, hogy csak így aktiválódik, ha az alakja megváltozik (conformational change). Csak akkor akadályozza a véralvadást, ha ez az alakváltozás létrejön. A szervezetben az endothélen jelenlévő szénhidrát molekulák egy csoportja. a heparánszulfátok, folyamatos konformációs változást okoznak az antitrombinon, ez folyamatosan akadályozza a véralvadást, ezért folyékony a vér.
A legfontosabb indirekt inhibitorok a heparin csoport gyógyszerei. Ezek ugyanígy aktiválják az antlthrombint, mint a heparánszulfátok.
- Direkt úton. A direkt inhibitor ilyenkor a gátlandó enzim aktív részéhez kötődik. Így hat a hirudin, ami a thrombinhoz kötődik. A hirudint régebben a pióca nyálmirigyéből készítették, ma genetikai módszerekkel állítják elő. Mivel fehérje, csak injekcióban adható. Ebben a csoportban a kutatók ma a hirudinnal rövidebb láncú anticoagulans peptideket keresnek. Szúnyogok, kullancsok véréből, denevér nyálából előállítható anyagokkal végeznek kísérleteket.
Heparinkutatás és fejlesztés
A heparinokat már az 1930-as évektől bevezették a klinikumba, és a VTE-k ellen közel 80 éve eredményesen alkalmazzák, noha hatásmechanizmusukat csak az 1970-es évekbeli tisztázták (4, 5). Régebben szarvasmarhák tüdejéből, ma disznóbélből történő extrakcióval készülnek. Csaknem azonnal, de rövid ideig hatnak, így elkerülhető a túladagolás. Thrombocytopeniát okozhatnak. A tradicionális, nem-frakcionált heparin különböző hosszúságú polisaharid láncok keveréke. A molekula polisacharid. azaz monosacharid egységekből álló lánc. Mivel a monosacharidok különböző gyököket, többek között szulfonát csoportokat (- SOS3 -) hordoznak, a heparinnak erős negatív töltése van. Ezzel magyarázható, hogy a szervezetben számos pozitív töltésű fehérjéhez kapcsolódik, így kötődik többek között a thrombinhoz is. A kutatások során sokáig hasonló hatású molekulákat kerestek, olyan módon, hogy szulfonát csoportokat adtak különböző természetes vagy mesterséges polimerekhez. Ezek a kísérletek azonban kudarcba fulladtak.. Kiderült ugyanis, hogy
- a túl erős töltés csökkenti az. anticoagulans aktivitást.
- a negatív töltés felelős a heparin mellékhatásaiért, többek között a thrombocytopeniáért,
- a negatív töltés korlátozza a hatás idejét, ezzel elősegíti az eliminációt,
Az 1970-es években megfigyelték, hogy az antithrombotikus hatás nem csökkent, ha a heparin adagját csökkentették, Ugyanakkor ,jelentős mértékben csökkent a vérzés kockázata. Így született meg a kisdózisú, "low dose" heparin. A jelenséget 1974-ben magyarázták meg. A véralvadás, ami egy enzimsorozat láncreakciójának következménye, minden egyes lépésben erősödik. Logikusan következett ebből, hogy a koagulációt hatásosabban lehet gátolni egy korábbi lépésben, amikor még az amplitikáció kicsi. Kimutatták, hogy 1 mikrogramm heparin, ami az aktivált X faktort (fXa) gátolja (- ez a faktor aktiválja a thrombint -), ugyanolyan anticoagulans hatású, mint 1000 mikrogramm heparin - ami a koaguláció egy későbbi lépésé-ben közvetlenül a thrombint gátolja.
1976-ban derült ki, hogy a heparin anticoagulans tulajdonságait a molekulasúly befolyásolja. A különböző hoszszúságú polisacharid-láncokból álló heparin, aminek molekulasúlya 15 000 dalton, egyformán gátolja a fXa-t és a thrombint. Kimutatták azt is, hogy míg az antifaktor Xa aktivitás a molekulasúlytól független, az antithrombin aktivitásához olyan polisacharid molekula szükséges, aminek a molekulasúlya legalább 6000 daltor és mintegy 20 monosacharid egységből áll. Ez a megfigyelés vezetett a kismolekulasúlya heparinok ("low molecular wight heparins", LMWH) kifejlesztéséhez.
Mivel a rövid (kismolekulasúlyú) oligosacharidok jobban gátolták az antithrombotikus hatás kulcstényezőjét, az fXa-t, tmint a thrombint, a katatások során arra törekedtek, hogy elkerüljék a hosszabb (nagymolekulasúlyú) oligosacharidok képződését, ugyanis az ilyen molekulákon alakultak ki azok a negatív töltések, amik a mellékhatásokat okozzák. Az LMWH-k tovább maradnak a keringésben, mint a standard heparin, ami lehetővé tette, hogy az injekciókat ritkábban adjuk. Régebben a standard heparin frakcionálásával, ma kémiai fragmentációval állítják elő őket. 1986-bar kerültek a klinikai gyakorlatba. Napjainkban az összes felhasznált heparin több mint fele LMWH.
Számos kérdés azonban továbbra is megválaszolatlan maradt:
- mennyire lehet a fragmentumok nagyságát csökkenteni úgy. hogy fXa hatásuk még megmaradjon?
- a jó antithrombotikus hatáshoz elég a tXa gátlása?
- a kizárólag fXa-t gátló gyógyszer hatásosabb, mint az LMWH
Az anticoagulánsok új osztálya
1976-bar Rosenberg Bostonban és Lindahl Uppsalában, egymástól függetlenül megállapították, hogy a heparin preparátumban jelenlévő láncoknak csak egyharmada kötődik az antithrombinhoz, és csak ezek a láncok csökkentik a véralvadást. Megfigyelésük fontos szerepet játszott a heparin továbbfejlesztésében.
Az 1980-as évektől Párizsban, a Sanofi-Synthélabo laboratóriunlában Jean Choay és munkatársai: Petitou, Herbet, Lormeau azt a legkisebb fragmentumot keresték, ami az antithrombinhoz kötődik és képes a fXa-t gátolni. A megoldás módszerét is megtalálták; először fragmentálni kell a heparint, szelektálni azokat a fragmentumokat, amik az antithrombinhoz kötődnek, majd ezeket az oligosacharidokat megfelelően tisztítani kell, végül meg kell vizsgálni a különböző fragmentumok anti fXa hatását. Így jutottak el egy pentasacharidhoz, vagyis egy 5 monosacharid szekvenciából álló lánchoz, amit DEFGH-val jelöltek. Ez az antithronlbinhoz kötődött, azt aktiválta, az antitrombin pedig válaszul a fXa-t gátolta. Az antithrombinhoz való kötődéshez alapvető volt egy szulfonált alegység, az "F subunit" jelenléte. Miután kezükben volt a szerkezet - von Boeck és Meuleman, az Organon kutatóinak segítségével - a szintetizálás kérdését is megoldották (6.7, 8). A szintetizált pentasacharid aktivitását a jelenlévő antithrombin automatikusan szabályozza. A túladagolás lehetősége így elkerülhető, mivel a szervezet a túl sok pentasacharidot eliminálja. Különösen fontos, hogy az előállított molekulák kizárólag az antithrolnbinhoz kötődnek. csak ez a céltáblájuk. Kis méreteiknek és kis elektromos töltesüknek köszönhetően a pentasacharidoknak nincs meg az a káros mellékhatásuk, ami a több heparin-származékkal jelen van; azaz nem kerülnek interakcióba a thrombocyta 4 faktorral (pf4), ami a heparinnal komplexet alkotva thrombocytopeniát (HIT) okoz. Az új szintetizált antitrombotikumok felezési ldeje (17 óra) is megfelelt a célkitűzéseknek, biohasznosulásuk csaknem 100%, ezenkívül jobban ellenőrizhetők, biztonságosabbak. mint az állati szervekből előállított termékek, ezeken ugyanis - legalább elméletileg - fertőzést okozó pathogen ágensek lehetnek. Specilicitásuk és szelektivitásuk miatt a pentasacharidok közvetlenül nem hatnak a trombinra. Mégis, azáltal, hogy az antithrombinhoz kötődve az fXa-t gátolják, a thrombinképződést is befolyásolják, 1 molekula antithrombin által előidézett 1 molekula fXa gátlása 50 molekula thrombin képződését akadályozza (9).
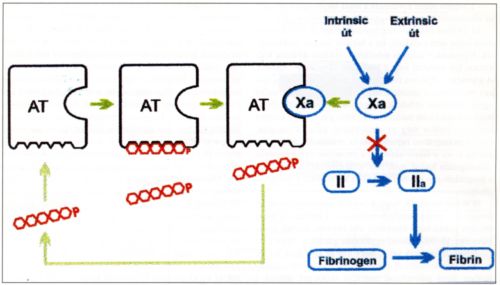
1. ábra.
A pentasacharid hatásmechanizmusa. AT - antithrombin, P = pentasacharid, Xa = aktivált X faktor, II = prothrombin, Ila = thrombin.
A pentasacharid hatásmechanizmusa
Az 1. ábra mutatja a részletes hatásmechanizmust. Egy-egy pentasacharid molekula 1 molekula anthitrombinhoz kötődik, egy specifikus kötőhelyen, nagy affinitással. A kötődés gyors, non-kovalens és reverzibilis. A kötődés konformációs változást idéz elő az antithrombinon. A változás következtében az antithrombinon szabaddá válik egy arginin reziduomot tartalmazó kacs. Ez a kacs az antitrombint az aktivált X faktorhoz kapcsolja. Ilyenkor az antithrombinnak az aktivált X faktor ellen kifejtett gátló hatása háromszázszorosára növekszik. Abban a pillanatban, amikor az antithrombin - aktivált X faktor kapcsolódás megtörtént, a pentasacharid leválik az antithrombinról. Ezt követően az egyes pentasacharid molekulák számos más antithrombin molekulához képesek kötődni. Ezzel szemben, a pentasacharid által az antithrombinon előidézett konformációs változás tartós és az antithrombinnak az aktivált X faktorhoz való kötése kovalens és irreverzibilis.
A túldozírozást a jelenlévő antithrombin molekulák korlátozzák. Amikor az összes antithrombin molekula a pentasachariddal telítődik, a fölösleges pentasacharid gyorsan kiválasztódik a veséken át. Ezután a pentasacharid lassan leválik az antithrombinról és az eredeti állapot visszaáll.
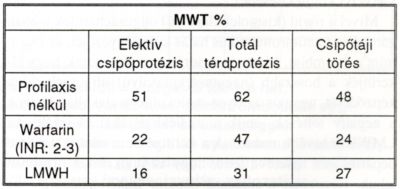
II. táblázat.
Az MVT előfordulása ortopéd-sebészeti betegeken.
Klinikai vizsgálatok
A gyógyszerként bevezetett első szintetikus pentasacharid a Sanofi-Synthélabo / Organon készítménye. Generikus neve; Fondaparinux Sodium. Kereskedelmi neve: Arixtra.
Ortopédiai műtétekre kerülő betegeken gyakran alakul ki postoperatív VTE. Ezek a betegek a legnagyobb kockázatú csoportba tartoznak, mivel ilyen műtéteknél a Virchow triász mindhárom komponense - a statis, hypercoagulabilitas, érsérülés - jelen van. Profilaxis nélkül elektív csípő-protézis beültetésnél, csípőtáji töréseknél MVT 50%-ban fordul elő, totál. térd-protézis implantációnál az arány még magasabb, csípőtöréses betegek 13%-a pedig PE-ben veszti életét (10). Hatásos protilaktikus módszerek alkalmazásával az eredmények ,javultak, de a MVT előfordulása még mindig jelentős (II. táblázat).
A fondaparinux első klinikai vizsgálatait ezért nagykockázatú ortopédiai betegeken végezték. A több mint 8000 betegre- kiterjedő alkalmazási program során az LMWH-khoz viszonyított preventív hatást és biztonságot vizsgálták. Csípő- és térd-protézis műtéteknél a LMWH-k hatásosabbak. mint az Egyesült Allanlokban egyes klinikákon előszeretettel alkalmazott warfarin (10), ezért választották ezeket összehasonlítási alapul. Az LMWH-k közül a világszerte regisztrált enoxaparinnal (Clexane / Klexane / Lovenox) végezték a vizsgálatokat. Eddig 5 internacionális, multicentrikus, randomizált, kettős-vak vizsgálatban hasonlították össze a két gyógyszer thromboprofilaktikus hatását.
Pentathon study (11)
Tulajdonképpen dóziskiválasztó tanulmány volt. A 69 amerikai, kanadai, ausztráliai centrumban végzett kettős vak, randomizált vizsgálat célja a VTE megelőzése csípőízületi totál-endoprotézis (TEP) beültetés során. A randomizált 933 betegből 593 teljesítette a kritériumokat, A betegek 2x30 mg enoxaparint, vagy 1 x fondaparinuxot kaptak, különböző (8 mg, 6 mg, 3 mg, 1,5 mg, 7 mg) adagban, a műtétet követően. Az 5-10. napon venographiát végeztek, a nyomonkövetés 40 napig tartott. MVT az enoxaparin csoportban 9.4%-ban, a fondaparinux csoportban 1.5 mg-os adag mellett 6,7%-ban, 3 mg-os adag mellett 1,7%-ban fordult elő. A VTE relatív rizikó redukciója a fondaparlnux javára 29% volt a 1,5 mg-os csoportban (NS) és 81% a 3 mg-os csoportban (p=0.01). Fatális PE az enoxaparin csoportban 1 volt. Jelentősebb vérzés csak 6-8 mg-os adagolás mellett fordult elő, thrombocytopeniát nem tapasztaltak a vizsgálat során.
Végeredményben a napi 1x1,5 mg fondaparinux adag ajánlott, ez jelentősen javítja a kockázat/előny arányát az LMWH-nal szemben.
Pentathlon 2000 study (12)
A 139 centrumban végzett kettős vak, randomizált vizsgálat során, 1584 betegen, ugyancsak csípőízületi TEP implantációt követően hasonlították össze a két gyógyszert. A fondaparinux csoportban 6%-ban, az enoxaparin csoportban 8%-ban keletkezett MVT. A relatív rizikócsökkenés 26,3% volt (95%-os konfidencia intervallum; -10,8%-tól 52,8%-ig). 1x2,5 mg fondaparinux ennél a vizsgálatnál nem volt szignifikánsan jobb preventív hatású, mint a 2X 30 enoxaparin.
Klinikailag nagyobb vérzés és thrombocytopenia egyformán minimálisan fordult elő, mindkét csoportban
Ephesus study (13)
73 európai centrumban, köztük Magyarországon, csípőízületi TEB beültetésen átesett 1827 betegen tanulmányozták a két gyógyszer preventív hatását. Az enoxaparint (lx 40 mg) a műtét előtt, a fondaparinuxot (lx 2,5 mg) a műtét után kezdték adni. A diagnózist az 5-10. napon venographiával állították fel. A randomizált, kettős vak összehasonlítás során a fondaparinux szignifikánsan csökkentette a MVT előfordulását (4%) az endoxaparinnal szemben (9%), 55,9-os relatív rizikó csökkenéssel (95%-os konflidencia ntervalllum: 33.1 %-72.8%, p<0,0001).
A két csoport között nem volt különbség a halálozás, a klinikailag fontos vérzés és a thrombocytopenia tekintetében.
Penthifra study (14)
Csípőtáji (combnyak-, pertrochanter-, subtrochanter-) törések miatt végzett műtétek során (osteosynthesis, fél-protézis, totál-protézis) 99 centrumban, 1250 betegen hasonlították össze a két gyógyszert. Magyarország 3 ccntrummal, 69 beteggel vett részt a vizsgálatban. A fondaparinux szignifikánsan csökkentette a MVT előfordulását a 11. napon (8,3%), az enoxaparinnal szemben (19.1%). A relatív rizikó redukció 56,4% volt, 95%-os konfidencia intervallum; 39,0% - 70,3% mellett. p
Pentamaks study (15)
Elektív, nagy térdműtétek után, 64 kanadai és amerikai centrumban 724 betegen tanulmányozták az enoxaparin és a fondaparinux protektív hatását. Priméren teljes térdprotézis implantációt, vagy revíziós műtéteket végeztek. A MVT gyakorisága szignifikánsan csökkent a fondaparinux csoportban (12,5%), a 11, postoperatív napon végzett venographia szerint, az enoxaparin csoporthoz viszonyítva (27,8%). Ez 55.2%-os relatív kockázatcsökkenést jelent, ahol a 99%-os konfidencia intervallum 36.2%-70.2% volt, p<0,001.
Nem volt különbség a két csoportban a jelentősebb vérzések és a thrombocytopenia tekintetében. Mindkét csoportban a 49 napig tartó megfigyelési időszakban 2-2 halálos és 1-1 nem-halálos PE fordult elő.
A klinikai vizsgálatok metaanalízise
Elkészült a pentasachariddal végzett klinikai vizsgálatok összefoglaló statisztikai áttekintése. Mivel az első tanulmány a Pentathlon study még dóziskereső, a megfelelő dózist kiválasztó vizsgálat volt, a méta-analízis a 4 nagy ortopédiai vizsgálat adatait értékelte, objektív statisztikai kritériumok alapján (16). Az eredményeket a III. táblázat és a 2. ábra mutatja.
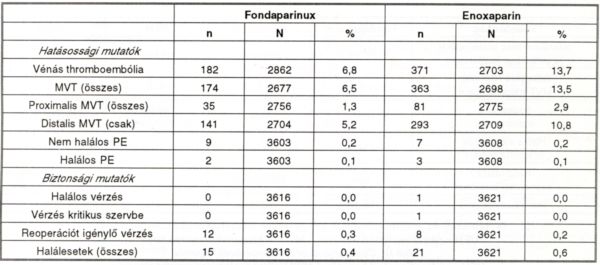
III. táblázat.
Gyakorisági és biztonsági mutatók a 11. napig. n = az adott betegségben szenvedők száma, N = a vizsgált összes beteg.
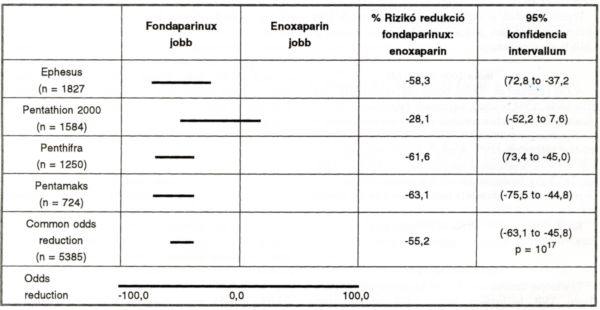
2. ábra.
A vénás thromboembóliák incidenciája a műtétet követő 11 napig. Fondaparinuxszal elért rizikóredukciók tanulmányonként és összesítve, extraparinhoz viszonyítva %-ban (95%-os konfidencia intervllum).
Az eredmények azt mutatják, hogy a fondaparinux hatásosabb a VTE megelőzésében, mint az enoxaparin, 55,2%-os rizikócsökkenéssel (p<0,0001). A különösen veszélyes proximalis MVT megelőzésében a fondaparinux még előnyösebb, itt a rizikócsökkenés 57,4%, 95%-os konfidencia intervallum mellett (35,6%-72,3%). A PE-k előfordulása mindkét preventív módszerrel kevesebb, mint 1 %. Ugyanakkor az előnyösebb hatás mellett a vérzés kockázata nagyon kicsi. A fondaparinux jellegzetes tulajdonságait (17) a IV. táblázatban foglaltuk össze.
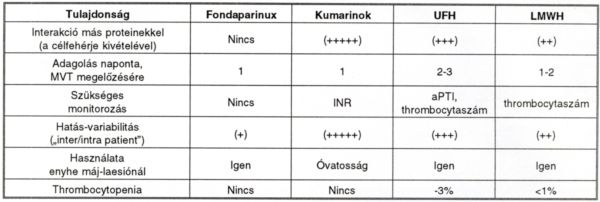
IV. táblázat.
Az antithrombotikus gyógyszerek összehasonlító tulajdonságai. UFH = nemfrakcionált heparin, LMWH = kismolekulasúlyú heparin.
Távlatok
A pentasachariddal nemcsak a profilaxis javallata alapján végeztek klinikai vizsgálatokat. A Rembrant tanulmány az akut proximalis MVT kezelésében mutatta ki az új gyógyszer előnyös és biztonságos hatását (18}. A Matisse tanulmányok több mint 4000 betegen vizsgálták a pentasacharidot. bizonyított MVT és bizonyított PE eseteiben. Szaporodnak a kardiológiai indikáció alapján végzett tanulmányok. Így az akut coronaria szindróma PTCA kezelésében tapasztalták a pentasacharid előnyös hatását (19), a Pentalyse vizsgálat során pedig az akut myocardialis infarktus fibrinolitikus kezelésében adjuváns szerként alkalmazták jó hatással (20). A Pentua vizsgálatban a fondaparinux legalább olyan előnyös volt instabil angina kezelésében, mint az enoxaparin. Jelenleg is folyamatban van a Pegasus vizsgálat, amelyben a fondaparinux és a dalteparin (LMWH) preventív hatását hasonlítjuk össze nagykockázatú hasi műtétes betegeken. A nyugat-európai országok után 2001 decemberében az Egyesült Államokban a nagyon kritikus FDA is regisztrálta a fondaparitluxot. Magyarországon 2003 tavaszán várható az új gyógyszer bevezetése. A pentasacharid alkalmazásával a vénás thromboembóliák megelőzésében jelentős áttörés történt. Az antithrombotikus profilaxisban várhatóan új korszak kezdődik
Irodalom
- Hirsh, J., Hoak. J.: Management of deep vein thrombocin and pulmonaty embolism. A statement for health care professionals. Ciculation 93: 2212-45. (1996)
- Silverstein, M. D., Heit, J. A., Mohr, D. N. et al.: Trends in the incidense of deep vein thrombosis and pulmonary embolism: A 25-year population based study. Arch. Intern. Med. 158: 585593 (1998)
- Sándor T.: Thrombosisprofilaxis az ezredfordulón. Érbetegségek 8 Suppl.: 9-15 (2001)
- Rák K: Heparin terápia 1998. (A 80 éves heparin mai alkalmazása.) Orv. Hetil. 140: 59-66 (1999)
- Sándor T.: Kismolekulasúlyú heparinok - az első l2 év. Érbetegségek 6: 37-44 (1999)
- Retitou, M., Lormeau. J. C., Chaay. J.: Chemical synthetic of gycosaminoglycant: new approaches to antitromhotic drugs. Nature (Suppl.) 350: 30-33 (1991)
- Herbert, J. M., Petitou, M., Lormeau, J. C. et el.: SR90107A/Org31540 a Novel Anti-Factor Xa Antithrombotic Agent. Cardiovasc. Drog Rev. 15: 1-26 (1997)
- Petitou M., Hérault, P., Bernat, A. et el.: Synthesis of thrombin inhibiting mimetics without side effects. Nature 398: 417-422 (1999)
- Lormeau, J. C., Hérault, J. P.: The effect of synthetic pentasac charide SR90107A/Org3154U on thrombin generation ex vivo is uniquely due to AT III mediated neutralization of factor Xa. Thromb. Haemost. 74:1474-77 (1995)
- Geerts, W. H., Heit, J. A., Clagett, G. P. et al.: Prevention of venous thromboembolism. Chert 119 Suppl: 132X-175S (2001)
- Tupie. A. G. G., Galus, A. ,S'., Hoek, J. H.: A synthetic penta cacharide for Prevention of deep vein thrombocis after total hip replacement. N. Engl. J. Med. 344: 619-625 (2001)
- Turpie, A. G. G., Bauer. K A., Eriksson, B. L, Lessen, M. R. for the PENTATHLON 2000 Study Steering Committee: Postoperative fondaparinux versus postoperative enoxaparin for Prevention of venous thrombolism after elective hip-replacement surgery: a randomized double blind trial. Lancet 359:1721-26 (2002)
- Lassen, M. R., Beuer, K. A.. Eriksson B. 1., Turpie, A. G. G. for the European Pentasacharide Hip Elective Surgery Study (EPHESUS)) Streeting Committee: Postoperative fondaparinux versus postoperative enoxaparin for Prevention of venous thromboembolism in elective hip replacement surgery: a randomized double blind comparison. Lancet 359: 1715-20 (2002)
- Eriksson, B. 1., Bauer, K. A.. Lassen. M. R., Tulpie. A. G. G. for the Streeting Comittee of 'the Pentasacharide in Hip Fracture Surgery~ S'tudy: Fondaparinux compared with enoxaparin for Prevention of venous thromboembolism after hip-fracture surgery. N. EngL J. Med. 345: 1298-1304 (2001)
- Beuer, K, A., Eriksson, B. L, Lessen. M. R., Turpie. A. G. G. for the Steering Committee of the Pentasacharide in Major Knee ,Surgery, Study: Fondaparinux compared with enoxaparin for the Prevention of venous thromboembolism after elective major knee surgery. N. EngL J. Med. 345: 1305-10 (2001)
- Turpie, A. G. G.: Overview of the clinical results of petitasacharide in major orthopedic surgery. Haematologica 86 (Suppl.) 59-62 (2001)
- Rosenvert, R D.: Redetigning heparin. N. IJngl. J. Med. 344:673-74 (2001)
- The Rembrant Investigators: Treatment of proximal vein thrombocic with a novel synthetic compound (SR90107A1Org31540) with porc anti-factor Xa activity: A phace II evaluation. Circulation 102:2726-31 (2000)
- Vuillemont, A., Schiele. F., Meneveau, N. et al.: Efficacy of a synthetic pentanacharide, a porc factor Xa inhibitor, as an antithrombotic agent - a pilot study in the netting of coronry angioplasty. Thromb. Haemost. 81: 214-220 (1999)
- Coussement P. K., Bassaud, J. P., Convens, C. et el.: A synthetic factor Xa inhibitor (Org315401SR90107A) as an adjunct of fibrinolysis in acute myocardial infarction. The Pentalyse study. Eur. Heart J. 22: 1716-24 (2001)
Dr. Sándor Tamás
Semmelweis Egyetem, II. Sebészeti Klinika
1125 Budapest, Kútvölgyi. út 4.
Érbetegségek: 2002/4. 113-119. oldal


