A szerzők a klinikumban a közemúltban bevezetett lézer Doppler (LD) vizsgálló eljárás felhasználásával vizsgálják krónikus sulfonylurea terápiában részesülő (n=22) tip. 2 diabeles mellitusban (DM) szenvedő és (n=5) anyagcsere egészséges beteg alkarjában a bőr microcirkulációját. Reaktív hyperaemia teszt (RHT) során értékelik a diaheteses anyagcserezavar, valamint a bevezetett glibenelamlide, illetve glimepiride terápia flow mediált vasodilaciós készségre kifejtett hatását. A glibenelamide az anyagcsere hatásában kedvezőbb glimepiriddel szemben a jó anyagesereállapot ellenére diabetes mellitusban gátolja a vasodilatációs készséget, és jelentősen megnyújtja a provokált fluxusváltozás idejét, míg a glimepiride érhatás hiányában az áramlásnövekedést nem gátolja. E kedvező haemodinamikai hatás és a várható előnyös metabolikus tulajdonságaiból adódóan a szerzők diabetes mellitusban szenvedő obliteratív érbetegek kezelésekor a glimepiride terápiát előnyösebbnek tartják a hagyományos sulfonylureaval szemben.
Érbetegségek: 2002/2. 49-55. oldal
KULCSSZAVAK
Laser Doppler, diabetes mellitus, glimepirid, flow medialt vasodilatáció
Bevezetés
Amióta az ATP-dependens kálium csatornák (KATA) hasnyálmirigyen kívüli egyéb szöveti jelenléte is ismertté vált és a csatornák szerkezetéről is mind több ismeret áll rendelkezésünkre (1), az új sulfonylurea (SU) készítmények alkalmazásánál egyre inkább előtérbe kerülnek a lehetséges extrapancreatogen hatások. Elsősorban a szív- és érrendszer területén (2) számolhatunk ezen hatásokkal, mivel a szívizomban, a coronáriákban és a perifériás érrendszerben (3, 4, 5), de az izmokban (6) és az arteriolákban (7) is nagy számban megtalálhatók, és fiziológiai szerepük is már jelentős mértékben tisztázódott (4. 5, 6, 7). A KATP csatornáknak a cardiovascularis rendszerben endogén protectív szerepet tulajdonítanak (8), mivel a microcirculatiót representaló pre - és postcapillaris arteriolákban és az endothelben is nagy számban jelen vannak és metabolikus szabályozottságukból eredően pusztán az endothelhez kötött folyamlatokkal is szoros kapcsolatban állnak (20). Aktivitásuk révén, a fent említett sejtek membran potenciáljának változtatásával szerepet kapnak a precondicionálásban (8), az erek vasomotor funkciójában és a vasodilatációs reactiókban (4.5).
A typ. 2 diabetes mellitus terápiájában alkalmazott sulfonylurea készítmények vasoregulációs hatásukat éppen a KATP csatorna blokkolása révén fejtik ki, melynek következtében gátlódhat, illetve csökkenhet az erek tágulékonysága, fokozódhat a perifériás vascularis resistencia.
Diahetes mellitus (DM) korai szakaszában a glucose toxicitás a kisereében és arteriolákban reversibilis funkcionális eltéréseket okoz, melyek a klinikumban csupán előrehaladott állapotban, esetleg már szerkezeti elváltozást is eredményező stadiumban regisztrálhatók (microalbuminuria, FLAG). Cukorbetegségben a bőr microcirculatiójának funkcionális eltérései szoros korrelációt mutatnak egyéb microcirculatiós szervkárosodásokkal (9, l0), melynek magyarázata, hogy a bőr microcirkulatiója nyugalomban a keringési kapacitás kb. 6-8%-át, terhelésre az izomkeringéssel együtt mint egy 80%-át reprezentálja. Így a lézer Doppler (LD) vizsgálat a bőr legkisebb keringési egységét (pre-postcapill. arteriola és capillaris endothel) detektálva az egész test vascularis resistenciaállapotáról informálja a vizsgálót. Ezt az érzékeny non invazív vizsgálati módot alkalmaztuk az in vitro vizsgálatok és a kedvező klinikai profil (11) alapján perifériás érhatásában is kedvezőnek ígérkező glimepiride (Amaryl, Aventis) microcirculatiós hatásának értékelésében.
Monoterápiában alkalmazott glibenclanlide (Gilemal, Chinoin), illetve glimepiride (Amaryl, Aventis) terápia perifériás microcirculatióra kifejtett hatását vetettük össze frissen diagnosztizált, csupán diétás kezeléssel tovább egyensúlyban már nem tartható korai tip. 2 diahetes mellitusos betegekben.
Módszer
A betegek (n=22,13 férfi, 9 nő) beválasztásakor friss, tip. 2. DM-ban szenvedő és min. 3 hónapja kvantitatív diétával (15 g/die) nem rendezhető, rossz szénhidrát anyagcsere állapotú, normális testsúlyú (BMI/=25,0 kg/m 2) és más gyógyszeres terápiában nem részesülő egyedek közül kerültek a vizsgálatba. Kontrollként 5 egészséges anyagcsereállapotú (3 ffi, 2 nő) egyén került beválasztásra. A kontroll személyek és betegek érrendszeri megbetegedésben, illetve szövődményben nem szenvedtek, gyógyszeres kezelésben - az anyagcsereállapot rendezés céljából bevezetett készítménytől eltekintve - nem részesültek. (Ez utóbbi egyúttal kizárta más vasodilatációs hatással rendelkező gyógyszer szedését is: például: Ca antagonisták, ACE-gátlók, nitrátok stb.).
A rossz anyagcsereállapot miatt a diéta kiegészítéseket SU monoterápiát vezettünk be, ennek során glibenclamide (Gilemal 5-l0--l5 mg/die, Chinoin), illetve glimepiride (Amaryl 24-6 mg/die, Aventis) terápiát alkalmaztunk ,.cross over" formában, nyílt vizsgálatban, 4-4 hétig. A diéta további szigorú fenntartása elellett alkalmazott SU dózisoknál célunk a normoglikaemia elérése volt (PP2ó vércukor: 7,5 mml/l, HbA1C: <7.0%). A szoros anyagcsere ellenőrzés mellett a vizsgálat indításakor, majd a SU kezelési periódusok végén lézer Doppler vizsgálatot végeztünk. Ennek keretében a nyugalmi alapáramlás mérését (basalis flow, Fo), a reaktív hyperaemia tesztet (RHT) és vasoconstrictiós tesztet (VCT) végeztünk el.
Laser Doppler vizsgálat (LD): HeNe monokromatikus fény kibocsátásával, Doppler elven működő Perimed 5000 (Perisoft 5,1 IBM PC) laser Doppler készüléket alkalmaztunk. A vizsgálatot standardizált körülmények között, a készülék kalibrálása után, zajmentes szobában, állandó szobahőmérsékleten (22 C°), fekvő helyzetben, 10 perces pihenést követően végeztük. Méréseink során a nyugalmi periódus elteltével az alapáramlást (Fo) értékeltük, majd ezt követően a reaktív hyperaemia tesztet (RHT), valamint a vasoconstrictiós tesztet (VCT) alkalmaztuk.
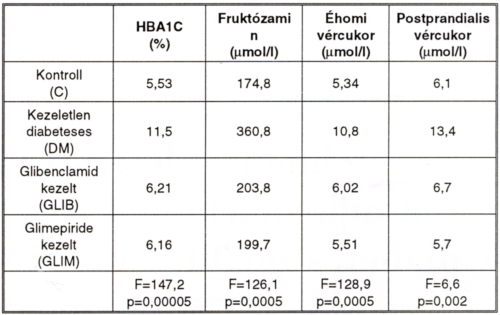
I. táblázat.
A vizsgált csoportok anyagcsere-értékei.
Bosal flow (Fo, (PU/s]): az alkar volaris felszínén a cubitalis hajlattól 10 cm-re felhelyezett vizsgálófejjel, nyugalomban történik az érzékelés.
RHT: Reaktív Hyperaemia Test: A basalis áramlás (Fo) mérését követően a vizsgálófej változatlanul hagyása mellett a felkaron elhelyezett higanyos vérnyomásmérő mandzsetta (200 Hgmm - 2 percig) felfújásával az alkarban ischaemiát hozunk létre, majd az áramlás folyamlatos detektálása mellett a mandzsetta hirtelen felengedését követően létrejött flow fokozódását elérjük. A microcirculatióban az alapáramlást, az áramlás intenzitásának fokozódását consensus alapján alkalmazott pertusiós egységekben [PU/s], illetve a változás mértékét százalékban[%], a maximális áramlás intenzitásig eltelt időt secundumban (Tpeak,[s]) fejezzük ki. A flow változás mértéke (ðF= csúcsflow l alapflow, [%]) tájékoztat a vizsgált érszakasz vasodilációs kapacitásáról.
VCT: Vasoconstrictíós teszt: A flow változásának értékelése fekvő, majd álló helyzetben lábon, a belboka felett felhelyezett elektróddal történt.
A laser Doppler vizsgálat klinikai jelentőségét non illvazív jellege és nagy érzékenysége adja. A módszer experimentális és klinikai felhasználásával kapcsolatosan utalunk külföldi és hazai szerzők munkáira (12, 13). Az érbetegségek kizárása céljából végeztük az alábbi kiegészítő vizsgálatokat: Hypertonia kizárása 24 ð ABPM monitorozással, alsó végtagi obliteratív érbetegség kizárása pulsatilis Doppler (PD) vizsgálattal, coronariabetegség kizárása Bruce protokoll szerint végzett Treadmil terheléses vizsgálattal.
Labor paraméterek megadása nemzetközileg elfogadott standard értékekben történt (éhomi és PP2ð vércukor (mmol/l), fruktózamin (µmol/l), HbAIC(%), total koleszterin, LDL-, HDL- kol, TG (mmol/l), húgysav (U/l), microangiopathia észlelésére microalbuminuria (mg/die) meghatározást és szemészeti vizsgálatot végeztünk.
Statisztikai elemzésben egy-szempontos variancia analízist (Bonferroni) alkalmaztunk.
Eredmények
Eredményeinket az I. táblázatban és az 1., 2., 3. ábrán tüntetjük fel.
Az LD lehetőséget ad a nyugalmi áramlás (Fo), valamint provokációs próbákra létrejött áramlásváltozás (ðF) észlelésére. Vizsgálatunkban flow medialt RHT által előidézett ischaemias stressz során csakúgy, mint diabeteses anyagcserezavarban az érfali metabolismus károsodik. A hypoxia/ischaemia v. szénhidrát anyagcserezavar következtében lecsökkent intracellularis ATP szint aktiválja a metabolikus változásra érzékeny KATP csatornákat, mely vasorelaxatiót, áramlásfokozódást eredményez.
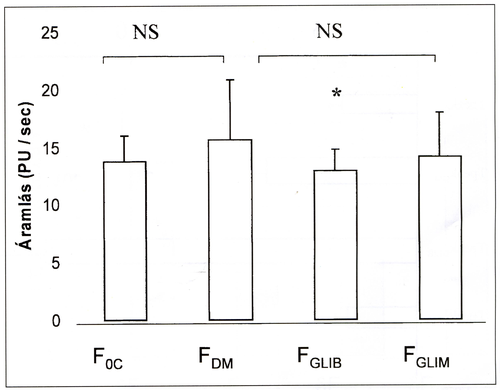
1. ábra.
A kezelés és az anyagcsere-állapot hatása az alapáramlásra. *p<0,001.
A glímepíride kezelés nem befolyásolja (FGLiM:14,16, PU/s SE 0,39 vs. Foc:13,71, PU/s SE: 0,61 vs. FDM:15,58, PU/s SE: 0,38, NS comp. Bonferroni), míg a glíbenclamide kezelés diabeteses anyagcsere-zavarban statisztikailag értékelhető mértékben csökkenti az alapáramlást (FGLIB:12,89, PU/s SE: 0,63 vs. FDM * p=0,001 comp. Bonferroni).
Ezt a glucose toxicitásnak tulajdonított vasodilatiós kapacitáscsökkenést representálja a még gyógyszerrel nem kezelt cukorbeteg csoport reaktivitása (ðFDM = 192.0% SE:6.5). Bár a nyugalmi áramlásban nem mutatkozott eltérés a cukorbeteg és egészséges csoportok között (FDM vs Foc =15,58 PU/s SE:0.38 vs 13.71 PU/s SE:0,60 NS) (1. ábra), a kezelésben nem részesült cukorbetegek RHT eredménye szignifikánsan elmarad a kontroll egészséges csoporttól (ðFDM vs ðFC:192,0% SE:6.5 vs 443.0% SE: 18,83 p<0,005) (3. ábra). A glibenclamiddal (dFGLIB vs. ðFDM:220,0% SE:11,2 vs 192,0% SE:6.5 NS) kezelt betegek reakciókészsége az intenzív anyagcsere ellenőrzés eredményeként elért normoglikaemias állapotban sem mutatott jelentős javulást (bFGLIB vs FC; 220,0% SE: 11,2 vs. 443,0% SE: 18,8 p<0,005) (3. ábra). A glimepiriddel kezelt csoportban szintén elérhető volt a jó anyagcsereállapot (HbAIC, FA). Itt a maximális fluxus változásig eltelt idő az egészséges csoporttól nem különbözött (Tpeak GLIM vs Tpeak c: 3,12 s SE:0,1 vs. 3,37s SE:0,16s NS ), míg a maximális fluxusváltozás mértéke meghaladta mind a glibenclamide kezelt, mind az egészséges csoportnál mért értéket (ðFGLIM vs, ðFGLIB vas. ðFC:560,1 % SE; 15,1 vs. 220,0% SE: 11.2 vs. 443,0% SE;18,8 p,0005) (3. ábra). Ugyanakkor mind a kóros szénhidrát anyagcsere, mind a glibenclamide kezelés significans mértékben megnyújtja a maximális fluxusváltozásig eltelt Tpeak időtartamot (TpeakDM vs. TpeakC: 6,45 s SE:0,19 vs. 33,37 s SE: 0,16 s p<0,005, TpeakGLIB vs TpeakC: 11,98 5 SE: 1,989 vs. 3,37 s SE:0,16 p<0,005) (2. ábra). A célul kitűzött normoglikaemia elérhető volt mind a két SU csoportban, az egyes kezelési periódusok végén a laborparaméterek az egészséges kontroll csoporttal csaknem megegyezőek voltak (1. táblázat). A vizsgálat kezdetén a rossz anyagcsereállapotú diabeteses csoport 40%-a retinopathia (Rp) jeleit mutatta, mely a normoglikaemia elérésének idejére rendeződött, függetlenül a SU típusától. A VCT alapján a hyperglikaemias kezelésben még nem részesült betegek (DM) között 3 személy mutatott kóros VCT paramétereket, mely alapján esetükben diabeteses neuropathiát diagnosztizáltunk tekintettel arra, hogy egyéb toxikus ártalom nem volt bizonyítható (vegyszer, alkohol) és az LD vizsgálat sensitivitása, a korábbi eredmények alapján erre feljogosít (13).
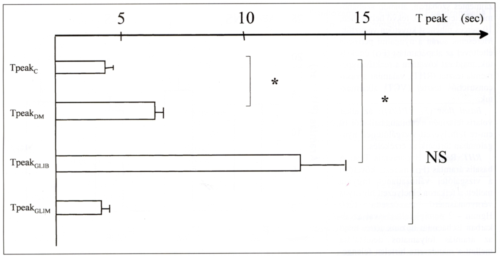
2. ábra.
Sulfonylurea kezelés hatása a fluxusváltozás kifejlődésének idejére. * p<0,0005.
A maximális fluxusváltozásig eltelt idő kezeletlen diabetes mellitusban és glibenclamide kezelés során egyaránt megnyúlik. (TpeakDM: 6,45 sec., SE: 0,19 vs., TpeakGLIB:11,98 sec., SE: 1,94 vs., Tpeakc: 3,37 sec., SE: 0,16 ** p<0,0005), ugyanakkor a kedvező anyagcsere-hatás eredményeként a glimepiride kezelés ezt az időtartamot nem növeli.
(TpeakGLIM: 3,12 sec., SE: 0,11 vs., Tpeakc, NS comp. Bonferroni.)
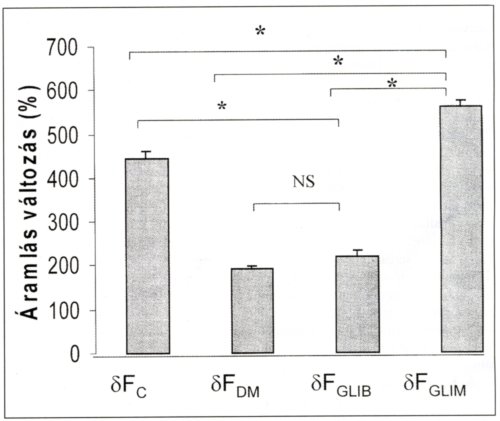
3. ábra.
Fluxusváltozások mértéke reactiv hyperaemia teszt (RHT) során. p<0,0005.
Reactiv hyperaemia teszt (RHT) során diabetes mellitusban a glimepiride kezelés mellett a provokált áramlás-változás mértéke fokozódik (ðFGLIM: 560%, SE: 15,1 vs., bFDM:192,0%, SE 6,5 vs., ðFGLIB: 220%, SE 11,2 *p=0,0005, comp. Bonferroni), míg glibenclamide kezelés során az anyagcsere javulás ellenére sem észlelhető az áramlás-változás mértékének növekedése (ðFGLIB: 220,0%, SE 11,2 vs. ðFc: 443%, SE 18,8, p<0,0005 comp. Bonferroni).
Glibenclamide kezelés alatt a kóros szénhidrát anyagcsere-állapothoz hasonló mértékben elmarad a vasodilatációs reakciókészség (ðFGLIB vs., ðFDM NS, vs. ðFc) *p<0,0005.
Megbeszélés
A KATP csatornák eltérő szöveti manifestatiója (2.14), a SU-k iránti eltérő affinitása a csatornák heterogenitására (1) utal. Az elmúlt években a szívizomsejt (SUR2A/Kir 6,2) és pancreas beta sejt (SUR1/Kir 6.1) KATP csatorna-receptor komplexusai genetikailag már reprodukálhatókká lettek, így ezen szövetekben a KATP csatorna (SURKir6.x) és a terápiában alkalmazott SU interakciója laboratóriumilag is jól vizsgálhatóvá vált (6). Még csak részben ismert azonban az artériák simaizmaiban jelenlévő KATP csatorna (SUR2B/Kir 6,2/6,1) receptor struktúrája és annak működése, SU affinitása.
A második generációs SU készítmények cardiovascularis hatásuk tekintetében nem egységesek. Állatkísérletek igazolták a glimepiride érhatásoktól mentes szelektív hatását (16) és a glibenclamidhoz hasonló kémiai szerkezete ellenére kedvezőbb farmakokinetikai tulajdonságait. Ezen kedvező in vitro eredmények és a glimepiride kedvező farmakodinámiás profilja (11) ellenére a human klinikai tanulmányok ellentmondó angiológiai hatásokról számolnak be (17, 18, 19). Bár egészséges anyagcsereállapotú betegeknél az alkarban diazoxiddal kiváltott artériás dilatációban a glimepride hatását a placeboval azonosnak találták (17), és ismételt coronaria dilatációval kiváltott precondicionális hatása is megőrizhetőnek bizonyult glimepiride adása mellett (18), ugyanakkor más szerzők diabeteses anyagcserezavarban acetylcholinnal aktivált endothel-dependens válaszreakció vizsgálatakor beszámoltak arról, hogy a glibenclamiddal azonos mértékben gátolja a vasodilatációt.
Ez utóbbi észlelésnek ellentmondani látszott, hogy vizsgálatunkban, szénhidrát anyagcserezavarban, bár jó anyagcserekontroll mellett, a glimepiride a vasodilatációs reakciót nem befolyásolta. Az RHT során cukorbetegben a glibenclamide hatástól eltérően glimepiride kezelés alatt, a válaszreakció az egészséges kontrollcsoporttal azonos mértékűnek bizonyult. Ennek hátterében részben a gyakran előnyként említett, glibenclamidnál alacsonyabb terápiás dózissal elérhető jó anyagcsereállapot (11, 15), részben receptor szelektivitása áll. In vivo vizsgálatból ismert, hogy a klinikumban használatos glimepiride dózis többszöröse sem gyengíti a diazoxiddal kiváltott. K-ATP csatorna által mediált vasodilatációt (17).
Betegeink anyagcsereállapotának jelentős különbsége ellenére az alapáramlásban (Fo) nem volt statisztikailag értékelhető különbség a kontroll és a cukorbeteg csoportok között, melynek feltehető oka. hogy fiziologiásan a nyugalmi áramlásban (Fo) a KATP csatornákban nincs meghatározó szerepe. Vizsgálati eredményeink eltérnek az Abbink (19) által megfigyeltektől, ahol rossz anyagcsereállapotú cukorbetegeknél (HbAIC<8,0%) a glimepride és glibenclamide Ach aktivációra kifejtett hatásukban azonos hatásúnak mutat koztak. Az idézett vizsgálatban az anyagcsereállapot csatorna aktivációra kifejtett hatása nem került értékelésre. Azonban az anyagcserezavar okozta metabolicus hatásból eredően nemcsak a resistencia erek KATP csatornáinak aktivitása (4), de a KATP csatorna aktiváló szerek iránti érzékenysége is csökkent mértékű lehet diabetes mellitusban. In vitro tanulmányok igazolták, hogy a szénhidrát anyagcserezavarban az endotheltől független (21, 23) vasorelaxatió, valamint az endothel csökkent NO synthesiséből adódóan az endothel dependens (20, 22) vasorelaxatió is gátolt formában valósul meg. Ezért tapasztalható mérsékeltebb flow medialt vasodilatációs készség human vizsgálatokban is rossz szénhidrát anyagcsereállapot során (22, 23, 24). Megfigyelésünk során is a még SU kezelésben nem részesült cukorbeteg csoport relaxatiós készsége (ðFDM) szignifikánsan elmaradt az egészséges kontroll csoportban mért értéktől (3. ábra).
A KATP ioncsatorna aktivitásának szabályozása szempontjából elsődleges és meghatározó a sejt energetikai állapota. Így normoglikaemias körülmények között a csatornák RHT során diabetes mellitusban is aktiválhatók, melyet a vasoactív hatással rendelkező glibenclamide és az érhatással nem rendelkező glimepiride eltérően befolyásolhat. Ezt látszik megerősíteni Bjilstra (17) vizsgálata, melynek során egészséges anyagcsereállapotban a diazoxiddal létrehozott KATP csatorna aktivitást a glimepiride - glibenclamiddal ellentétben - nem gátolja.
Az eddigi tudományos közlések, még a humán vizsgálatok is, a glimepiride direkt KATP csatorna blokkoló hatását csatorna aktiváló szerekkel érzékenyített, akut vizsgálatban észlelték (18, 19). Klinikai megfigyelésünk azonban krónikus gyógyszerszedés mellett, fiziológiás reflex reakciót értékelt, mely a tartós sulfonylurea kezelés alatt álló cukorbeteg vasodilatációs készségét reprezentálja. Vizsgálatunkban megerősítést nyert, hogy egészséges anyagcsereállapothoz hasonlóan (17, 18) szénhidrát anyagcserezavarban sem fejt ki a glimepiride a flow medialt vasodilatációs gátló hatást, mely gyakorlati jelentőséggel bír a perifériás érbetegséggel küzdő cukorbetegek kezelésében. A vizsgálat indulásakor friss, még kezeletlen cukorbetegek esetében a hyperglikaemiához társuló lipid-anyagcserezavarral (22), a csökkent inzulinérzékenységgel - inzulin rezisztens állapottal (24, 25) is számolnunk kell. Ezek kapcsán szintén csökken a vasodilatációs készség, mely hozzájárulhat a diaheteses ér patológiás válaszreakciójához (25).
A glimepiride terápiának a bőr microcirculatiójára kifejtett kedvező hatásában ugyanakkor szerepet kell tulajdonítanunk a glucose transzporterek (GLUT-1, GLUT-4) fokozott expreszszalódásának is (26). Ez utóbbi a KATP csatorna metabolikus szabályozás szempontjából meghatározó glucose felveétel fokozódását eredményezi, mely a metabolikus szabályozás elsődleges modulátorát, az intracellularis ATP mennyiséget növeli az érfali sejtekben, így a relaxációra képes sejtekben a KATP csatornák reakciókészségét (hypoxia érzékenységét) fokozza. Ennek következtében a glimepiride tartós alkalmazása során a korábban feltételezett kedvező extrapancreatikus metabolikus hatásai (26) is érvényesülhetnek, s együttesen a relaxációban résztvevő összes sejt energetikai állapotának javításával diahetes mellitusban az erek vasodilatációs készségének fokozódását eredményezhetik (22). Mivel a bőr microcirculatiójában észlelt változások generalizált vascularis vasodilatációként értékelhetők (13), így tapasztalatunk azt mutatja, hogy a glimepiride valóban érhatásoktól mentes, biztonságos és kedvező metabolikus hatású SU készítmény, melynek következtében a klinikumban az obliteratív érbetegségben szenvedő cukorbetegek kezelésében is ígéretes lehet.
Irodalom
- Aschroft, F. M, Gribble, F. M.: Tissue - specific effects of sulfonylureas. Lessons from studies of cloned K ATP channels. J. Diab. Compl. 14: 192-196. (2000).
- Nichols, C. G., Lederer, W. J.: Adenosine-triphosphate sensitive channels in the cardiovascular system Am. J. Physiol. 261: H1675-1232. (1991).
- Quayle, J. M., Nelson, M. T., Standen, N. B.: ATP-sensitive and inwardly rectifying potassium channels in smooth muscle Physiol. Rev. 77: 1165-1232. (1997).
- Braycen, J. E.: Potassium channels in vascular smooth muscle. Clin. Exp. Pharmacol. Physiol. 23: 1069-1076. (1996).
- Nelson, M. T., Quayle, J. M.: Physiological roles and properties of potassium channels in arterial smooth muscle. Am. J. Physiol. 268: C799-822. (1995).
- Inagaki, N., Tsuura, Y., Namba, N., Masuda, K., Gonoi, T.: Cloning anld functiollal characterization of a novel ATP-sensitive potassium channel ubiquitously expressed in rat tissue including pancreatic islets, pituitary, skeletal muscle and heart. J. Biol. Cleem. 270: 5691-5694. (1995).
- Bari, F., Errico, R. A., Louis. T. M., Busija, D. W.: Interaction between ATP-sensitive K+ channels and nitric oxide on pial arterioles in piglets. J. Cerebr. Blood Flow Metab. 16: 1158-1164. (19969.
- Cameron, J. S., Baghdady, R.: Role of ATP sensitive potassium channels ill long term adagtation to metabolic stress. Cardiovasc. Res. 28: 788-796. (1994).
- Balabolkin. M. I., Mamaeva, G. G., Troshina, E. A.: Use of laser Doppler flowmetry for the early diagnosis diabetic microangiopathies. Probl. Endocrinol.40: 19-20. (1994).
- Sax. F. L., Cannon III. R. 0., Hanson, C., Epstein S. E.: Impaired forearm vasodilator reserve in patients with microvascular angina. Evidence of a generalized disorder of vascular function? N. Engl. J. Med. 317: 1366-70. (1987)
- Rokamp, R., Wernicke-Panten, K, Graeger. E.: Clinicals profile of the novel sulphonylurea glimepiride. Diab. Res. Clin. Pract. 31. suppl. S33-542. (1996).
- Winsor, T.. Haumschild, D. J., Winsor, D. W.. Luong, T. N.: Clinical applicatiole of laser Doppler flowmetry for measurement of cutaneous circulation in health and disease. Angiology, 38: 727-736. (1987).
- Farkas K., Kolosváey E.. Járai Z., Dolgos L., Farsang Cs.. Diaheteses microangiopathia kimutatása laser Doppler vizsgálattal. Érbetegségek, N. 13-18. (1997).
- Winkler G., Pogátsa G., Speer G., Cseh K.: A sulfonylurea-receptor struktúrák és szerepük a differenciált sulfonylurea kezelésbele. Diabetologia Hullgarica 8: 157-166. (2000).
- Saponaro, A., Martinez, R., Gaudio, M., Dragagna, G., Leggio, F., Cangelosi, M. M.: Cutaneous microcirculation and diabetic disease. A functional and flowmetry study in subiects with diabetes mellitus type 2. Card. 38: 317-21. (1993).
- Geiser; K, Végh. A., Krause, E., Papp, J. G.: Cardiovascular effects of conventional sulphonylureas and glimepiride. Horm. Nletab. Res. 28: 496-507. (1996).
- Bjilstra. P. J., Lutterman, J. A., Russel, F. G. M.. Thien, T., Smits, P.: Interaction of sulphonylurea derivatives whith vascular ATP-sensitive potassium channels in humans. Diabetologia. 39: 1083-1090. (1996).
- Klepizig, H., Kober, G., Matte,; C., Luus, H., Schneider, H., Boedeker; K. H., Kiowski, W., Amann, F. W., Gruber, D., Harris, S., Burger, W.: Sulfonylureas and ischaemic preconditioning; a double - blind, placebo - controlled evaluation of glimepiride and glibencalmide. Eur. H. J. 20: 397-398. (1999)
- Abbink, E. J., Pikkers, P.. Jansen von Rosendaal, A., Smits, P.: Glibenclamide and glimepiride impaire KATP - channel-mediated vasodilatory responses to a similar degree. Br. J. Clin-. Pharmacol. 48: 780-781. (1999).
- Stehouwer; C. D. A., Lambert, J., Donker; A. J. M., van Hinsbergh, V. W. M.: Endothelial dysfunction and pathogenesis of diabetic angiopathy. Cardiovase. Res. 34: 55-68. (1997)
- McVeighh, G. E., Brennan, G. M., Johnson. G. D.: Impaired endothelium - dependent and independent vasodilation in patients with typ. 2 (non-insulin dependent) diabetes mellitus. Diabetologia 35: 771-776. (1992).
- Shige, H.,1shikawa, T., Suzukawa, M., Ito, T., Nakajima, K., Higashi, K, Ayapri, M., Tabata, S., Ohsuzu, F., Nakamura, H.: Endothelium-dependent flow-mediated vasodilation in the postprandial state in type 2 diabetes mellitus. Am. J. Card 84: 1272-1274. (1999).
- Morris, S. J., Shore, A. C., Tooke, J. E.: Responses of the skin microcirculation to acetylcholine and sodium nitroprusside in patients with non-insulin-dependent diabetes. Diabetologia 38: 1337-1344. (1995).
- Tooke, J. E.: Possible pathophysiological mechanism fon diabetic angiopathy in type 2 diabetes. J. Diab. Compl. 14: 197-200. (2000).
- de Haan, C. H A., van Dielen, F. M. H., Houben, A. J. H. M., del Leeuw, P. W., Huvers, F. C., DeMey, J. G. R., Wolffenbuttel, B. H. R., Nicolaas C. Schaper.: Periferial blood flow and noradrenaline responsiveness: the effect of physiological hyperinsulinaemia Cardiovasc. Res. 34: 192-198. (1997).
- Bahr, M., von Holtey, M., Miller. G., Eckel, J.: Direct stimulation of myocardial glucose transport and glucose transporter - 1 (GLUT1) and GLUT4 protein expression by the sulfonylurea glimeirid. Endocrinology 136: 25472553. (1995).
Dr. Nieszner Éva
Országos Gyógyintézeti Központ
1133 Budapest, Szabolcs u. 33-35.
Érbetegségek: 2002/2. 49-55. oldal


