Az endothel diszfunkció egyre gyakrabban alkatinazott elem a korai kardiovaszkuláris rizikófelmérés során. Az endothel funkció nem-invazív meghatározására a legelterjedtebb eljárás az a. brachialis flow mediált vazodilatációjának mérése.
Vizsgálatunk célja a mindennapi gyakorlatban könnyen alkalmazható, reprodukálható protokoll kidolgozása volt az endothel funkció meghatározására.
A koszorúereklez hasonló nagyságrendű a. brachialis endothel-fiiggű - flow mediált - vazodilatáeióját (FMD) vizsgáltuk adenosine, L-Ar ginin, illetve nitroglicerin hatás alatt, egészséges kontroll (n: 22) és magas rizikójú (n: 24) betegeken.
Mind a natív, illetve gyógyszerhatásban végzett flow mediált vazodilatációban, mind az NG által kiváltott értágulatban a beteg- és a kontrollcsoport között kifejezett szignifikáns különbség volt tapasztalható (p<0,01).
L-Arginin adását követően mindkét csoportban szignifikánsan nőtt az FMD, az endothel károsodott betegcsoportban azonban a változás jelentősebb volt (kontroll: natív vs. L-Arg. p = 0,04, beteg: natív vs. L-Arg. p = 0,01.7).
Megállapítottuk, hogy sublingualis NG alkalmazásával jól elkülöníthető az endothel-, illetve simaizom-dependens vazodilatáció károsodása. Felkari leszorítást követően jelentősebb dilatáció jön létre, amely a rizikócsoportok közötti szeparálásra alkalmasabb, mint az alkari leszorítással dolgozó protokollok. A fenti protokoll könnyen alkalmazható a mindennapi gyakorlatban, segítségével korán és megbízhatóan elkülöníthetők a magas kardiovaszkuláris rizikócsoportba tartozó endothel diszfunkciós betegek.
Érbetegségek: 2004/3. 91-95. oldal
KULCSSZAVAK
szűrővizsgálat, flow-mediált dilatáció, kardiovaszkulúris betegség
Bevezetés
A kardiovaszkuláris betegségek pathomechanizmusában az endothel diszfunkciónak egyre nagyobb jelentőséget tulajdonítanak. Ismert a vaszkuláris endothel szerepe az értónus szabályozásában, gyulladásos folyamatok mediálásában, a véralvadás, illetve a vérlemezke funkció szabályozásában. Összetett - mindeddig csak részben ismert - regulációs rendszere alapján különálló szervnek tekinthető.
Az endothel funkció nem-invazív meghatározására a legelterjedtebb eljárás az a. brachialis flow mediált vazodilatációjának mérése. A módszer élettani alapja az, hogy a véráramlás fokozódása - nagyobb nyíró feszültség révén - ép endothel mellett értágulatot vált ki.
Hypoxia során különböző vazoaktív metabolitok szintén stimulálják az endotheliális NO-termelést, illetve -kiválasztást. Az NO passzív diffúzió útján jut el az érfali simaizmokhoz és okoz dilatációt. Az értágulat mértéke nagyban függ az érfal compliance-től is, amelyet döntően a simaizom elemek határoznak meg.
A korai kardiovaszkuláris rizikó felmérése szempontjából az endothel funkció izolált vizsgálata értékesebb. A szív- és érrendszeri rizikófaktorok, mint a dohányzás, magas vérnyomás, cukorbetegség (leginkább a II. típusú DM a hyperinzulinémia által), hyperlipidémia, előrehaladott életkor az arteriosclerosis kialakulása, az érfal compliance-ének jelentős csökkenése előtt már jól mérhető funkciókárosodást okoznak.
Cél
Vizsgálatunk célja a mindennapi gyakorlatban könnyen alkalmazható, reprodukálható protokoll kidolgozása volt az endothel funkció mérésére, amellyel non-invazív úton tudjuk szűrni a magas kardiovaszkuláris rizikójú betegeket, a betegség minél korábbi stádiumaiban.
Vizsgálatunkkal megpróbáltuk modellezni az endothel vazodilatációt előidéző működését, az NO simaizomhoz jutását, illetve megtalálni a sérült lépést az endothel diszfunkció hátterében.
Módszer
A már korábban hasonló metodika kidolgozását célzó munkák figyelembevételével (1, 2, 3, 4, 6, 18) vizsgálatunkban mi is a könnyen hozzáférhető, koszorúerekhez hasonló nagyságrendű és szerkezetű, középnagy artéria, az a. brachialis - endothel-dependens - flow mediált vazodilatációját (FMD) vizsgáltuk. Standardizált körülmények elérésére törekedtünk: éhomra (4 óra éhezés), fél órai pihenést követően, 22 C° hőmérsékletű, csendes, elsötétített szobában végeztük vizsgálatainkat. A vizsgálatba bevont betegeink a mérést megelőző 48 órában nem szedték vazoaktív gyógyszereiket, aznap nem fogyasztottak kávét, teát, antioxidánst, valamint nem dohányoztak.
Vizsgálatunkhoz Toshiba 6000 UH-készüléket, 11 MHzes linealis fejet használtunk. Áramlást kizáró (200 Hgmm feletti), 4,5 perces időtartamú felkari leszorítást alkalmaztunk. A mandzsetta felfújása előtt, majd a felengedést követően - 180 mp alatt - a maximális dilatációt értékeltük az a. brachialis könyökhajlat feletti szakaszán, a transducer helyzetének változtatása nélkül. Az ér egy-egy anatómiai viszonyítási pontját használtuk a lokalizáció rögzítése érdekében. Az a. brachialis hosszanti és rövid tengelyű metszetének három különböző pontján az intimális átmérő átlagát (mm) értékeltük az esetleges ferde metszetek torzító hatásának elkerülése céljából.
A felengedést követően néhány másodpercen belül mértük az áramlási sebességet (m/sec), s ezt összevetettük a nyugalmi értékekkel is (%). A vizsgálatokat VHS szalagra rögzítettük és utólag értékeltük.
A magyar ajánlástól (18) eltérően az alábbi szempontok miatt alkalmaztunk felkari leszorítást:
- a Vogel és munkatársai által 2000 augusztusában megjelentetett közlemény (5) szerint a felkari leszorítás alkalmazása mellett FMD szempontjából szignifikánsan jobban elkülönül a kardiovaszkuláris rizikóval rendelkező csoport a negatív kontrollcsoporttól, s jelen vizsgálatunk célja éppen ezen betegcsoport szűrésére alkalmazható módszer kidolgozása volt;
- ischaemiás területen végzett FMD méréskor a megnövekedett áramlás okozta nyíróerő mellett az anaerob metabolitok is serkentik a jól működő endothelben az NO-szintézist, illetve -felszabadulást, így károsodott endothel funkció esetében markánsabb eltérést kaphatunk, s ekként rizikó meghatározásunk érzékenyebb lehet.
A natív hypoxiás mérést követően infúziós pumpával biztosított 500 µg/min dózisú adenosin hatásban ismételtük meg a vizsgálatot. Az adenosin az NO felszabadulását serkenti az endothel sejtekből. Az adenosint rövid felezési ideje miatt választottuk első tesztelt szernek. Ezt követően iv. (10 µg/min), majd egy óra elteltével sublingualis (400 µg) nitroglicerin (NG) értágító hatását vizsgáltuk. Sublingualis alkalmazás esetén 5 perc elteltével mértünk. A nitroglicerinből képződő NO az érfali simaizmokhoz passzív diffúzió útján eljutva okoz vazodilatációt, így az endothel funkciótól független tágulékonysági képességról informál. Újabb egy óra várakozást követően 0,1 g/ttkg L-Arginin infúzió adása után ismételtük meg a felkari leszorítást, illetve FMD mérést. Az L-Arginin az NO prekurzora az endothel sejtben.
Betegeink
A vizsgálati csoportot 24 (13 férfi, 11 nő, életkor: 45 éves ± 10,4), részletes tájékoztatást követően önként vállalkozó, II. típusú diabetes mellitus, hypertonia vagy hyperlipidemia diagnózissal kezelt beteg alkotta. Beválasztási kritérium minimum két kardiovaszkuláris rizikófaktor jelenléte volt. Az egészséges kontrollcsoport 22 (14 férfi, 8 nő, életkor: 40 éves ± 7,7) önként vállalkozóból állt.
Eredmények
Mind a natív, illetve gyógyszerhatásban végzett flow mediált vazodilatációban, mind az NG által kiváltott értágulatban a beteg- és a kontrollcsoport között kifejezett szignifikáns különbség volt tapasztalható (p<0,01). Ugyanakkor sem a kontroll-, sem a betegcsoporton belül nem mutatkozott szignifikáns különbség adenosin hatására az FMD-ben (kontrollcsoportban: natív vizsgálat vs. adenosin hatás p = 0,1, betegcsoportban: natív vizsgálat vs. adenosin hatás p = 0,19). Az iv. és a sublingualis NG alkalmazása között sem volt érdemi eltérés az egyes csoportokon belül (kontroll: iv. vs. subl. p = 0,29, beteg: iv. vs. subl. p = 0,46). Eredményeinket összefoglalóan az 1. ábra mutatja.
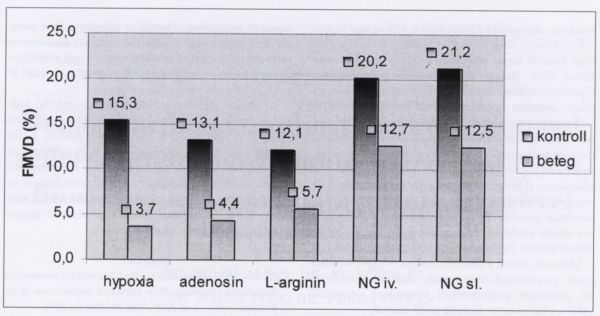
1. ábra.
Az eredmények összefoglaló ábrázolása grafikonon.
L-Arginin adását követően mindkét csoportban szignifikánsan nőtt az FMD, az endothel károsodott betegcsoportban azonban a változás jelentősebb volt (kontroll: natív vs. L-Arg. p = 0,04, beteg: natív vs. L-Arg. p = 0,017).
A csúcs áramlási sebesség, illetve a felengedés utáni és nyugalmi áramlás aránya - vizsgálatunk alapján - nem alkalmas az endothel funkció megbízható, kvantitatív megítélésére, illetve a magas kardiovaszkuláris rizikóval rendelkező betegcsoport elkülönítésére. Leginkább a leszorítás hatékonyságának megítélésében lehet a vizsgáló segítségére.
Konklúzió
A szív-érrendszeri betegségek rizikófaktorai közül szinte mindegyikről kimutatható, hogy az endothel funkciót károsítja. Ghiadoni és munkatársai (7) esszenciális hypertoniás betegekben - egészséges kontrollcsoporthoz képest - szignifikánsan alacsonyabb FMD-t mértek. Míg az akut vérnyomás-csökkentés nincs hatással az endothel funkcióra, a tartósan fennálló magas vérnyomás endothel funkció károsodáshoz vezet. Bae és munkatársai (8) a postprandialis hypertrigliceridémia endothel funkció károsító hatását igazolták, amelyben az oxidatív stressz mechanizmus hatását valószínűsítették. Lundman és munkatársai (9) a középsúlyos hypertrigliceridémiával élő fiatal férfiaknál jelentkező endothel diszfunkciót vizsgálták, és az emelkedett dimethylarginine plazmaszinttel hozták összefüggésbe. Barua és munkatársai (16) egészséges dohányzók endothel diszfunkciójának hátterében az endotheliális NO-szintetáz csökkent aktivitását igazolták. Teragawa és munkatársai (17) vizsgálata alapján a csökkent FMD vazospasztikus angina előfordulását tekintve független prediktív faktornak minősül.
Mindezek mellett a kardiovaszkuláris betegpopulációban pozitív eredménnyel zárult kemény végpontos vizsgálatokkal rendelkező gyógyszerekről kimutatható szignifikáns FMD-t, tehát endothel funkciót javító hatásuk.
Az egyik legjelentősebb vizsgálat eredményeiról Andersen és munkatársai (19) számoltak be még 2000-ben, munkájukban az angiotenzin konvertáló enzimgátlók (ACEI), angiotenzin receptor blokkolók (ARB) és Ca-csatorna blokkoló tekintetében igazoltak kedvező, endothel funkciót javító hatást.
Prasad és munkatársai (12) ARB akut és hosszútávú jótékony hatását írták le már kialakult endothel diszfunkció esetében.
Matsuda és munkatársai (13) carvedilol FMD-re kifejtett pozitív hatását mutatták ki koszorúér-betegek körében.
Statinokkal (simvastatin, atorvastatin) kapcsolatban is számos nagy esetszámú vizsgálat eredménye látott napvilágot. A MIRACL-vizsgálatból (10) ismert akut eredményekért valószínűleg részben az atorvastatin endothel protektív hatása tehető felelőssé.
Magas rizikójú - feltehetően diffúz endothel károsodással élő - betegcsoportban sem Adenosin, sem L-Arginin adásával nem volt normalizálható, vagy akár érdemben javítható az endothel funkció.
A beteg csoportban NG hatására is jelentősen elmaradt a vazodilatáció mértéke. Az általunk alkalmazott - az NO simaizomhoz jutását, annak dilatáló hatását modelláló - vizsgálat eredményei szerint a magas kardiovaszkuláris rizikójú betegekben az endothel funkció komplex károsodása mellett a simaizom funkció érintettsége is megállapítható.
Sublingualis NG alkalmazásával jól elkülöníthető az endothel-, illetve simaizom-dependens vazodilatáció károsodása. Nincs számottevő különbség azonban az NG beadási módjából adódóan.
Felkari leszorítást követően - amikor ischaemiás területen mérünk - a nyíróerő fokozódása mellett a felszabaduló vazoaktív metabolitok is hatnak az endothelre. Ezen komplex inger hatására egyidejűleg több aktiváló mechanizmus működhet, jelentősebb dilatáció jön létre, amely a rizikócsoportok közötti szeparálásra alkalmasabb, mint az alkari leszorítást használó protokollok esetében.
Az általunk alkalmazott FMD teszttel az endothel funkciót számszerűen jellemző, összehasonlítható paraméter nyerhető. A fenti protokoll könnyen alkalmazható a mindennapi gyakorlatban, segítségével korán és megbízhatóan elkülöníthetők a magas kardiovaszkuláris rizikócsoportba tartozó, endothel díszfunkciós betegek. Egyszerűsége és reprodukálhatósága révén összehasonlításra, az endothel károsodás, illetve az endothel funkciót befolyásoló hatások kvantifikált mérésére is alkalmas.
Irodalom
- Corretti, M. C.: Guidelines for the Ultrasound Assessment of Endothelial-Dependent Flow Mediated Vasodilation of the Brachial Artery. J. of ACC, Vol. 39., No. 2., 2002.
- Dimmeler, S.: Activation of nitric oxide synthese in endothelial cells by Akt-dependent phosphorylation. Natur, 1999, 339: 601-5.
- Vogel, R. A.: Measurement of endothelial function by brachial artery flow mediated vasodilatation. Am. J. Cardiol., 2001. július 19., 88(2-A): 31E-34E.
- Jarvisalo, M. J.: Non-invasive assessment of brachial artery endothelial function digital ultrasound and 13 MHz scanning frequency: feasibility measuring the true inner luminal diameter using the intimal interface. Ultrasound Med. Biol., 2000. október, 26(8): 1257-60.
- Vogel, R. A.: A comparison of brachial artery flow mediated vasodilatation upper and lower arm arterial occlusion in subjects with coronary risk factors. Clin. Cardiol., 2000. augusztus, 23(8): 571-5.
- Schroeder, S.: Influence of vessel size, age and body mass index on the flow mediated dilatation (FMD%) of the brachial artery. Int. J. Cardiol., 2000. november-december, 76(2-3): 219-25.
- Ghiadoni, L.: Effect of acute blood pressure reduction on endothelial function the brachial artery of patients with essential hypertension. J. Hypertens., 2001. március, 19(3 Pt2): 547-51.
- Bae, J. H.: Postprandial hypertriglyceridaemia impairs endothelial function enhanced oxidant stress. Atherosclerosis, 2001. április, 155(2): 517-23.
- Lundman, P.: Mild-to-moderate hypertriglyceridaemia in young men in association with endothelial dysfunction and increased plasma concentration of asymmetric dimethylarginine. J. of ACC, 2001. július, 38(1): 11-6.
- Gregory, G.: MIRACL Study That Evaulates Atorvastatin in Non-Q-Wave Acute Myocardial Infarction. A. J. Cardiol., 1998., 81: 578-81.
- Mullen, M. J.: Atorvastatin but not L-Arginine improves endothelial function type 1 diabetes mellitus: a doubleblind study. J. A. Coll. Cardiol., 2000 augusztus, 36(2): 410-6.
- Prasad, A.: Acute and chronic angiotensin-1 receptor antagonism reserves endothelial dysfunction on atherosclerosis. Circulation, 2000. május 23., 101(20): 2349-54.
- Matsuda, Y.: Carvedilol improves endothelium-dependent dilatation in patient with coronary artery disease. A. H. J., 2000 november, 140(5): 753-9.
- Clarke, S. C.: Tamoxifen effects on endothelial function and cardiovascular factors in men with advanced atherosclerosis. Circulation, 2001. március 20., 103(11): 1497502.
- Alonso, R.: Sustained long-term improvement of arterial endothelial function in heterozygous familial hypercholesterinaemia patients treated with simvastatin. Atherosclerosis, 2001. augusztus, 157(2): 423-9.
- Barua, R. S.: Dysfunctional endothelial nitric oxide biosynthesis in healthy smokers with imparied endotheliumdependent vasodilatation. Circulation, 2001. október 16., 104(16): 1905-10.
- Teragawa, H.: Endothelial dysfunction is an independent factor responsible for vasospatic angina. Clin. Sci. (London), 2001. december, 101(6): 707-13.
- Nagy L. és mtsai.: Magyar konszenzus az arteria brachialis áramlásfüggő "flow-mediated" vasodilatatiójának vizsgálatához. Érbetegségek, 2003/2.: 47-50.
- Anderson, T. J.: Comparativ study of ACE inhibation, angiotensin II. antagonist and Calcium channel blocade on flow-mediated vasodilatation in patients with coronary disease. J. A. Coll. Cardiol., 2000., 35: 60-66.
Dr. Szabó Albin
Semmelweis Egyetem,
I. sz. Belgyógyászati Klinika,
Kardiovaszkuláris Tanszéki Csoport
1083 Budapest, Korányi S. u. 2/a.
Érbetegségek: 2004/3. 91-95. oldal


