Bevezetés: az érsebészeti beavatkozásoknál a reperfúziós károsodások kivédése és a szöveti oxidatív stressz csökkentése alapvetően fontos a teljes klinikai restitúció eléréséhez. Az E-vitamin antioxidáns hatásainak pozitív szerepét számos kísérletes munka igazolja mind krónikus, mind akut modelleken. Munkánk során vizsgálni kívántuk, hogy milyen mértékben befolyásolja a perioperatív szakban folyamatosan alkalmazott E-vitamin az alsóvégtagi keringéshelyreállító műtétek következtében kialakuló oxidatív stressz és szöveti gyulladásos válaszreakciók kialakulását. Betegek és módszer: prospektív, randomizált vizsgálatunkba bevont 32 betegünknél angiográfiával igazolt AFS elzáródás szerepelt, mely miatt supragenuális rekonstrukciót végeztünk. Az E-vitaminnal kezelt betegeknek a műtétet megelőző naptól a posztoperatív 7. napig per os 1x200 mg E-vitamint adtunk. A második csoportba tartozó betegeknek nem adtunk Evitamint. A perifériás vénás vérmintákat a műtét előtt közvetlenül, majd a reperfúzió második órája végén (a korai reperfúziós szak) vettük. A késői reperfúzió monitorozását a műtéti iszkémiát követő 24. órában, és a 7. napon vett vérmintákban végeztük. Az oxidatív stressz paraméterek közül a lipidperoxidáció mértékét jelző malondialdehid plazmaszintjét vizsgáltuk, illetve az antioxidáns státusz meghatározását végeztük (GSH, totál-SH csoport, SOD). A gyulladásos válaszreakciók mértékét a fehérvérsejtek aktivációját jellemző indukált gyöktermelés meghatározásával, a plazma myeloperoxidase (MPO) aktivitás vizsgálatával, illetve a leukocyta adhéziós molekulák (CD11a és CD18) expressziójának monitorozásával jellemeztük. Eredmények: vizsgálataink azt mutatták, hogy a perioperatív szakban – a műtétet megelőző naptól a poszoperatív 7. napig – alkalmazott 200 mg E-vitamin csökkentette az iszkémia-reperfúzió következtében kialakuló oxidatív stressz mértékét (lipidperoxidáció, antioxidáns enzimek), valamint a prooxidáns-antioxidáns egyensúly felborulását. Igazoltuk, hogy az E-vitamin elektív műtétek során csökkentette a korai reperfúzióban a fehérvérsejt aktivációt (MPO aktivitás, szabadgyök produkció, adhéziós molekulák expressziója) és a következményes lokális gyulladásos folyamatokat. Összefoglalva: eredményeink alapján az E-vitamin hatékony kiegészítő gyógyszeres terápiája lehet az érsebészeti beavatkozásokat követő mérsékelt reperfúziós károsodások csökkentésének .
Érbetegségek: 2009/1. 11-19. oldal
KULCSSZAVAK
E-vitamin, oxidatív stressz, reperfúziós sérülés, leukocyta aktiváció, ASO
Bevezetés
Az E-vitamin fő jellemzői:
Az E-vitamin a zsírban oldódó vitaminok csoportjába tartozik, magát a vitamint Evans és munkacsoportja 1936- ban izolálta. Nyolc különböző formában létezik: alfa-, béta-, gamma- vagy delta-tokoferol és alfa-, béta-, gammavagy delta-tokotrienol. A tokotrienolok molekuláris struktúrája hasonló a tokoferolokéhoz, azzal a különbséggel, hogy az izoprenoid oldallánc három kettős kötést tartalmaz. A természetes tokoferolok fitil oldallánca három királis centrummal rendelkezik, melyeknek RRR konfigurációja van. Az E-vitamin kifejezést gyakran az alfatokoferol szinonimájaként használják. Valamennyi formának önálló biológiai aktivitása van, mely a szervezetben megnyilvánuló hatásának a mértékét is meghatározza. A táplálékban a gamma-tokoferol aránya általában magasabb, mint az alfa-tokoferolé, a plazmában a gammatokoferol aránya mégis csak 10%-a az alfa-tokoferolénak. Az emberi szervezetben jelenlegi tudásunk szerint az alfatokoferol a legaktívabb. A kereskedelmi forgalomban lévő, szintetikus E-vitamin általában valamilyen tokoferil észter formájában van jelen (alfa-tokoferil acetát, alfa-tokoferil szukcinát), mely antioxidánsként működik, de előfordul, hogy keveréke a természetben előforduló tokoferoloknak és tokotrienoloknak. A szintetikus alfa-tokoferol 8 lehetséges sztereoizomer egyenlő mennyiségéből is állhat (allrac- alfa-tokoferol, régebbi nevén dl-alfa-tokoferol). A táplálék kiegészítőkben és a kozmetikai cikkekben a leggyakoribb a vitamin-E acetát, mivel az észterifikáció megvédi az oxidációtól.
Az E-vitamin antioxidáns hatása
Az E-vitamin napi adagnál magasabb dózisának kedvező hatásáról számoltak be kardiovaszkuláris betegségek, daganatos betegségek, krónikus gyulladásos megbetegedések, Alzheimer és Parkinson kór esetén. Habár a vegyület hatásának tudományos racionalitása, az epidemiológiai adatok és a retrospektív vizsgálatok adatai egyaránt meggyőzőek, a prospektív, randomizált placebo kontrollált vizsgálatok eredményei nem megfoghatóak, és kevésbé vizsgáltak.
Az E-vitamin intracelluláris lokalizációja
Az E-vitamin sejten belüli megoszlása is nagy inhomogenitást mutat. Magas E-vitamin szint mérhető a Golgi apparátusban, a lizoszómákban, az endoplazmatikus retikulumban és a mitokondriumokban. Az endotélium Evitaminban viszonylag szegény. Alacsony a szintje a peroxiszómában és a citoszolban (1). Az alfa-TTP nagy mennyiségben expresszálódik a májban, kevésbé az agyban, retinában, limfocitákban és fibroblasztokban, valamint a placentában. A többi szövetben tapasztalható rendkívül alacsony alfa-TTP szint, vagy hiány azt mutatja, hogy léteznek alternatív intracelluláris transzporterek is.
Nemrégiben izoláltak egy olyan protein csoportot, mely úgy tűnik, hogy az intracelluláris E-vitamin transzportban fontos szerepet játszi. Tokoferol asszociált proteineknek (TAP) nevezték őket. A TAP proteinek GTP-áz aktivitással rendelkeznek, és valószínűleg az intracelluláris szignálokat tokoferol-függő módon befolyásolják (2).
Az E-vitamin metabolizmusa
Az E-vitamin a kiválasztódás előtt intenzíven metabolizálódik. Az 1950-es években két fő vizelettel távozó metabolitot írtak le, a tokoferonsavat és a tokoferol laktont. Mindkét metabolit glükuronid, vagy szulfát formájában távozik. A metabolitokban rövidebb oldalláncot és nyitott kromán struktúrát detektáltak, mely az antioxidáns reakciók következményének tűnt (3).
Negyven évvel később újra vizsgálták az E-vitamin metabolizmusát és rövidebb oldalláncot, valamint ép kromán-gyűrűt találtak és megállapították, hogy a 2,5,7,8- tetrametil-2(2’-karboxietil)-6-hidroxikroman (alfa-CEHC) a fő vizelettel távozó humán metabolit, mely analógja a béta- és gamma-tokoferol metabolitjainak (4). Az oldallánc degradáció feltételezett mechanizmusa az ómega- (CYP indukált) és béta-oxidáció (5). Az alfa-tokoferonolakton az oxidatív stressz használható markere lehetne.
Célkitűzések
Az E-vitamin antioxidáns hatásainak pozitív szerepét számos kísérletes munka igazolja mind krónikus és akut modelleken. In vitro és állatkísérletes modelleken kimutatták hatását az reperfúziós károsodások csökkentésében, humán vonatkozásban azonban kevés egyértelmű adat mutatja jótékony hatását akut sebészeti iszkémia-reperfúziós kórképek kimenetelében. Munkánk során vizsgálni kívántuk, hogy milyen mértékben befolyásolja a perioperatív szakban folyamatosan alkalmazott E-vitamin, az alsó végtagi keringéshelyreállító műtétek következtében kialakuló oxidatív stressz és szöveti gyulladásos válaszreakciók kialakulását.
Vizsgált betegek és módszerek
Prospektív, randomizált vizsgálatainkba bevont betegeinknél angiográfiával és Doppler vizsgálattal igazolt krónikus obliteratív verőérbetegség, és következményes perifériás iszkéma miatt alsóvégtagi revaszkularizációs műtétet végeztünk. A vizsgált betegeknél az érelzáródás az artéria femoralis superficialison volt, így minden beavatkozás során a végtag keringésének kirekesztése az artéria femoralis communis magasságában volt. A dizbáziás végtag vérellátását az intakt artéria profunda femoris biztosította. A műtét típusa minden beteg esetében azonos volt (femoro-popliteális supragenuális műanyag graft áthidalás, illetve az AFS trombendarteriektomiája), így az iszkémia időtartama (42,8 ± 16,3 perc), és az iszkémia által érintett szövetmennyiség minden esetben közel azonos volt. A tanulmányba csak azokat a betegeket vontuk be, akiknél trófikus zavart nem észleltünk, gyulladásos folyamatok nem zajlottak. A 32 vizsgált beteg közül 4 szenvedett NIDDM-ban. Nyolc betegnél volt gyógyszerrel kezelt és beállított hypertonia. Valamennyi beteg dohányzott. Három beteg anamnézisében coronária-bypass szerepelt. Az összes beteg anamnézisében ISZB és ennek megfelelő rendszeres cardiacum szedése (béta blokkoló, Ca-csatorna blokkoló, ACE gátló) szerepelt. Az átlagos dizbáziás index 61 ± 15,4 m volt.
Az E-vitaminnal kezelt betegeknek (1. csoport, 17 beteg) a műtétet megelőző naptól a posztoperatív 7. napig per os 1x200 mg E-vitamint adtunk. (Vitamin-E Bioextra 200 mg kapszula ATC: A 11HA03-tocopherol; OGYI-eng. Sz.: 2642/40/94; gyártó: Bioextra KFT, Budapest, Magyarország)
A második csoportba tartozó betegeknek (15 beteg) nem adtunk E-vitamint, az alkalmazott műtét ugyanaz volt.
A kontroll (3.) csoport értékeit egészséges önkéntes véradók vérmintáiból számoltuk.
Valamennyi beavatkozás spinal anesztéziában történt. Premedikációban Dormicumot kaptak a betegek (2 mg iv, vagy 5 mg im). A spinal anesztézia bevezetése előtt közvetlenül 500 ml Ringer-laktát infúzióban részesültek. A műtét alatt a betegek 1000-1500 ml NaCl vagy Ringer-laktát infúziót kaptak. A műtét előtt 2 órával valamennyi beteg single shot 2 gr Totacef iv profilaxisban részesült. A műtéteket az érsebészeti gyakorlatnak mindenben megfelelő technikával végeztük. 8 esetben félig nyílt trombendarteriektómiát végeztünk. A fentmaradó esetekben ahol az érfal meszessége miatt TEA nem volt kivitelezhető, femoro-popliteális műayagbypass mellett döntöttünk.(6 mm átmérőjű Interring protézst (GORETEX Interring stretch, thin wall W. L. GORE & ASSOCIATES, INC. ; Flagstaff, Arizona 8604 USA). Valamennyi betegnél a műtétet követően poplitea pulzus jelent meg. Transzfúzióra nem szorultunk sem a műtétek alatt, sem a korai posztoperatív szakban. Korai reokklúzió nem fordult elő. Szeptikus, vérzéses szövődmény, amely ismételt feltárást igényelt volna, nem volt.
A kórházi bentfekvés alatt beteget nem vesztettünk el, jelentősebb általános szövődmény nem jött létre. A műtétet követően a betegek kórházi tartózkodásuk alatt 1x5000 NE Fragmin (deltaparin sodium; Pfizer-Pharmacia Upjohn, USA) profilaxist, valamint a mikrocirkuláció javítása érdekében napi 500ml 6%-os Voluven infúziót kaptak (Hydroxiethylstarch, Fresenius Kabi AG, Else-Kröner- Strasse 1., Bad Homburg v.d.H. Germany).
Vizsgálati protokoll
Az E-vitaminnal kezelt (Elektív + Evit) és E-vitaminnal nem kezelt (Elektív) betegektől vett perifériás vénás vérmintákból végeztük a laboratóriumi méréseket. Az első vérminta vétel a műtét napján reggel 7 órakor történt a kiindulási (kontroll) értékek meghatározására. A második mintavétel a műtéti iszkémát követő reperfúzió második órája végén (a korai reperfúzió szakában) történt. A késői reperfúzió monitorozását a műtéti iszkémiát követő 24. órában, és a 7. napon vett vérmintákban végeztük.
Vizsgált paraméterek meghatározása
Az oxidatív stressz paraméterek közül a lipidperoxidáció mértékét jelző malondialdehid plazmaszintjét vizsgáltuk, illetve az antioxidáns státusz meghatározását végeztük (GSH, totál-SH csoport, SOD). A gyulladásos válaszreakciók mértékét a fehérvérsejtek aktivációját jellemző indukált gyöktermelés meghatározásával, a plazma myeloperoxidase (MPO) aktivitás vizsgálatával, illetve a leukocyta adhéziós molekulák (CD11a és CD18) expressziójának monitorozásával jellemeztük.
1. Oxidatív stressz paraméterek: lipidperoxidáció marker: malondialdehid (fotometria), antioxidáns enzimek: GSH, SOD, -SH csoport, (fotometria).
2. Gyulladásos paraméterek: leukocyta szabadgyök produkció (Chrono-Log lumino aggregométer) – szuperoxid anion, myeloperoxidáz aktivitás (MPO), leukocyta aktiváció: CD11a és CD18 adhéziós molekulák expreszsziójának meghatározása (flow-cytométerrel).
1. Oxidatív stressz paraméterek vizsgálata; Malondialdehid meghatározás
Mintaelőkészítés: thiobarbitursav (TBA, Renal) 10%-os perklórsavban (Reanal) készített túltelített oldatát háromszoros mennyiségű 20 %-os triklórecetsavval (TCA, Carbo Erbe) elegyítettük Az így kapott 1:3 arányú elegy 4,5 mléhez 0,5 ml alvadásban gátolt vért (EDTA) adunk. A keletkezett mintát forrásban levő vízfürdőben 20 percig főztük, majd jégben gyorsan hűtöttük és 4000 rpm-en 15 percig centrifugáltuk (Universal 3RF, Hetterich Zentrifugen). A felülúszót 532 nm-en, a TBA-TCA elegy ellenében fotometráltuk (Milton Roy Spectronic 6001 spektrofotométer). A minták koncentrációját (nmol/ml) standardgörbe alapján határoztuk meg.
Redukált glutation (GSH) meghatározás teljes vérből
Alvadásgátolt vér (EDTA) 1 ml-éhez 4 ml 10%-os triklór ecetsavat (TCA, Carbo Erbe) adtunk. Az elegyet 15 percig 4000 rpm-en centrifugáltuk. A felülúszó 2 ml-éhez 4 ml 0,4 M-os (pH 8,7) Trisz-(hidroximetil)-amino-metan (TRIS, Reanal) puffert adtunk. Az így kapott elegyet 100 µl 5,5-Dithiobisz-2-nitrobenzoesav (DTNB, SERVA) hozzáadása után 5 percen belül, 412 nm-en fotometráltuk (Milton Roy Spectronic 6001). A minta GSH koncentrációját nm/ml-ben standardgörbe alapján határoztuk meg.
Totál-SH csoport meghatározás
Bizonyos plazmafehérjék jelentős antioxidáns kapacitással rendelkeznek. A plazma-albumin főleg thiol csoportjai révén a legjelentősebb extracelluláris antioxidáns molekula, melynek antioxidáns kapacitását számos körülmény befolyásolhatja. A plazmafehérjék antioxidáns kapacitását jellemeztük a totál-SH csoportok mérésével. A mérésekhez Ellman’s reagenst (99 mg 5,5’-dithiobis-2- nitro-benzoesav (DTNB); SERVA) használtunk. A 0,1 ml plazmát 0,8 ml TRIS pufferhez adtuk (2,3723 g EDTA 50 ml vízben oldva, melyhez 12,1 g TRIS-t adtunk, és 500 mlre egészítettünk ki; 0,2M TRIS, pH: 8,2) és 0,1 ml Ellman’s reagenst adtunk hozzá és 412 nm-en, 0,9 ml TRIS puffer + 0,1 ml Ellman’s reagenssel szemben Milton Roy Spectronic 6001 Spektrofotométerrel mértük. A koncentrációt standard-görbe alapján határozzuk meg.
Szuperoxid dizmutáz enzim aktivitás mérése mosott vörösvérsejtből
A mérés alapelve, hogy a szövetekben, vérben, plazmában található SOD enzim gátolja az adrenalin átalakulását adrenochrommá (színes, fotometrálható komplex). A gátlás mértékéből (optimálisan 50%-os) a benne levő enzim mennyisége kiszámítható. (6)
Minta előkészítés: Alvadásgátolt vérhez (EDTA) háromszoros mennyiségű hideg fiziológiás sóoldatot adtunk, 2000 rpm-en 3 percig centrifugáltuk. A felülúszót elöntöttük, majd a műveletet addig ismételtük, míg áttetsző felülúszót nem kaptunk. Az üledékből 10-szeres hígítást készítettünk, melynek 500 µl-éhez kloroformetanol (1:2) elegy azonos mennyiségét adtuk. Az így kapott mintát alapos keverés után 15000 rpm-en 5 percig centrifugáltuk (Hettich Zentrifugen Universal 3RF) 4C-on. A felülúszót használtuk a fotometriás méréshez (Hitachi U-2001 típusú spektrofotométer). Adrenalin standard (ASTD): 1,6488 mg/ml 0,1N sósavban. Reakcióelegy: Na2CO3, NaHCO3, Na-EDTA; 0,05M, pH: 10,2, melyhez 100 µl-t adtunk az ASTD-ből. A minta mennyiségét úgy változtattuk, hogy lehetőleg 50%-os gátlást kapjunk. A végső térfogat mindig 3 ml. Aktivitásmérés: Az abszorbanciát 480 nm-en 3 percig folyamatosan mértük és regisztráltuk. A kontroll görbe és a minta jelenlétében kapott görbe felszálló szárának meredeksége közötti eltérésből számítottuk ki a gátlás mértékét, az alábbi módon:
((Kontroll meredekség-minta meredekség)/kontroll meredekség)) x 100=A,
1/A=B-0,010989 (konstans) =C,
0,009011/C=D,
D x a hígítás mértéke= U/ml.
2. Gyulladásos válaszreakció jellemzése; A fehérvérsejtek szabadgyök-termelésének meghatározása teljes vérből
A teljes vérben lévő fehérvérsejtek szabadgyök termelését luminometriás módszerrel vizsgáltuk. A szuperoxid anion képződést 0.2 µg/ml phorbol 12-miristate 13- acetat-tal (PMA) (Sigma-Aldrich kft, Budapest), indukáltuk. A keletkezett szabadgyököt luminol (Boehringer MannheimGmbh, Germany; 3,33 µg/ml)hozzáadásával tettük mérhetővé. A méréseket Chrono-log 560-VS típusú lumino-aggregométerrel mértük (Chrono-log Corp. USA), kétcsatornás direktíró segítségével. A kapott diagrammok alapján az indukciót követő szabadgyök termelés idejét ("lag time" (sec)), a szabadgyök termelés sebességét (arbitrális egység/sec) és a szabadgyök termelés fehérvérsejt számra vonatkoztatott csúcsértékét határoztuk meg (arbitrális egység/mm3-enkénti fehérvérsejt szám).
A myeloperoxidáz (MPO) szérum koncentrációjának meghatározása
Neutrophyl granulocyta aktiváció jellemzésére használt módszer. 1 ml munkaoldathoz (tartalmaz: 10,9 ml Na-citrát 0,1 M, pH:5,5; 100 µl o-Dianisidin; 1 ml H2O2; 5 µl Triton-X 0.05%) 200 µl szérumot adva, majd 37şC-on inkubálva 5 percre. 1 ml 35%-os perklórsavat adva a mintához 10 perc centrifugálás következett 2500/perces fordulatszámon. A felülúszó fotometriás értékelése 560 nm-en történt, vak mintaként munkaoldatot használva.
Leukocyta adhézis molekulák expressziójának vizsgálata
Az adhéziós molekulák expresszióját flowcitometriás módszerrel határoztuk meg. Nátrium-citráttal alvadásgátolt teljes vért fluoreszcein izotiocianáttal (FITC) jelölt humán felszíni adhéziós molekula (CD11a, CD11b, CD18, CD49d, és CD97) ellenes antitesttel (BD Biosciences, Pharmingen, USA) 15 percen át szobahőmérsékleten inkubáltuk. A monocita populáció elkülönítésére humán CD14 ellenes antitestet (BD Biosciences, Pharmingen, USA) használtunk az előbb említett antitestekkel együtt. A vörösvérsejtek lizálása után a mintákat centrifugáltuk (7 perc, 200 g), a pelletet foszfát pufferben (PBS) újra hígítva mostuk és ismét centrifugáltuk (7 perc, 200 g). Az izolált és jelölt sejteket 0,5%-os formaldehid oldatban hígítottuk, fixáltuk. A mintákat 4C-n tároltuk, és 5 napon belül BD FacsCalibur (BD, USA) flowcitométerrel végeztük a méréseket. A mérési eredményeket Cellques szoftverrel analizáltuk, az egyes fehérvérsejt típusok felszíni adhéziós molekulák festődését arbitrális egységben (AU) adtuk meg. (7) (8) (9)
Statisztika
A mérési eredményekből átlagot és standard hibát számoltunk. A kiindulási értékhez viszonyított eltéréseket egymintás Student T-próbával számoltuk, a különbségeket p<0,05 értéknél tekintettük szignifikánsnak.
Eredmények
A membránkárosodást, lipidperoxidációt jelző malondialdehid plazmaszintjének értékei szignifikánsan emelkedtek 2 órával a műtét után, és a reperfúzió 24. órájában, majd ezek az értékek fokozatosan csökkentek az egyhetes posztoperatív periódus végére. A műtét utáni (0,63±0,012 vs 0,42±0,008; p<0,05), és a 24-órás értékek (0,41±0,014 vs 0,31±0,011; p<0,05) között a két vizsgálati csoportban szignifikáns különbséget találtunk, az E-vitaminnal kezelt csoportban a MDA értékei alacsonyabbak voltak (1. ábra).
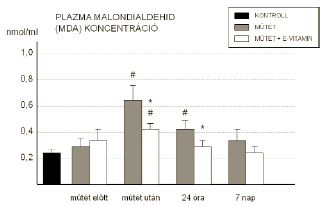
1. A lipidperoxidációt jellemző MDA plazmakoncentrációja a vizsgált időpontokban. (* = p<0,05 vs kezeletlen műtét; # = p<0,05 vs műtét előtt)
A GSH és a thiol csoportok koncentrációjában a műtétre váró és az egészséges kontroll csoport között nem volt szignifikáns különbség. A reperfúzió korai szakaszában a GSH szignifikáns módon csökkent (p<0,01), ám a két csoport között különbséget nem találtunk. Ezzel párhuzamosan a műtétet követően jelentősen csökkent az –SH csoportok mennyisége is, az E-vitaminnal kezelt csoportban a csökkenés szignifikánsan kisebb volt, mint a kezeletlen csoportban (33,2±3,6 mol/ml vs. 50,4±4,1mol/ml ; p<0,05) (2. ábra).
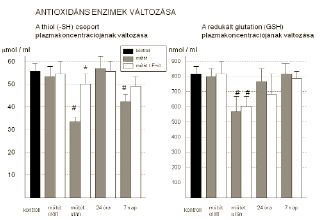
2. Az antioxidáns enzimek plazmaszintjének alakulása a vizsgált időpontokban. Bal ábra: A thiol csoport (-SH) mennyiségének változása. Jobb ábra: A redukált glutation (GSH) koncentrációjának változása. (* = p<0,05 vs kezeletlen műtét; # = p<0,05 vs műtét előtt)
A SOD aktivitásban rendkívül nagy különbség mutatkozott az egészséges kontroll és a műtétre kerülő betegek kiindulási értékei között (egészséges: 1035,3 86,8 U/ml; beteg: 715,4 75,2 U/ml). 24 óra múlva az E-vitaminnal nem kezelt csoportban még ehhez az igen alacsony értékhez képest is tovább csökkent (365±71U/ml vs. 587±66U/ml; p<0,05) (3. ábra). Méréseink szerint ezek a változások a GSH és SOD esetében egy hét múlva elérték a műtét előtti szintet, az -SH csoport azonban a műtét előtt mért érték alatt maradt.
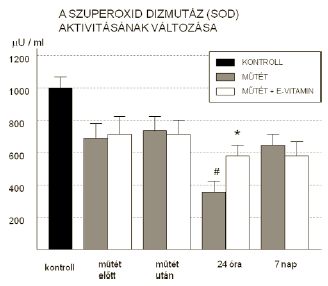
3. A szuperoxid dizmutáz aktivitásának változása a vizsgálati csoportokban. (* = p<0,05 vs kezeletlen műtét; # = p<0,05 vs műtét előtt)
A fehérvérsejtek száma az egészséges csoportban 6,5 0,34 x103 /ml volt, míg műtét előtt a beteg csoportban 11,51,9x103 /ml (p<0,05) és az egyhetes vizsgálati periódus alatt lényegesen nem változott.
Az egységnyi fehérvérsejt számra korrigált szuperoxid produkció a műtétre váró és az egészséges csoportban különbséget nem mutatott. A műtétet követően az E-vitaminnal nem kezelt csoportban szignifikáns emelkedést tapasztaltunk, amely a kezelt csoportban elmaradt (22,6±4,2 arb.unit/103 fvs vs. 11,4±2,3 arb.unit/103 fvs; p<0,05). A 24 órás és az egyhetes minták értékei emelkedettek voltak, a csoportok között azonban különbséget már nem mértünk. (4. ábra).
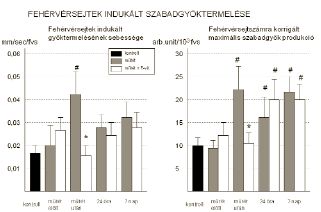
4. A fehérvérsejtek aktivációját jellemző indukált szabadgyöktermelés mértékének alakulása. Bal ábra: A gyöktermelés görbe felszálló szárának meredeksége - a gyöktermelés sebességének mértéke. Jobb ábra: A maximális szabadgyöktermelés mértéke a vizsgált csoportokban és időpontokban. (* = p<0,05 vs kezeletlen műtét; # = p<0,05 vs műtét előtt)
A PMA hatására a szabadgyök produkció sebessége (a gyöktermelés görbe felszálló szárának meredeksége) a műtétet követően a kezeletlen csoportban jelentősen megemelkedett, míg ez az emelkedés a kezelt csoportban elmaradt (0,042±0,007mm/sec/fvs vs 0,015±0,005mm/sec/fvs; p<0,05). A későbbi időpontokban vett mintákban az értékek nem térnek el a kiindulási értékektől.
A plazma MPO szint szignifikáns emelkedését a hetedik napon mértük a kezeletlen csoportban, a kezelt csoportban ezt az emelkedést nem tapasztaltuk (1,06±0,12nmol/ml vs. 0,61±0,73nmol/ml) (5. ábra).
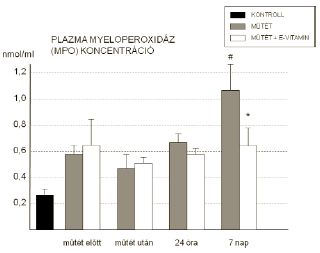
5. Az aktivált leukocyták által termelt myeloperoxidáz plazmakoncentrációjának változásai. (* = p<0,05 vs kezeletlen műtét; # = p<0,05 vs műtét előtt)
A granulocyták CD11a és CD18 expressziójának változását a 6. ábra mutatja. A kiindulási értékhez képest, a műtét után 2 órával mindkét marker expressziója szignifikánsan csökkent, azonban a késői reperfúzió során fokozatos emelkedést mutattak, majd egy hét múlva mérsékelten meghaladták a műtét előtti értéket. Szignifikáns különbséget a két csoport között a granulocyta CD11a 24 órás expressziójában mértünk, ahol az E-vitaminnal kezelt csoport értékei alacsonyabbak voltak (913±74 AU vs 621±89AU; p<0,05). A további vizsgált adhéziós molekulák (CD11b, CD49d, és CD97) menynyiségének változásai a megfigyelt periódusban eltéréseket nem mutattak.
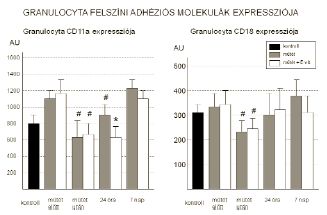
6. Granulocyta felszíni adhéziós molekulák expressziójának alakulása a vizsgált periódusban. (* = p<0,05 vs kezeletlen műtét; # = p<0,05 vs műtét előtt)
Megbeszélés
Vizsgálatsorozatunkban az antioxidáns E-vitamin hatását figyeltük meg az elektív, alsóvégtagi revaszkularizációs műtéteket követő reperfúziós folyamatokban. Eredményeink azt mutatták, hogy a perioperatív szakban - a műtétet megelőző naptól a posztoperatív 7. napig - alkalmazott 200 mg E-vitamin számos paraméterben csökkentette az iszkémia-reperfúzió következtében kialakuló oxidatív stressz mértékét, valamint a prooxidáns-antioxidáns egyensúly felborulását; kisebb mértékű csökkenést eredményezett az antioxidáns védelemben (lipidperoxidáció, antioxidáns enzimek). Igazoltuk, hogy az E-vitamin elektív műtétek során csökkentette a korai reperfúzióban a fehérvérsejt aktivációt (MPO aktivitás, szabadgyök produkció, adhéziós molekulák expressziója) és a következményes lokális gyulladásos folyamatokat (10).
Az E-vitamin antioxidáns hatása iszkémiás-reperfúziós folyamatokban
Az E-vitaminról antioxidáns hatása miatt feltételezik, hogy segít az oxidatív stresszhez kapcsolódó betegségek (kardiovaszkuláris betegségek, ateroszklerozis, daganatos megbetegedések, diabétesz, neurológiai rendellenességek) megelőzésében és gyógyításában.
Az E-vitamin antioxidáns hatása abban áll, hogy megtöri a szabadgyökök által gerjesztett láncreakciókat. Eközben tokoferoxi gyök keletkezik, mely velejárója minden E-vitamin alapú antioxidáns reakciónak. A következő reakció: LOO* + TocH = LOO + Toc* lejátszódása révén inaktív lipidperoxid és stabil tokoferoxil gyök keletkezik, mely a láncreakciót nem viszi tovább (ahol LOO*= lipid peroxid gyök, TocH = -tokoferol, LOO = inaktív lipid peroxid, Toc*= stabil tokoferoxil gyök).
Mivel ennek a reakciónak a sebesség konstansa nagyságrendekkel magasabb, mint a lipid peroxidációé, így egy - tokoferol/1000 foszfolipid hatékonysággal képes megvédeni a sejtmembránt. (11) Az aszkorbinsavhoz hasonló elektron donorok képesek regenerálni a tokoferoxil gyököt és így hozzájárulnak a celluláris védelem fenntartásához. Így a gyenge antioxidáns C-vitamin a tokoferoxil gyök protonálása révén fokozni tudja az E-vitamin antioxidáns hatását. Az is jól dokumentált azonban, hogy nagy dózisban az E-vitamin prooxidáns hatással is rendelkezhet a többszörösen telítetlen zsírsavak oxidációjának fokozása révén. (12) Ugyanakkor az E-vitamin a sejten belül képes fokozni a glutation peroxidáz aktivitást is, például izolált kardiomiocitákban. (13)
Az E-vitamin hatása a leukocyta-endothel aktivációra
A gyulladásos válaszreakciók kialakulásának korai eseménye a fehérvérsejtek végiggördülése az érfal mentén, majd kitapadása az endotélium sejtjeihez. Az endotélium sejtjeinek szelektinjei szabályozzák a gördülést, a leukocitákon levő integrinek és az endotélium sejteken levő sejtfelszíni adhéziós molekulák (CAM-ek) a leukociták és az endoteliális sejtek szoros adhézióját szabályozzák. Ezt követően a fehérvérsejtek diapedezis révén átjutnak a szubendotéliális rétegekbe. A szubendoteliális rétegekben a monociták makrofágokká alakulnak és NADPH oxidáz enzimük fokozott működése révén szuperoxidot termelnek. A keletkezett szuperoxid oxidálja az LDL-t, s így oxidált LDL (oxLDL) keletkezik, mely sejt-felszíni "scavenger" receptorok (CD36) megjelenését indukálja a makrofágok felszínén. Az aktivált endotélium sejtek citokineket - például interleukin-1 (IL-1) - és kemokineket (például IL-8 és monocyta kemotaktikus receptor-1) választanak el, melyek még több monocita és simaizom sejtet vonzanak az adott területre, tovább aktiválva ezzel az endoteliális sejteket.
Az aktivált monocitákban az E-vitamin gátolja az IL-1 felszabadulást (14), (15). Gátolja a monocita-endotelium adhéziót, valamint az oxLDL által indukált Mac1 (CD11b/CD18) expressziót monocitákban (16), (17), (18). Humán aorta endotélium sejtekben gátolja a monocita kemotaktikus protein 1 és az IL-8 produkciót (19). Gátolja a vérlemezke aggregációt maga is, és potencírozza az acetilszalicilsav hatását (20), (21). A vérlemezke aggregáció gátlásában az alfa-tokoferol egyik származéka, az alfatokoferil- kinon hatékonyabb, mint az anyavegyület (22).
Emiatt más antikoagulánsokkal együtt történő alkalmazása esetén az aggregációt ellenőrizni kell. A vérlemezke aggregációt oly módon gátolja, hogy fokozza az aggregáció indukálta nitrogén monoxid elszabadulást in vitro és in vivo is (23). Gátolja a NADPH oxidáz enzim aktivitását azáltal, hogy gátolja a p47phox foszforilációját és membránba történő transzlokációját (24).
A fenti folyamatokat jelentős mértékben csak az alfatokoferol képes befolyásolni. A hasonló antioxidáns hatású mennyiségben adagolt más analógok (béta-, gamma-, delta-tokoferol) nem fejtenek ki ilyen hatásokat, vagy ha mégis akkor sokkal kisebb mértékben. A vitaminnak ezek a hatásai a citokinek, növekedési faktorok és hormonok által indukált szignálfolyamatokban kulcsszerepet játszó protein kináz C (PKC) izoenzimekre gyakorolt effektusával is magyarázhatók. Az alfa-tokoferolnak nemcsak a PKC-án kifejtetett foszforiláció-gátló hatását bizonyították, hanem a kontrareguláló protein foszfatáz (PP2A) aktivitását is fokozta. (25) Yamauchi és munkatársai azt is bizonyították, hogy a tokoferol asszociált protein (TAP), alfa-tokoferol függő módon, a citoszolból a nukleuszba transzlokálódik, valamint azt is, hogy az alfa-tokoferol transzkripciós modulátorként képes a gén-expressziót befolyásolni (26). Az azonban nem bizonyított, hogy a génexpressziót az E-vitamin direkt módon, vagy a PKC izoenzimek, vagy a TAP befolyásolása révén váltja ki.
Vizsgálatainkat összegezve eredményeink alapján úgy gondoljuk, hogy az E-vitamin hatékony kiegészítő gyógyszeres terápiája lehet az érsebészeti beavatkozásokat követő mérsékelt reperfúziós károsodások csökkentésének.
Irodalom
- Drevon CA: Absorption, transport and metabolism of vitamin E. Free Radic Res Commun. 1991; 14(4): 229- 246.
- Kempna P, Zingg JM, Ricciarelli R, Hierl M, Saxena S, Azzi A: Cloning of novel human SEC14p-like proteins: ligand binding and functional properties. Free Radic Biol Med. 2003; 34(11):1458-1472. 2003.
- Eisengart A, Milhorat AT, Simon EJ, Sundheim I: The metabolism of vitamin E. II. Purification and characterization of urinary metabolites of alpha-tocopherol. J Biol Chem. 1956; 221 (2): 807-817.
- Schultz M, Leist M, Petrzika M, Gassmann B, Brigelius-Flohe R: Novel urinary metabolite of alphatocopherol, 2,5,7,8-tetramethyl-2(2’-carboxyethyl)-6- hydroxychroman, as an indicator of an adequate vitamin E supply. Am J Clin Nutr.62 (6 Suppl) 1995; 1527S-1534S.
- Birringer M, Drogan D, Brigelius-Flohe R: Tocopherols are metabolized in HepG2 cells by side chain omega-oxidation and consecutive beta-oxidation. Free Radic Biol Med. 2001; 31 (2): 226-232.
- Stevens JB and AP Autor.: Induction of superoxide dismutase by oxygen in neonatal rat lung. J Biol Chem. 1977, 252:3509.
- Hamid Rabb, Yvonne M. O’Meara, Patrick Coleman, Hugh R. Brady: Leukocytes, cell adhesion molecules and ischemic acute renal failure. Kidney International 1997, 51: 1463-1468.
- Albelda SM, Smith CW, Ward PA: Adhesion molecules and inflammatory injury. FASEB J. 1994, 8: 504-512.
- Menger MD, Vollmar B: Adhesion molecules as determinations disease: from molecular biology to surgical research. Br. J. Surg. 1996, 83: 588-601.
- Arato E, Kurthy M, Jancso G, Sínay L, Fehér I, Kollar L, Rőth E: Monitoring of prooxidant-antioxidant state following limb revascularisation surgery. Journal of Vascular Research. 2006; 43 (1): 45-45.
- Kornbrust DJ, Mavis RD: Relative susceptibility of microsomes from lung, heart, liver, kidney, brain and testes to lipid peroxidation: correlation with vitamin E content. Lipids. 1980; 15 (5): 315-322.
- Dutta A, Dutta SK: Vitamin E and its role in the prevention of atherosclerosis and carcinogenesis: a review. J Am Coll Nutr. 2003; 22(4):258-268.
- Li RK, Cowan DB, Mickle DA, Weisel RD, Burton GW: Effect of vitamin E on human glutathione peroxidase (GSH-PX1) expression in cardiomyocytes. Free Radic Biol Med. 1996; 21(4):419-426.
- Mayorga M, Iborra A, Estany S, Martinez P. Protective effect of vitamin E in an animal model of LPS-induced inflammation. Am J Reprod Immunol. 2004; 52 (6): 356- 361.
- Muroya T, Ihara Y, Ikeda S, Yasuoka C, Miyahara Y, Urata Y, Kondo T, Kohno S: Oxidative modulation of NFkappaB signaling by oxidized low-density lipoprotein. Biochem. Biophys. Res. Commun. 2003; 309 (4): 900- 905.
- Singh U, Devaraj S, Jialal I: Vitamin E, oxidative stress, and inflammation. Annu. Rev. Nutr. 2005; 25:151- 174.
- Wu D, Koga T, Martin KR, Meydani M: Effect of vitamin E on human aortic endothelial cell production of chemokines and adhesion to monocytes. Atherosclerosis. 1999; 147 (2): 297-307.
- Terasawa Y, Manabe H, Yoshida N, Uemura M, Sugimoto N, Naito Y, Yoshikawa T, Kondo M: Alpha-tocopherol protects against monocyte Mac-1 (CD11b/CD18) expression and Mac-1-dependent adhesion to endothelial cells induced by oxidized low-density lipoprotein. Biofactors. 2000; (4):221-233.
- Nobata Y, Urakaze M, Temaru R, Sato A, Nakamura N, Yamazaki K, Kishida M, Takata M, Kobayashi M: Alpha- Tocopherol Inhibits IL-8 synthesis induced by thrombin and high glucose in endothelial cells. Horm Metab Res. 2002; 34 (2): 49-54.
- Gonzalez-Correa JA, Arrebola MM, Guerrero A, Munoz-Marin J, Ruiz-Villafranca D, Sanchez de La Cuesta F, De La Cruz JP: Influence of vitamin E on the antiplatelet effect of acetylsalicylic acid in human blood. Platelets. 2005; 16(3-4): 171-179.
- Mardla V, Kobzar G, Samel N: Potentiation of antiaggregating effect of prostaglandins by alpha-tocopherol and quercetin. Platelets. 2004; 15(5): 319-324.
- Freedman JE, Keaney JF Jr.: Vitamin E inhibition of platelet aggregation is independent of antioxidant activity. J. Nutr. 2001;131(2): 374-377.
- Freedman JE, Li L, Sauter R, Keaney JF Jr.: Alpha- Tocopherol and protein kinase C inhibition enhance platelet-derived nitric oxide release. FASEB J. 2000; 14(15):2377-2379.
- Cachia O, Benna JE, Pedruzzi E, Descomps B, Gougerot-Pocidalo MA, Leger CL: Alpha-tocopherol inhibits the respiratory burst in human monocytes. Attenuation of p47(phox) membrane translocation and phosphorylation. J Biol Chem. 1998; 273 (49): 32801- 32805.
- Munteanu A, Zingg JM, Azzi A: Anti-atherosclerotic effects of vitamin E — myth or reality? J Cell Mol Med. 2004; 8(1): 59-76.
- Yamauchi J, Iwamoto T, Kida S, Masushige S, Yamada K, Esashi T: Tocopherol-associated protein is a liganddependent transcriptional activator. Biochem Biophys Res Commun. 2001; 285(2): 295-299.
Dr. Arató Endre érsebész , PhD
Pécsi Tudományegyetem,
ÁOK Sebészeti Tanszék
Baranya Megyei Kórház
7623 Pécs, Rákóczi út 2. Pf. 172.
Telefon: 72/533-133 fax: 72/212-059
e-mail: Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
mobil:06/30/9578 685
Érbetegségek: 2009/1. 11-19. oldal


