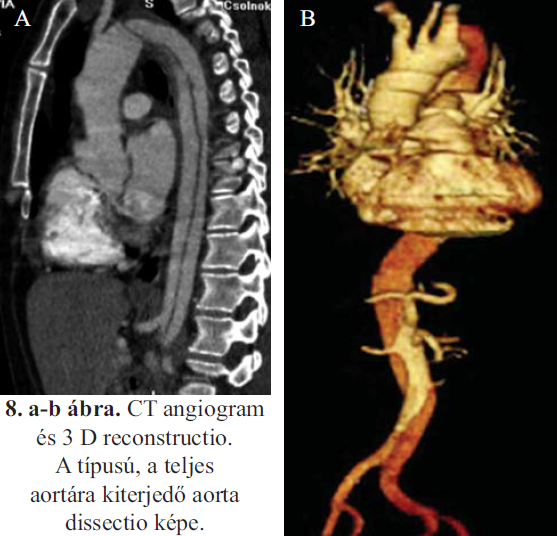
Az aorta dissectio a cardiovascularis katasztrófák egyik legsúlyosabb eseménye. Előfordulási aránya évente 5-6 eset 100 000 lakosra számítva. Két alap típusa van: ha az intima berepedése az aorta ascendenst érinti A típusú, ha az isthmicus aortát érinti B típusú elváltozásról beszélünk.
Érbetegségek: 2024/1. 5-12 oldal
Mindkét változat előfordul lokalizált és hosszú szakaszra kiterjedő formában (1, 2, 3, 4, 5, 6, 7. ábra). Amennyiben az utóbbi érinti a spinalis, zsigeri, renalis és ilio-femoralis artériákat is, azok keringési zavara eltérő súlyosságú malperfusiot okozhat. Az alacsony ischaemia toleranciájú szervek súlyos keringési zavara a dissectiok egyik vezető haláloka, arányuk B típusú aorta dissectio esetében meg - haladja az álaneurysma rupturáét (1). Jelenleg az A típusú dissectiok elsősorban sebészi megoldást igényelnek, míg a B típusú elváltozások ellátásában a hypotenziv kezelés mellett az endovascularis beavatkozások kerültek előtérbe (2,3). A distalis malperfusio megoldásában is vonzó a kevésbé invaziv endovascularis megoldás, de ennek a súlyos problémának sebészi vetületei is vannak. Jelen dolgozatunkban a sebészi lehetőségek javallatával és technikai megoldásával foglalkozunk.
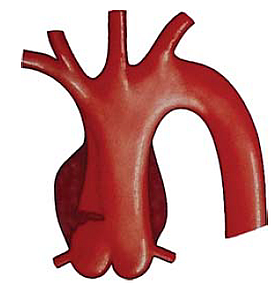
1. ábra.
Az A típusú, lokalizált aorta dissectio sémás rajza.
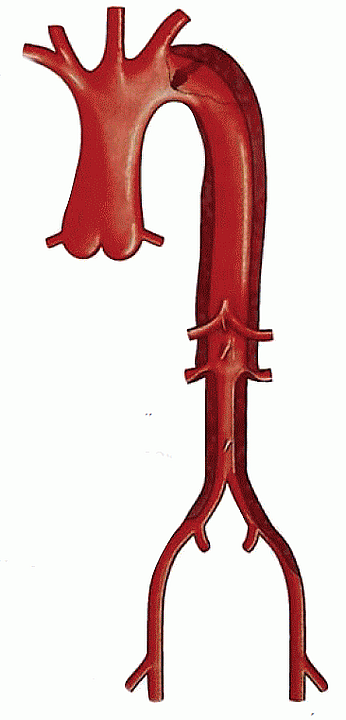
2. ábra.
Az A típusú, hosszú szakaszú aorta dissectio sémás rajza.
Az aorta dissectiot elősegítő állapotok igen változatosak:
- congenitalis aorta fal gyengeség (Marfan-, Ehlers Danlos-, Loeys- Dietz-syndromák, etc)
- bicuspidalis aorta billentyű
- jobb oldali aortaív
- coarctatio aortae
- kezeletlen hypertonia
- ulcerativ arteriosclerosis
- az aorta elongatioja okozta angulatio
- a mellkasi aorta tompa sérülése
- Egyéb
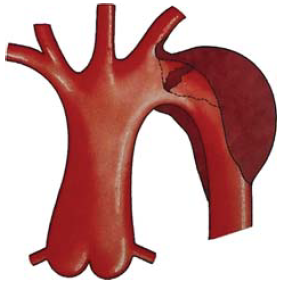
3. ábra.
A B típusú, lokalizált aorta dissectio sémás rajza.
A dissectio kialakulásában és kiterjedésében az alábbi tényezők játszanak jelentős szerepet:
- áramlási vektorok változása
- az áramlás kinetikus energiája
- az aortafal rétegei közötti kohéziós erő
- az aortafal külső, megmaradó rétegeinek ellenállása

4. ábra.
A B típusú, hosszú szakaszú aorta dissectio sémás rajza.
Az aorta dissectio dinamikája
Az áramlás legnagyobb energiát hordozó centrális sugara rendszerint az aortafal egy pontján okozza a legnagyobb erőbehatást az intima rétegére. A nyíróerő először a rugalmatlan intima réteg leválását okozza, és subintimalis haematoma képződik.
A levált intima átszakadása a véráram számára belépési pontot képez a rétegek közé. Ennek alapját az intima szakadékonysága – veleszületett genetikusan kódolt strukturális tényezők mellett trauma, szerzett betegség, elsősorban arteriosclerosis okozta plaque illetve atheromás fekélyképződés adja.
Amennyiben az aortafal rétegei között a kohéziós erő nagy, lokalizált dissectio keletkezik. Ha a külső rétegek szakító szilárdsága csekély, gyorsan progrediáló álaneurysma és akár ruptúra következhet be. Ennek esélye nagy kinetikus energiájú áramlás esetén fokozott.
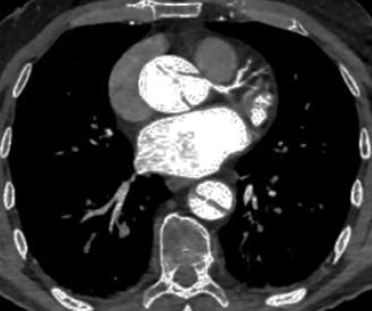
5. ábra.
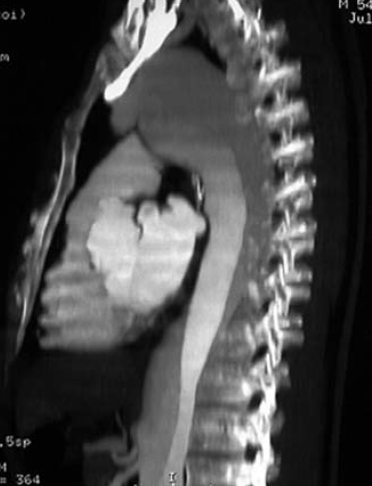
5. ábra. A typusú aorta dissectio CT angiogramja. Jól látható az aorta ascendensen kialakult állumen, a coronaria szájadék érintettsége és az aorta descendensen kis refenestratio jelenléte.
Ha azonban a külső rétegek rezisztenciája nagyobb, mint a rétegek közötti kohéziós erő, akkor a rétegek közé behatoló áramlás kinetikus energia mértékétől függő kiterjedésben hosszú szakaszú dissectio jön létre (6. ábra). Az intima henger leválasztása rendszerint spirál alakban történik, de szélsőséges esetben annak körkörös leválasztás is kialakulhat. Az állumen feszülése kiáramlás hiányában minden systole után fokozódik, ami a progressziót segíti elő (4). Szerencsés esetben, ha a nagy oldalágakat nem érintő dissectio az aorta distalis szakaszán az intima réteget ismét átszakítva refenestratio jelenik meg, az állumenben a feszülés hirtelen megszűnik és kettős lumenű (two barrel) aorta alakul ki. A feszülés megszűnése az addig észlelt háti fájdalom megszűnésével járhat és a beteg akár évekig tünetmentesen, kettős lumenű aortával élhet, ami később véletlenül kerül felismerésre. A külső rétegek ellenállásától függ, hogy a hosszú távú utánkövetés során kettős lumenű aorta szakaszon aneurysma képződés jelentkezik-e.
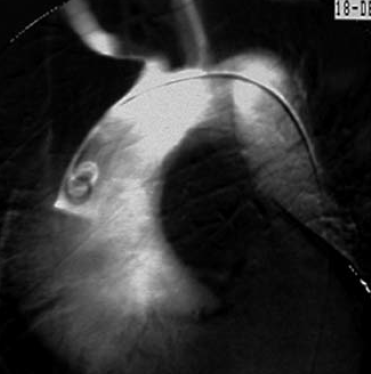
6. ábra.
6. ábra. DSA angiogram. A típusú aorta dissectio képe, ami a supra aorticus ágakra is ráterjed.
Az aorta és dissectio és malperfusio előfordulási aránya
Mai tudásunk szerint az aorta dissectio évente mintegy 5-6 esetben fordul elő 100 000 lakosra számítva, így Magyarországon 5-600 esetre számíthatunk. Ezek mintegy harmada éri meg a kórházba szállítást. Az utóbbi években az esetek számának növekedését tapasztaltuk, ami részben a képalkotó diagnosztika jobb elérhetőségének tudható be.
Az A típusú rövid szakaszú aorta dissectio coronaria perfusiós zavart és akár szív tamponádot okozhat. Az aorta billentyű felfüggesztésének leszakadása, illetve a sinotubularis junctio szintjén az aorta dilatatioja aorta insufficienciát eredményez. Az aorta ascendens ruptúrájával szövődött esetek aligha érik meg a szakintézeti ellátást. Az A típusú dissectiot a proximalis aortaív ágainak érintettsége elérheti a 60 %-ot (7, 8. ábra).
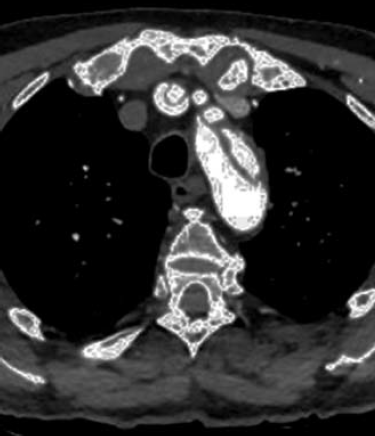
7. ábra.
Aortaívre terjedő A típusú aorta dissectio CT angiogramja.
Hosszú szakaszú változataiban a supraaorticus ágakra terjedő, klinikailag jelentős, súlyos dissectio némileg kisebb arányban fordul elő, de a zsigeri ágak és a subrenalis aortoiliacalis szakasz perfúziós zavara az esetek 15-20%-ában jelenik meg.
A B típusú dissectio lokalizált formájában a ruptúra életveszélyes állapotot okoz (9, 10. ábra). Retrográd intima leválasztás révén károsodhatnak a distalis aortaív ágai az esetek mintegy 20%-ában. A zsigeri és medencei artériák dissectio okozta elváltozásai hosszú szakaszra terjedő kórformákban elérhetik a 25-30%-ot (11. ábra) (1,5,6).

9. ábra.
9. a-b.ábra. B típusú aorta dissectio okozta haemothorax mellkas rtg felvétele és a dissectio CT angiogramja.
A malperfusio súlyosságának mértékét megszabja:
- az érintett életfontosságú mellékágak száma
- érintett mellékágak morfológiai elváltozásának - súlyossága
- az érintett szervek perfúziós zavarának klinikai súlyossága (5,6).
A mortalitás jelentősen összefügg a malperfusio által érintett mellékágak számával. Míg Czerny és mtsai 2137 A típusú dissectioban szenvedő beteget felölelő gyűjtő statisztikai anyagában a malperfusio nélküli esetekben a mortalitás 12.6, egy szervet érintő esetben 21.3, 2 szerv érintettsége esetén 30.9, és 3 szervet érintő esetben 43.4% volt (6).
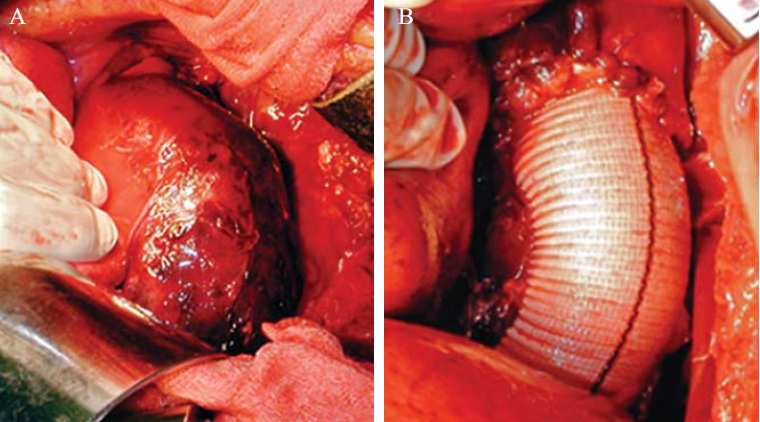
10. ábra.
10. a-b.ábra. A 9. képen látható B típusú aorta dissectio, acut aneurysma képződéssel és fedett ruptúrával, azonnali sebészi beavatkozást indokolt. Aorto-aorticus graft interpositiot végeztünk. Intraoperatív képek.
Az aorta dissectio klinikuma
Az aorta dissectio általában erős mellkasi, esetleg lumbalis és háti fájdalommal jár, amit összefoglaló néven acut aorta syndromának nevezünk (5,6). Az A típusú aorta dissectio okozta heves fájdalom acut myocardialis infarctus, pulmonalis embolia, intercostalis neuralgia, pleurális fájdalom gyanúját kelheti. Amennyiben a dissectio a supraaorticus ágakra is ráterjedő malperfusiot okoz, rendkívül változatos klinikai kép alakulhat ki, ami tudatzavarral, akár mély kómával, paraparesissel, paraplegiával, felső végtagi keringés zavarral, pulsus status drámai változásával társulhat.
A B típusú aorta dissectio háti, lumbalis, hasi és alsó végtagi fájdalmat okozhat. Egyes esetekben az isthmicus intima berepedés retrograd dissectio révén érintheti az aortaív ágait is. Mindkét dissectio típus hosszú szakaszú kiterjedése distalis malperfusios syndromához vezethet. A nagy hasi mellékágakat érintő dissectio az A típusú elváltozás esetén 5-10 %-ban okoz klinikai jelentőségű elváltozást, míg B típus esetében ez akár 20%-ot is elérhet (5,6).
A malperfusio diagnosztikája
A klinikai kép a hosszú szakaszra kiterjedő aorta dissectiok esetében a mellékágak szájadékának károsodása következtében – azok súlyosságának függvényében – igen eltérő lehet. Amennyiben az érintett szervek keringésének csökkenése a funkcionális szintű vérellátást sem biztosítja, azok működésének csökkenésével vagy teljes kiesésével kell számolnunk. A gerincvelő perfúziós zavara paraparesis ill. paraplegia formájában jelentkezik, a renalis keringési zavar a vizelet elválasztás csökkenésében, sőt anuriában nyilvánulhat meg. A renalis hypoperfusio gyors hypertenzív válasza a renin–angiotensin-aldosteron rendszer aktiválódásának következménye, ami súlyosbítja a hypertoniát, jelentősen elősegítve a dissectio propagatioját. A zsigeri keringés acut, drámai csökkenése a gyomor bélrendszer hypermotilitását majd bélhűdést okoz, ami klinikailag hasi fájdalommal, esetleg véres, nyákos székletürítéssel, transmuralis bélelhalás esetén peritonitis tüneteivel, végül endotoxin shockkal jár. Az ilio-femoralis artériák dissectioja a lumen obturatioja miatt artériás embolia, vagy thrombosis gyanúját keltve acut végtagi ischemiát okoz. A pulzus status vizsgálata, Doppler nyomásmérés elősegíti a dissectio okozta végtag keringéscsökkenés mértékének számszerűsítését, és annak változásait. A különböző pontokon mért vérnyomás értékek, a gradiens meghatározása és annak változása a dissectio dinamizmusáról is felvilágosítást adhat.
11. ábra.
B típusú, hosszú szakaszú aorta dissectio CT angiogramja.A jelentős állumen képződés leválasztottana zsigeri szájadékok intima rétegét is a mellkasi és hasi aorta teljes hosszában.
Laboratoriumi vizsgalatok
Dissectiora jellemz. specifikus laboratoriumi vizsgalatokkal nem rendelkezunk, azoknak els.sorban az elkulonit. diagnozisban lehet jelent.seguk. Troponin vizsgalattal a myocardialis infarctus kizarasara torekszunk, bar a coronaria szajadekokat erint. esetekben ez a vizsgalat nem zarja ki annak dissectio okozta eredetet. Egyes biomarkerek aortafal extracellularis matrix degradaciobol szarmazo matrix metalloproteinaz, TGF-Ŕ (transforming growth factor Ŕ) solubilis elastin fragmentumok, myosin, kreatinin kinaz, calponin, D-dimer megjelenese a serumban utalhatnak aorta dissectiora, de specificitasuk alacsony (7).
Gerincvelő ischemia celluláris károsodásának kimutatása a liquorban intracellularis markerek, mint NSE (neuronspecificus enolase), illetve protein S100 meghatározásával lehetséges – ritkán alkalmazott eljárások. A renalis funkció a percdiuresis, karbamid, kreatinin és GFR (glomeruláris filtrációs ráta) értékek vizsgálatával jól követhető. A gastrointestinalis ischaemia előrehaladott szöveti károsodás állapotában jelentős, 20 000 feletti leukocyta szám emelkedéssel, esetleg az alkalikus foszfatáz szint rapid növekedésével, és a máj enzym értékek romlásával jár. Az érintett szövettömeg ischaemiája az anaerob glikolysis következtében fokozódó lactat acidosist okoz. Az enzim értékek emelkedése nem tükrözi teljes biztonsággal a segmentális bél ischemia patológiai mély ségét és kiterjedését (8).
12. ábra.
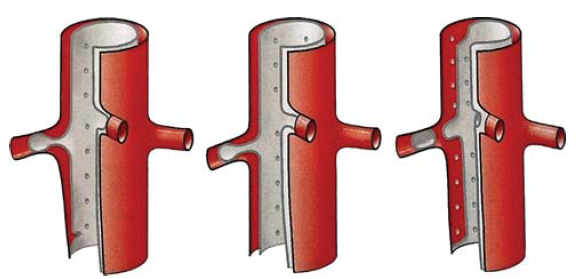
12. ábra. Dissectio okozta mellékág károsodások sémás rajza. Jól látható a subintimalis haematoma okozta stenosis, valamint a szájadék részleges és teljes kiszakadásának vázlatos képe.
Képalkotó vizsgálatok
Az aorta dissectio alapos gyanúja az egyszerű mellkas felvételen látható közép árnyék kiszélesedés alapján is felállítható. A diagnosist a centralis aorta szakasz állapotának megítélésében a transoesophagealis echocardiographia (TEE) megerősítheti. A distalis malperfusio esetén a kórismézés alapját a kontrasztanyaggal végzett computer tomographiás angiographia (CTA), esetleg mágneses rezonancián alapuló angiographia - MRA képezi (9). A sagittalis, coronalis és 3 D recontructiok pontos képet adnak a dissectiot okozó intima berepedés helyéről, a dissectio kiterjedéséről, az álaneurysma méretéről, az állumen és valódi lumen viszonyairól és az esetleges refenestratio helyéről. A nagyfelbontású készülékekkel a valódi és állumen systolo-diastoles dynamicus és staticus elváltozásairól is képet kapunk. A szájadékok átáramlásának dinamikus változásai nem, vagy nem kielégítően refenestralt hosszú szakaszú dissectio esetében, de leválasztott orificialis intima réteg esetében várhatók. Az állumen systoléban pumpaszerűen kerül feszülés alá, és fokozza a mellékág szűkületét, míg diastole során az állumenben a nyomás kissé csökken és a perfusio javul (4). Mivel az állumen ilyen esetben minden szív revolutioval fokozódó nyomás alá kerül, ez magában rejti a progressio lehetőségét, így instabil helyzetnek minősítendő. Viszonylagos morfológiai stabilitást a refenestratio jelenthet. Berepedt, vagy kiszakadt szájadék(ok) esetében várható az érintett szervek súlyos malperfusioja. A mellékágak szájadékának dissectio okozta károsodása és annak mértéke CTA vagy MRA vizsgálattal jól megítélhető (10).
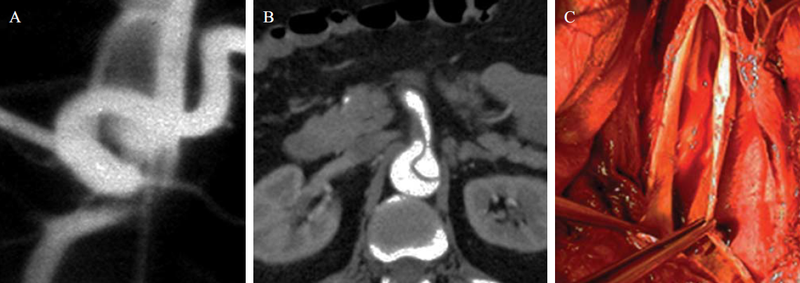
13. a-b-c. ábra.
A zsigeri artériák szájadékának dissectio okozta súlyos kompressziója DSA, CTA és intraoperativ képeken.
Ennek fokozatai a következők:
- subintimalis periorificialis haematoma okozta stenosis (12. ábra)
- az intima részleges átszakadása a distalis intima részleges felgyűrődésével (13. ábra)
- a szájadék tölcsérének körkörös kiszakadása az intima felgyűrődésével (14. ábra)
- A distalis érszakasz thrombosisával (15. ábra)
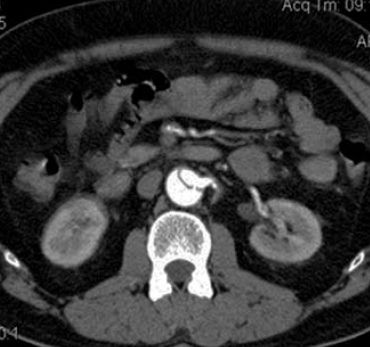
14. ábra.
CTA. Jól látható a bal artéria renalis kiszakadt szájadéka.

15. ábra.
15. ábra. CTA. Acut hosszú szakaszú aorta dissectio az állumen és mindkét a. renalis thrombosisával.
A malperfusio az aorta nagy és létfontosságú mellékágainak dissectio okozta keringési zavarát jelöli. Kiterjedésének és súlyosságának megítélésében és prognózisában jelentős szerepet játszik az érintett szájadékok száma, a szájadékok károsodásának morfológiai eltérése, és az érintett szervek ischaemia tolerantiája (6).
A klinikai tünetek felmérése mellett a képalkotó eljárással nyert információk pontos képet adnak azokról a morfológiai instabilitást jelentő elváltozásokról is, amelyek előre vetítik a definitív szervkárosodás veszélyét is. Így hozzájárulnak a rendkívül dinamikus kórkép kezelés javallatának, taktikájának és időzítésének meghatározásához. Mivel az érintett szervek ischaemia tűrőképessége rendkívül rövid, csak a preventiv beavatkozástól várhatunk eredményt. Ezt jól tükrözik Cho és mtsai, valamint Wang és mtsa által közölt adatok. 268 beteg adatait feldolgozva malperfusio morfológiai jelei nélkül a mortalitási aránya szignifikánsan jobb volt, mint a subklinikus morfológiai instabilitással járó estekben, illetve a malperfusio klinikai tüneteivel észlelt betegek esetében (11,12).
Az aorta dissectio kezelési javallata
Az A típusú aorta dissectio kezelése acut szívsebészeti megoldást igényel, bár 2003 óta endovascularis meg oldásokat is alkalmaznak (11,12). A B típusú aorta dissectio sebészi megoldása a proximalis belépési ponton az aorta szakasz graft interpositioja thoracotomia útján jelentős sebészi terheléssel, magas szövődmény rátával jár - csak rövid szakaszt érintő, gyorsan növekvő, vagy megrepedt álaneurysma esetében lehet életmentő beavatkozás (9,10). Ma - napság a nyitott eljárást az endograft beültetés térhódítása nagyrészt kiváltotta. Hosszú szakaszú, a nagy distalis mellékágakra terjedő dissectiok esetében csak a centrális belépési pont kezelése akár sebészi akár endovascularis módszerrel, nem minden esetben képes megelőzni vagy megoldani a mal perfusiot.
A B típusú aorta dissectiok jelentős része hypotenziv kezeléssel stabilizálható. Napjainkban belépési pont endovascularis lefedése a preferalt módszer. Ez a kevésbé invazív eljárás megszünteti az állumen telődését és annak thromboticus elzáródását eredményezheti. A valódi lumen felé irányított keringés elősegíti a levált intima réteg kitapadását, ezzel az aortafal remodellingjét, és megakadályozhatja a későbbi aneurysma képződést. A hosszú szakaszú elváltozások esetében az intima kitapadását a belépési pontot lefedő endograftot kiegészítő, csak a vázat alkotó nitinol hálóval ún. pettycoat grafttal biztosítják. Ez a fedetlen graft szakasz kitámasztja az intimát, komprimálja az állument, de nyitva tarthatja a spinalis segmentális artériák szájadékát. Az eljárás kis átmérőjű állumen esetében jó eredményhez vezet, de jelentős méretű állumen esetében az intima hengert átszakítva megnyithatja az állument és annak újabb telődését okozva inkomplett megoldást jelent. Ezen esetekben újabb stentgraft beültetés jön szóba (Staged implantation) (13,14).
A teljesen endovascularis megoldás a zsigeri és renalis malperfusio esetében scallop vagy fenestrált, valamint paralell graftok alkalmazásával, sandwich technikával megoldhatók. Az oldalágak perfusiojának biztosítása a részben vagy teljesen kiszakadt orificialis intima rögzítése stentekkel vagy borított stentekkel biztosítható. Elágazó graftok egyedi méretvételezés alapján készülő graftok jelentős időveszteség miatt acut esetekben aligha alkalmazhatók. A vázolt endovascularis eljárások rutinszerű alkalmazását a jelentős költség igény mellett állandó, teljes spektrumú raktárkészlet hiánya korlátozhatja és nagy endovascularis gyakorlatot feltételez - valamint nem minden esetben kivitelezhető. Ezen esetekben sebészi megoldás mérlegelendő.
A refenestratio - thoracoabdominalis endarteriektomia - szerepe a hosszú szakaszú aorta dissectiok esetében
Régi klinikai megfigyelés, hogy a dissecált intima lemez spontán átszakadása az állumen distalis pontján, annak hirtelen nyomás kiegyenlítődését okozza és kettős lumenű thoracalis aorta keletkezik. A nyomás kiegyenlítődése csökkenti, vagy szerencsés esetben megszünteti a distalis progressio esélyét. Ha ez a refenestratio indifferens szakaszon, például az aorta descendes supradiaphragmaticus szakaszán történik és a dissectio már nem érinti visceralis ágak szájadékát, kettős lumenű thoracalis aortával stabil keringés alakul ki, ami akár évekre panasz és tünetmentes állapotot ered - ményezhet. Az állumenben a kiegyenlített nyomás általában nem vezet a külső réteg dilatációjához, mint ahogy a desobliterált artériák és aorta sem hajlamos kitágulásra. Azon esetekben azonban, amelyek Marfan-típusú congenitalis érfali gyengeség miatt szenvedték el az aorta dissectiot, hosszú távon aneurysma képződéssel számolhatnak az aktuálisan érintett, de bármely aorta szakaszon.
A kettős lumenű aorta tartós panaszmentességet biztosító spontán kialakulása vezetett a mesterséges refenestratio gondolatához. 1935-ben Gurin vezette be az aorta abdominalison a refenestratio sebészi technikáját. Az eljárás látványosan hozzájárult az iliaca szintre terjedő dissectiok esetében az alsó végtag(ok) keringésének javulásához és az állumen proximalis szakaszán a túlnyomás megszűnéséhez. Ha a visceralis, renalis szájadékok intima tölcsérét az állumen feszülése csupán beszűkítette az érintett szervek perfúziója is rendeződhet. Amennyiben az említett szájadékok részben vagy teljesen kiszakadtak ez az eljárás a malperfusiot, és annak esetleg fatális kimenetelét nem volt képes megszüntetni, ezért az abdominális refenestratio bizonytalan eredményeket hozott és a módszer perifériára szorult. Az 1950-es évek közepén, a katéter technikák megjelenésével az eljárás minimalisan invazív jellege, az állumennek az abdominalis szakaszon, katéterrel történő megnyitása ismét előtérbe került. Mivel azonban az új technika sem oldotta meg a zsigeri perfúzió fentebb említett bizonytalanságait, hamarosan lekerült a rutin kezelési módszerek palettájáról. Az eljárás tovább fejlesztett változatát a Mayo klinikán Penetton végezte a 90-es években. Median laparotomia útján tárta fel az aorta visceralis segmentumát és intervisceralis aorta kirekesztésben az aortotomiát a subrenalis aortáról interrenalisan vezetve végzett refenestratiot és a renalis szájadékok intimáját szem ellenőrzése mellett rögzítve állította helyre a renalis perfusiot. Az eljárás rendezte a renalis és subrenalis keringést, de változatlanul hagyta a zsigeri ágak instabil elváltozásait és a malperfusio számára nem szolgáltatott biztos megoldást.
Mivel a malperfusio által érintett szervek ischemia tűrőképessége 40-45 perc, a fenyegető keringési zavar felismerése élet-, illetve szervmentő szereppel bír. Az instabil visceralis, renalis és alsó végtagi keringés CTA-n megítélhető morfológiai jelei alapján haladéktalan sebészi beavatkozás - thoracoabdominalis refenestratio javallatát jelenti. E preventív műtéttel megelőzhetjük a malperfusio klinikailag manifest károsodását, és megtarthatjuk az érintett szervek funkcióját.
Acut és subacut esetekben 1985 óta végezzük a thoracoabdomianlis aorta endarteriektomiával a zsigeri és renalis artériák szájadékait magába foglaló refenestartiot. A thoracoabomialis aortát bal oldali ferde fekvésben pararectalis és intercostalis ívelt metszésen át közelítjük meg a rekeszizom paracostalis cirkuláris átvágása és a peritoneum zsák tompa leválasztása útján. Az aorta proximalis kirekesztése a truncus coeliacus felett 4-5 cm-rel történik. Ezen a szinten való kirekesztés nem jár a gerincvelő ischamiás károsodásával. A distalis kirekesztést a renalis artériák alatt 3-4 cm-rel készítjük elő. Az aorta és a gerinc között tompán alagutat készítünk a lumbalis artériák lefogásának előkészítésére. Aláhurkoljuk a bal a renalist. Mérsékelt hypertonia bevezetése után 10 000 IU Heparinnal végzett anticoagulatiot követően óvatosan kirekesztjük az aorta descendenst, a subrenalis aortát és a lumbalis ágakat, majd ívelt aortotomiát végzünk. Előtűnik az állumenen át a dissecalt intima henger. Láthatóvá válnak a részben, vagy teljesen kiszakadt lumbalis, illetve a truncus coeliacus, a. mesenterica superior és bal renalis szájadékok. Megnyitva a valódi lument ballonnal zárjuk el azokat. A distalis aortát a valódi lumenbe vezetett Foley ballonnal is elzárhatjuk, ami a subrenalisan levált intimát kitámasztja a külső megmaradt aorta falhoz. Ezután a proximalis kirekesztés alatt harántul átvágjuk az levált intima hengert annak tapadási vonaláig, majd azt követve resecaljuk azt, és a tapadási vonal mentén, valamint a szájadékokban 4 - vagy 5/0-ás monofil tovafutó varrattal rögzítjük az intima szélt. A thoracalis szakaszon nyitva hagyjuk a kettős lument. A műtét lépéseit vázlatos rajzon a 16. ábránkon mutatjuk be.
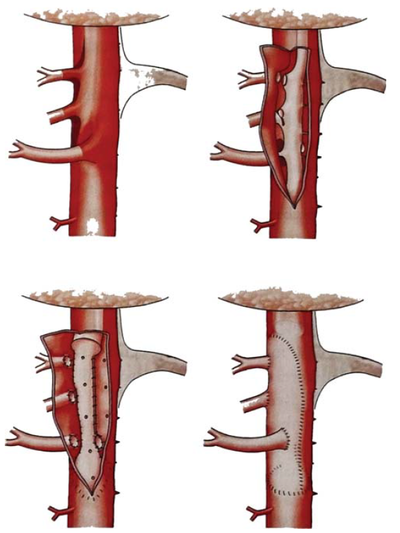
16. ábra.
A thoracoabdominalis aorta refenestratio lépéseinek sémás rajza, hosszú szakaszú aorta dissectio esetében.
Azokban az esetekben, ha a dissectio a subrenalis aortára és a medencei ágakra is ráterjed, a következő megfontolások jönnek szóba (17. ábra). Ha spontán refenestratio alakul ki az aorta bifurcatio körül és mindkét alsóvégtag perfusioja stabilan biztosított, meghagyhatjuk a subrenalis kettős lument. Amennyiben refenstratio nem alakult ki a subrenalis aortán mindkét iliaca irányába biztosítva a keringést, az aortotomia distalis pontján körkörös varrattal fixáljuk a levált intimát, helyreállítva a valódi lument. Ilyen esetekben intraoperativ stentgraft behelyezés is szóba jön. Jelentős subrenalis állumen, a külső és belső rétegek közötti jelentős méretkülönbség esetében, vagy preexistáló subrenalis aorta aneurysma esetében kiegészítő graft interpositio végzendő. Ha sub - renalis dissectio állumenének spontán refenestratioja nem történt meg, az késői aneurysma képződéshez vezethet.
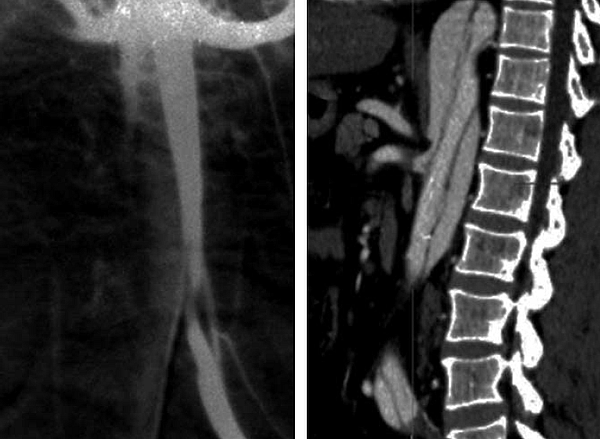
17. a-b. ábra.
A subrenalis aortára és az iliaca communisok területére is kiterjedő, hosszú szakaszú aorta dissectio DSA és CTA képe. A CTA képen jól látható a zsigeri ágak súlyos érintettsége is.
A proximalis aorta rövid felengedésével "kilövetjük" az állumenben esetleg meglévő mobilis alvadékot, átöblítjük a mellékágak szájadékait, majd az aortotomiát 4/0-ás monofil tovafutó varrattal zárjuk. Óvatosan felengedjük az aortát ügyelve a vérnyomás változásaira, kellő volumen pótlással és gyógyszeres korrekcióval stabilizáljuk azt. A fenti eljárás kirekesztési ideje 25-35 perc, ami nem éri el az érintett szervek meleg ischaemia tűrőképességének felső határát. Amennyiben a prolongált kirekesztés megkívánja, az érintett szervek szelektív kanülálása útján 0 C°-ra hűtött Ringer lactat oldattal tudunk hypothermiás védelmet nyújtani számukra. A keringés teljes helyreállítása után kis nyílást készítünk a peritoneumon, ami módot ad a hasűri szervek állapotának megítélésére - esetleges segmentalis bélelhalás vagy hasűri vérzés felismerésére. Az alvadási viszonyok rendezését és a műtéti terület áttekintését követően mellkasi és retroperitonealis drain behelyezése és a rekesz rekonstrukciója után a mellkas és hasfal réteges zárásával fejezzük be a beavatkozást. A distalis malperfusio sebészi kezelésének eredményei jelentős mértékben összefüggenek az instabil morfológiai helyzet felismerésével és beavatkozás időzítésével.
Gargiulo és mtsai 29 beszámoló alapján az alábbi 138, B típusú aorta dissectio okozta malperfusio esetében 120 betegnél regisztráltak alsó végtagi ischaemiát, ami 40 estben mindkét oldalt érintette. Csak alsó végtagi tünetek 44 esetben fordultak elő, de 35-nél renalis és 21-nél zsigeri malperfusio is társult a klinikai képhez. A radiológiai kép alapján a dissectio okozta károsodás a renalis arteriákra 47, a truncus coeliacusra 31, az a. mesenterica superiorra 30 esetben terjedt. 22 beteg gyógyszeres kezelésben részesült, 51 esetben sebészi és 65-nél endovascularis megoldást választottak. A sebészi módszerekkel kezelt esetekben (51 beteg) az alsó végtagi perfusios zavart 23 betegnél nyitott refenestratioval, 21-nél extraatomicus bypass megoldással és 2 esetben aorto-aorticus graft interpositioval oldották meg. Az endovascularisan kezelt 65 esetben percutan refenestratiot 31, illetve aorta - aortoiliacalis stent vagy stentgraft beültetést 54, mellkasi stentgraft behelyezést 18, aorta stentinget 21 és iliaca stentinget 24 esetben végeztek. A beavatkozások széles spektruma jól tükrözi a szerteágazó megoldási lehetőségeket. A gyógyszeres kezelésben részesült betegek 30 napos morbiditasa és mortalitasa 0% volt. A sebészileg kezelt csoportban 100%-os technikai sikerről számoltak be, de a 30 napon belül 13 betegnél észleltek klinikai jelentőségű szövődményt (31%). 5 esetben renalis insufficientia, 3-nál myocardialis infarctus, 2 esetben paraplegia, paraparesis, colon necrosis, amputatiohoz vezető ellenoldali végtagischaemia 1-1 esetben fordult elő. A sebészileg kezelt betegek 14 %-át veszítettek el - négyet subrenalis refenestratio után (16).
Az endovascularis módszerekkel kezelt betegekben technikai sikert 88%-ban értek el. A 30 napos szövődmény ráta 33% volt, TEVAR (thoracic endovascular aortic repair) esetében a morbiditás az első hónapban 46%-ot ért el. A szövődmények között compartment syndroma, vese, máj és gastrointestinalis ischaemia fordult elő. Mortalitás 8% volt. Saját anyagunkban 104 fenyegető malperfusio morfológiai jelei miatt operált betegünkben a mortalitási ráta 4% volt (17). Szeberin és mtsai B típusú dissectio szövődménye (17 malperfusio) miatt sebészi módszerekkel kezelt 42 beteget magába foglaló anyagában a halálozási arány 21.4 % volt. Ez a magasabb halálozási arány az aorta ruptúra és manifeszt zsigeri ischaemia állapotában nem preventíve operált betegek nagyobb műtéti kockázatának tudható be. Kétéves után követés során 6 betegük aorta ruptúra miatt halt meg, ami rávilágít a késői után követés jelentőségére (18).
Az általunk preferált thoracoabdominalis endaortectomia képes nagy biztonsággal helyreállítani a visceralis, renalis és alsóvégtagi keringést is - a fenyegető morfológiai helyzet felismerésével, gyors indikációval és preventív beavatkozással az érintett szervek meleg ischaemia tűrőképességi idején belül.
Összefoglalás
Az eljárás előnyeit az alábbiakban látjuk:
- megszünteti az állumenben a nyomásfokozódást.
- kiegyenlíti a valódi és állumen nyomásviszonyait.
- ezáltal csökkenti a külső fal feszülését, a korai aneuryma képződés esélyét,
- biztosítja az állumenből eredő segmentalis artériák direkt perfusioját.
- helyreállítja a zsigeri, renalis és az alsó testfél artériás keringését,
- gyors beavatkozással csökkenti az érintett szervek ischemia terhelését.
- A nyitott műtét lehetővé teszi az érintett szervek állapotának vizuális ellenőrzését, pl. bél elhalás megállapítását és annak kiterjedését.
- a hazai viszonyok között költséghatékony.
Hátránya a nagyobb sebészi trauma és a hosszabb hospitalisatio. Az eljárás hosszútávon stabil keringési és morfológiai viszonyokat alakít ki a zsigeri és renalis ágak területén. Klinikailag manifeszt szervkárosodás esetében az eljárás elkésettnek ítélhető, preventív beavatkozással azonban jó eredmények érhetők el. Késői aneurysma kialakulásra elsősorban Marfan-típusú congenitalis érfal deficienciák esetében számíthatunk. Betegeink évenkénti nyomonkövetése mind a szerv funkciók mind a morfológiai viszonyok ellenőrzése szempontjából elengedhetetlen.
Irodalom
- Cambria RP, Brewster DC, Gertler J, Moncure AC, Gusberg R, Tilson MD, Darling RC, Hammond G, Mergerman J, Abbott WM.: Vascular complications associated with spontaneous aortic dissection. J Vasc Surg. 1988 Feb; 7 (2):199-209.
- Hagan PG1 , Nienaber CA , Isselbacher EM , Bruckman D , Karavite D J, Russman PL , Evangelista A , Fattori R , Suzuki T , Oh JK, Moore AG , Malouf JF, Pape LA , Gaca C , Sechtem U , Lenferink S , Deutsch H J, Diedrichs H , Marcos y Robles J , Llovet A , Gilon D , Das SK, Armstrong W F, Deeb GM , Eagle KA: The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA. 2000 ;283 (7):897-903.
- Tsai TT, Evangelista A , Nienaber CA: Long-term survival in patients presenting with type A dissection: a CT-based feasibility study. Eur J Vasc Endovasc Surg. 2011;42:442-443
- van Bogerijen GHW, van Herwaarden JA, Conti M, Auricchio F, Rampoldi V, Trimarchi S, Moll FL: Importance of dynamic aortic evaluation in planning TEVAR. Ann Cardiothorac Surg. 2014 May; 3 (3): 300–306
- Nienaber CA, Powell JT: Management of acute aortic syndromes. Eur Heart J. 2012;33(1):26-35b
- Czerny M, Schoenhoff F, Etz C, Englberger L, Khaladj N, Zierer A, Weigang E, Hoffmann I, Blettner M, Carrel TP: The impact of Preoperative Malperfusion Outcome in Acute Type A Aortic Dissection: Results From the GERADA Registry. J Am Coll Card. 2015; 65(24): 2628-2635
- Morello F, Piler P, Novak M, Kruzliak P: Biomarkers for diagnosis and prognostic stratification of aortic dissection: challenges and perspectives. Biomark Med. 2014; 8 (7): 931-941
- Braverman AC: Acute Aortic Dissection, Clinician Update. Circulation. 2010;122 :184-188
- Gomez-Jorge J: Aortic Dissection Imaging. Medscape, Updated 2016, January 11
- Cho YH, Sung K, Kim WS, Jeong DS, Lee YT, Park PW, Kim DK: Malperfusio without organ failure is not a risk factor for surgical procedures for type A aortic dissection. Ann Thorac Surg. 2014;98 (1):59-64.
- Wang Z., Massimo C., Li M: Deployment of endograft in the ascending aorta to reverse type A aortic dissection. Asian J Surg. 2003;26:117-119
- Senay S, Alhan C, Toraman F, Karabulut H, Dagdelen S, Cagil H: Endovascular stent graft treatment of type A dissection :case report and review of literature. Eur J Vasc Endovasc Surg. 2007;34:457-460
- Trimarchi S, Nienaber CA, Rampoldi V, Myrmel T, Suzuki T, Bossone E, Tolva V, Deeb MG, Upchurch GR Jr, Cooper JV, Fang J, Isselbacher EM, Sundt TM , Eagle KA: IRAD Investigators. Role and results of surgery in acute type B aortic dissection: insights from the International Registry of Acute Aortic Dissection (IRAD). Circulation. 2006;114(1 Suppl):I357-64
- Shimokawa T, Horiuchi K, Ozawa N, Fumimoto K, Manabe S, Tobaru T, Takanashi S: Outcome of surgical treatment in patients with acute type B aortic dissection. Ann Thorac Surg. 2008;86(1):103-7
- Sfyroeras GS, Rubio V, Pagan P, Diethrich EB, Rodriguez JA: Endovascular management of malperfusion in acute type B aortic dissections. J Endovasc Ther. 2011;18(1):78-86
- Gargiulo M, Bianchini Massoni C, Gallitto E, Freyrie A, Trimarchi S, Faggioli G, Stella A: Lower limb malperfusion in type B aortic dissection: a systematic review. Ann Cardiothorac Surg. 2014;3(4):351-67
- Dzsinich C: Thoracoabdominal endaortectomy in case of type B aortic dissection. Acta Chir Belg. 2002;102(5):307-12
- Szeberin Z, Dósa E , Fehérvári M , Csobay-Novák C , Pintér N , Entz L: Early and Long-term Outcome after Open Surgical Suprarenal Aortic Fenestration in Patients with Complicated Acute Type B Aortic Dissection. Eur J Vasc Endovasc Surg. 2015;50(1):44-50
Írta: DR. DZSINICH CSABA
Érbetegségek: 2024/1. 5-12. oldal


