1 PTE KK Aneszteziológiai és Intenzív Terápiás Intézet, 2 PTE KK Érsebészeti Klinika, 3 PTE KK Sebészeti Oktató és Kutató Intézet, 4 Debreceni Egyetem Alkalmazott Kémiai Tanszék
Bevezetés: Az aszimmetrikus dimetil-arginin gátolja a nitrogén-oxid szintézisét, és az atherosclerosis markere. A preoperatív L-arginin és az aszimmetrikus dimetil-arginin kapcsolatát vizsgáltuk a cerebrális anaerob metabolizmust jelző juguláris laktát koncentrációval, a vér-agy gát integritását jelző S100B szintjével és az egyéb sebészi faktorokkal regionális anesztéziában végzett carotis endarterectomia során.
Módszerek: 55 a kutatásba bevont betegnél meghatároztuk az L-arginin, aszimmetrikus dimetil-arginin és a szimmetrikus dimetil-arginin szintjét carotis endarterectomia előtt vett artériás vérből. Szintén megmértük a vérgáz - értékeket, a laktát és az S100B koncentrációkat artériás és juguláris vénás vérben az a. carotis kirekesztése előtt, illetve a kirekesztés felengedése előtt és után. Kiszámoltuk az juguloarteriális szén-dioxid nyomáskülönbség / arterio - juguláris vér oxigéntartalom különbség hányadosát, ami az anaerob metabolizmus mutatója.
Eredmények: pozitív korrelációt találtunk a preoperatív aszimmetrikus dimetil-arginin szint és a kirekesztés alatti és a reperfúzió után számolt juguloarteriális szén-dioxid nyomáskülönbség / arteriojuguláris vér oxigéntartalom különbség hányados között (p=0,005 és p=0,01). Fordított korreláció volt a preoperatív L-arginin és a juguláris laktát koncentrációk között minden időpontban (p=0,002). Receiver Operating Characteristic analízis segítségével meghatároztuk a kritikus L-arginin értéket: 35 ?mol/l alatt magasabb volt a juguláris S100B szint 24 órával a műtét után (p=0,03) és a juguláris laktát-szint reperfúzió után (p=0,02). A preoperatív L-arginin mediánja alacsonyabb volt azoknál, akiknél később shunt behelyezésére volt szükség az a. carotis interna kirekesztése után (median: 30,3 ?mol/l [interkvartilis tartomány: 24,4-34,4 ?mol/l] vs. 57,6 ?mol/l [interkvartilis tartomány: 42,3-74,5 ?mol/l]; p =0,002).
Következtetések: a magas preoperatív aszimmetrikus dimetil-arginin koncentráció rossz cerebrális perfúzióval jár együtt, amit a magas juguloarteriális szén-dioxid nyomáskülönbség / arteriojuguláris vér oxigéntartalom különbség hányados is jelez. Az alacsony műtét előtti L- arginin szint előre jelzi a shunt behelyezés szükségességét. A preoperatív L-arginin és a kirekesztés alatt mért juguláris laktát, illetve az S100B közötti fordított korreláció a nitrogén-oxid donor L-arginin protektív szerepét sejteti.
Érbetegségek: 2020/1. 5-11. oldal
KULCSSZAVAK
aszimmetrikus és szimmetrikus dimetilarginin, L-arginin, carotis szűkület, endarterectomia, laktát
1 PTE KK Aneszteziológiai és Intenzív Terápiás Intézet, 2 PTE KK Érsebészeti Klinika, 3 PTE KK Sebészeti Oktató és Kutató Intézet, 4 Debreceni Egyetem Alkalmazott Kémiai Tanszék
Bevezetés
Az erek átmérőjét az L-arginin ? nitrogén-monoxid (NO) út szabályozza. A nitrogén-monoxid az L-arginin L-citrullinná történő átalakulása során szabadul fel a nitrogén-oxid szintáz enzim (NOS) segítségével (1). A NO szintézisét gátolni lehet az L-arginin guanin-szubsztituált analógjaival, mint az aszimmetrikus dimetil-argininnal (ADMA), ami a NOS aktív helyét gátolja. Az ADMA és a szimmetrikus dimetil-arginin (SDMA) az L-arginin fehérje lebontási termékei (2). Az SDMA az arginin felvételével vetélkedik és antagonizálja az L-arginin hatását (2,3). Nemrégiben argininben gazdag fehérjéket neuroprotektív hatásúnak találtak állatkísérletes modellekben (4). Ezzel szemben a keringésben lévő ADMA-szintet vizsgálták többféle kardiovaszkuláris betegségben, és magasnak találták hypoxiával, ischaemiás stroke-kal és carotis szűkülettel összefüggő állapotokban (5,6,7,8). Az ADMA emelkedett szintje kapcsolatban van az endotheldiszfunkcióval és az előrehaladottabb atherosclerosissal (1,5,8). Emellett az ADMA elősegíti a subklinikus érelmeszesedés kialakulását hely-specifikus módon, az artériás rendszer ismert sérülékeny pontjain erősebb proatherogen hatással (5,8).
Az a. carotis endarterectomia utáni újraelzáródása szintén magasabb szérum ADMA-szinttel jár (9). A perifériás vérben mért S100B szint a vér-agy gát diszfunkciójának és az ischaemiás agyi károsodásnak is érzékeny markere klinikailag tünetmentes carotis endarterectomia (CEA) során is (10,11). Feltételezésünk szerint az a. carotis interna kirekesztése alatt a v. jugularis internából származó és az artériás sav-bázis paraméterek tükrözik a cerebrális hypoperfusio mértékét. Különösen a P(j-a)CO2 különbség (CO2-gap) és a P(j-a)CO2/C(a-j)O2 arány lehetnek hasznos mutatói a kritikus agyi hypoperfusiónak (12). Feltételeztük, hogy az L-arginin út metabolitjai összefüggést mutatnak az agyi metabolikus válaszokkal, a vér-agy gát integritásával, illetve az agyi ischaemiás károsodással éberen végzett CEA során. Másodsorban a markerek shunt-behelyezés szükségességét előrejelző képességét vizsgáltuk.
Betegek
A vizsgálat protokollját elfogadta a helyi etikai bizottság, a betegeket tájékoztatáson alapuló beleegyezést követően vontuk be a vizsgálatba. 55 szignifikáns carotis szűkülettel élő beteget vontunk be prospektív vizsgálatunkba a PTE Érsebészeti Klinikáján. Kizárási kritérium volt a végállapotú vesebetegség, illetve a vizsgálatban való részvétel megtagadása. A szignifikáns carotis-szűkület diagnózisát carotis duplex ultrahanggal és CT-angiográfiával állították fel. A betegeket neurológiai vizsgálat után jegyezték elő carotis endarterectomiára. A carotis szűkület oldalának megfelelő fokális kieséssel, illetve a tranziens ischaemiás attack vagy minor stroke után lévő betegeket tekintettük szimptomatikusnak. 32 beteg volt szimptomatikus, 23 aszimptomatikus. A kétoldali duplex ultrahang vizsgálatot Philips HD7XE készülékkel és 5-10-MHz-es lineáris fejjel végezték, szürke és színes skálán a haránt és sagitális síkokban. A vizsgálat során az a. carotis interna (ICA) csúcs systoles sebességét (PSV), vég diastoles sebességét és az ICA PSV / a. carotis communis (CCA) PSV arányát határozták meg a 70-99%-os ICA szűkület azonosítására. A Carotis Konszenzus Panel kritériumai alapján diagnosztizálták a szignifikáns carotis stenosist (PSV > 230 cm/second, end-diastolic velocity > 100 cm/second, ICA/CCA ratio > 4) (13). A nemzetközi ajánlásokkal összhangban, a 70-99%-os szűkületeket tekintettük szignifikánsnak (14).
A betegek hypertoniával, dyslipidaemiával, diabetes mellitussal, stroke-kal vagy tranziens ischaemiás attack-kal, dohányzással, rendszeres gyógyszerszedéssel kapcsolatos anamnézisét felvettük.
Minden beteg regionális anesztéziában, éberen végzett carotis endarterectomián esett át (15). Mély és felületes cervikális blokádot végeztünk, amit szükség esetén további helyiérzéstelenítő adásával egészített ki az érsebész a műtét alatt. A betegekkel verbális kontaktust tartottunk és az operált oldallal ellentétes kéz motorikus működését is ellenőriztük. Shunt behelyezés mellett akkor döntöttünk, ha ICA kirekesztése után romlottak az ellenőrzött motorikus vagy verbális funkciók, illetve a beteg tudata.
Friss neurológiai kórjel jelentkezett 6 betegnél, amelyek shunt behelyezése után megszűntek. Egy 61 éves, strokeon átesett férfit kivettünk a vizsgálatból, mert a carotis kirekesztésekor azonnal intraoperatív ischaemiás stroke következett be (mely később végzetesnek bizonyult). Mivel vizsgálatunk célja a kirekesztés alatti ischaemiával szembeni tolerancia elemzése volt, ezt a közvetlen embolizációval járó esetet kizártuk. Csak klinikailag eseménytelen betegeket vontunk be a statisztikai analízisbe.
Módszerek
Vérmintavétel és laboratóriumi mérések. A műtéti előkészítés részeként artériás kanült helyeztünk be. A radiális artériából vett mintából meghatároztuk az összes vizsgált marker kiinduló értékeit a beavatkozás előtt. A v. jugularis internát az operáló érsebész kanülálta a műtét során, a kanül vége a véna koponyaalapi kilépésénél volt. Artériás és juguláris vénás vérmintákat vettünk vérgáz- (Radiometer Abl 800 flex) és laktát vizsgálatra, a műtét során összesen 4 alkalommal: az a. carotis kirekesztése előtt, a kirekesztés után 3 perccel, a kirekesztés felengedése előtt és után 1-1 perccel. A plazma-mintákat 60 percen belül -70°C-ra hűtöttük a vizsgálatig.
Az S100B plazma koncentrációját meghatároztuk a műtét előtt, a kirekesztés végén és a reperfúziókor a jugularis vénából vett mintából, 2 órával és 24 órával a műtét után a radiális artériából vett mintából. A mérés automatizált elektrokemiluminescens immunoassay módszerrel történt (Liaison Sangtec 100 system; DiaSorin, Bromma, Sweden).
A vérminták aminosav tartalmát szilárd fázis extrakció módszerrel (SPE) határozták meg és derivatizálás után magas teljesítményű folyadék kromatográfiával számszerűsítették (16,17). Az arginint és homoarginint ? =337 nmen határozták meg, az ADMA-t és SDMA-t ? = 520 nm és ? = 454 nm-en.
Összesen 55 beteget vontunk be vizsgálatunkba, azonban az L-arginin út metabolitjait csak 49-nél határoztuk meg, 6 beteg adatai elvesztek a rontott mintavétel miatt.
Statisztikai analízis. Az adatokat SPSS 20.0 segítségével dolgoztuk fel (IBM, Armonk, NY, USA). A kategorikus változókat abszolút és relatív gyakoriságuk átlaga alapján összegeztük (szám és százalékos arány). A mennyiségi változókat átlag és 96%-os konfidencia intervallum (CI), illetve átlag?standard deviáció (SD) segítségével írtuk le. A normalitás vizsgálatára a Kolmogorov-Smirnov tesztet használtuk. Demográfiai és klinikai tényezők analízisére kategorikus adatok esetén a chi-négyzet próbát, folyamatos adatok esetén a Student-féle t-tesztet alkalmaztuk. A non-parametrikus Mann-Whitney tesztet használtuk az S100B, laktát, L-arginin, ADMA, SDMA analízisére. A nem-normál eloszlást mutató adatokat medián + inter - kvartilis tartomány formában írtuk le. Bináris logisztikus regressziós analízis segítségével azonosítottuk a független prediktorokat. Az L-arginin cut off értékét a shunt behelyezés előrejelzésére receiver operator curve (ROC) analízissel határoztuk meg. Korreláció analízis a Spearmanféle korrelációs koefficiens (r) kiszámolásával történt. A p < 0,05 értéket fogadtuk el szignifikánsnak.

1. táblázat. Betegek adatai
Eredmények
A demográfiai és klinikai adatokat az 1. Táblázat mutatja. A biomarkerek, metabolitok preoperatív koncentrá - ció értékeit a 2. Táblázatban foglaltuk össze alcsoportokra bontva (szimptomatikus ? aszimptomatikus, shuntölt ? nem shuntölt betegek). A shunt-idő 20 ? 8 perc volt a shuntölt csoportban. A kirekesztési idő nem különbözött szignifikánsan a szimptomatikus és aszimptomatikus csoport között (23?6 min vs. 22? 6 min).
Preoperatív összefüggések. A preoperatív artériás L-arginin plazma koncentráció szignifikánsan alacsonyabb volt azokban a betegekben, akiknél később shuntöt kellett behelyezni (median 30.3 mmol/L, inter - kvartilis tartomány [IQR] 24.4-34.4 mmol/L vs. median 57.6 mmol/L [IQR 42.3-74.5 mmol/L]; p=0,002) (2. Táblázat).
A többi paraméterek tekintetében nem volt különbség a két csoport között. A preoperatív L-arginin koncentráció fordított korrelációt mutatott az artériás preoperatív laktát szinttel (r= -0,447, p=0,002). Nem volt korreláció az artériás laktát koncentráció és az ADMA, SDMA szintek között.
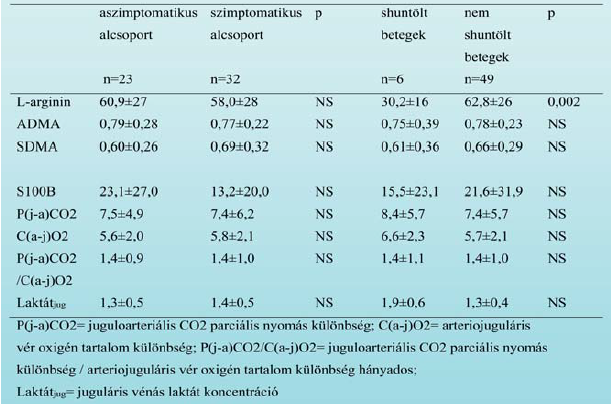
2. táblázat. Markerek és metabolikus paraméterek kiindulási koncentrációja az egyes alcsoportokban.
A vizsgált markerek szintjének időbeli változása. Megvizsgáltuk a preoperatív artériás L-arginin út metabolitjainak korrelációját az agyi anaerob metabolizmus mutatójával, a P(j-a)CO2/C(a-j)O2 aránnyal és a jugularis laktát koncentrációval, amiket a műtét kritikus időpontjaiban (kirekesztés előtt és után, kirekesztés felengedése előtt és után) mértünk. Fordított korrelációt találtunk a preoperatív L-arginin és a juguláris laktát szintek között, ami megmaradt a kirekesztés és a reperfúzió alatt is (r =-0,757 [p =0,002] és r = -0,678 [p = 0,008]). Ezzel szemben a preoperatív artériás ADMA koncentráció pozitív korrelációt mutatott az agyi anaerob metabolizmus mutatójával, a P(j-a)CO2/C(a-j)O2 aránnyal a kirekesztés és a reperfúzió alatt is (r = 0,701 [p = 0,005] és r = 0,644 [p = 0,01]) (3. Táblázat). A műtét előtt mért SDMA szint nem korrelált a P(j-a)CO2/C(a-j)O2 aránnyal.
Az ADMA és SDMA szintek egyik időpontban sem korreláltak a jugularis laktát koncentrációkkal. A juguláris S100B-t, a vér-agy gát sérülésének és az agy ischaemiás károsodásának markerét is vizsgáltuk. A preoperatív artériás L-arginin koncentráció az ADMA-val és SDMA-val ellentétben fordított korrelációt mutatott a reperfúzió után mért juguláris S100B-val (r= -0,702, p= 0,005) (3. Táblázat). Végezetül a P(j-a)CO2/C(a-j)O2 és az intraoperatív, illetve pre- és posztoperatív S100B koncentrá - ciók közötti korrelációt vizsgáltuk. A P(j-a)CO2/C(a-j)O2 arány a reperfúziót követően szignifikáns pozitív kor - relációt mutatott a műtét után 2 órával mért S100B koncentrá cióval. A műtét után 24 órával az összefüggés nem volt többé látható.
A preoperatív L-arginin prediktív szerepe. A preoperatív L-arginin és a juguláris laktát közötti fordított korreláció megfigyelése után feltételeztük, hogy a nitrogén-monoxid donor L-argininnak protektív szerepe lehet a cerebrális perfúzió kompenzálásában az a. carotis kirekesztése alatt, ezért ROC analízist végeztünk, hogy meghatározzuk az L-arginin cut off értékét. Úgy találtuk, hogy a 35 mmol/Lnél kisebb preoperatív L-arginin érték (area: 0,904; szenzitivitás: 95,0%; specificitás: 83,3% [p = 0,002]) előre jelezte a shunt behelyezés szükségességét (pozitív prediktív érték: 83%, negatív prediktív érték: 95%). A cut off értéket használva a betegeket két alcsoportra osztottuk: magas rizikójú (preoperatív L-arginine < 35 mmol/L ? n=7) és alacsony rizikójú (preoperatív L-arginine > 35 mmol/L ? n=42) csoportra. Bináris logisztikus regressziós analízis alapján, az életkor, társbetegségek, az ellenoldali carotis szűkület súlyossága, a biomarkerek kiindulási értékei közül egyedül a cut off értéknél kisebb kiinduló L-arginin-szint jelezte előre a shunt behelyezés szükségességét (odds ratio 0,061, 95% CI 0,004 ? 0,866; p = 0,039). Eszerint a cut off értéknél magasabb műtét előtti L-arginin szint kisebb kockázatot jelent a későbbi shunt behelyezés szempontjából.
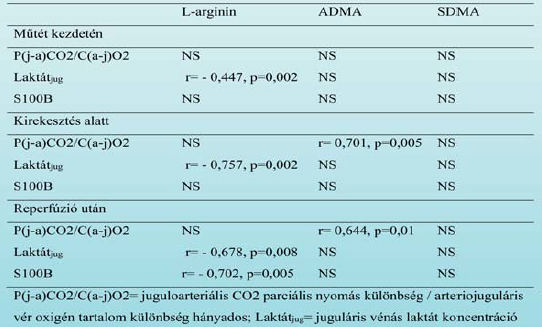
3. táblázat. Az L-arginin út metabolitjai és a cerebrális metabolizmus markerei közötti korreláció időbeli változása carotis endarterectomia alatt.
A magas és alacsony kockázatú alcsoportok összehasonlítása. A preoperatív L-arginin szint szerinti alcsoportok összehasonlításakor a juguláris laktát koncentráció szignifikánsan magasabb volt a magas kockázatú alcsoportban a kirekesztés felengedése után (median 1.8 mmol/L [IQR 1,5-2,2 mmol/L] vs. 1,3 mmol/L [IQR 1,0-1,6 mmol/L]; p =0,03). Hasonlóképpen, az S100B koncentráció szignifikánsan magasabb volt a magas rizikójú csoportban 24 órával a műtét után (median 53,9 nmol/L [IQR 43,9-57,0 nmol/L] vs. 12,4 nmol/L [IQR 1,7-34,0 nmol/L); p = 0,02).
A fentiek ellenére nem találtunk statisztikai különbséget sem az S100B, sem a juguláris laktát szint, sem a vérgázértékekből származtatott paraméterek tekintetében a shuntölt és nem shuntölt csoportok között.
Az anaerob metabolizmus indikátorai. Megvizsgáltuk a nem shuntölt betegekben az a. carotis interna kirekesztései ideje és az anaerob metabolizmus mutatói, mint az artériás és juguláris laktát és a P(j-a)CO2/C(a-j)O2 közötti kap - csolatot. A kirekesztési idő fordított korrelációt (0,296; p = 0,035) mutatott a kirekesztés felengedése előtt mért P(j-a)CO2/C(a-j)O2 értékkel. A juguláris laktát koncentráció fordítottan korrelált a P(j-a)CO2/C(a-j)O2-vel a kirekesztés előtt (0,345; p = 0,013). Hasonlóképpen a műtét előtti artériás laktát fordított korrelációt (0,332; p = 0,017) mutat a kirekesztés előtt mért P(j-a)CO2/C(a-j)O2 hányadossal, ami a reperfúzió alatt is megmarad (0,442; p = 0,002).
Megbeszélés
Úgy találtuk, hogy a műtét előtti plazma L-arginin koncentráció képes a későbbi shunt behelyezés szükségességét előre jelezni carotis endarterectomia során. Ez a megfigyelés nem szükségszerűen ok-okozati összefüggést jelent, inkább további kérdéseket vet fel és tisztázó vizsgálatokat, más noninvazív vizsgálatokkal való összevetéseket igényel. Néhány vizsgálat megkísérelte felderíteni a carotis kirekesztéssel szembeni intolerancia előrejelzőit. Az a. cerebri media transcraniális Dopplerrel (TCD) mért átlagos áramlási sebességének carotis kompresszió hatására történő maximális csökkenése jó előrejelzője a kirekesztéssel szembeni intoleranciának (18). Egy másik tanulmányban TCD-vel monitorizálták a vér áramlási sebességet CO2-vel és L-argininnel történő stimulálás mellett carotis műtét előtt és utána 3 hónappal (19). A szűkület oldalán műtét előtt szignifikánsan alacsonyabb reaktivitást találtak L-argininnel történő stimulálás hatására. Ez az aszimmetrikus válasz nem volt látható CEA után (19). A csökkent reaktivitás valószínűleg endothel diszfunkcióra vezethető vissza, ami 3 hónappal a műtét után nem észlelhető (19).
Ez a jelenség az L-arginin fiziológiás szerepét sejteti a hemodinamikai kompenzáló mechanizmusokban nyaki verőér betegségben (19). A diffúzió-súlyozott képalkotóval (DWI) kimutatott léziók száma és kiterjedése CEA után érzékeny előrejelzői az agyinfarktusnak (20,21).
Mivel a shunt behelyezés szükségessége éberen végzett CEA során gyakran társul DWI agyi léziók kialakulásával (21), az agykárosodást jelző S100B fehérje szintjének szignifikáns emelkedését vártuk, a juguláris és artériás mintákban is. Ennek ellenére vizsgálatunkban a juguláris S100B nem tudta előre jelezni a shunt behelyezés igényét. A műtét előtti L-arginin koncentráció volt az egyetlen marker, mely képes volt erre. Feltételeztük, hogy az L-arginin út befolyásolhatja az agyi vérátáramlást az erek tónusának szabályozása által (2,4,22,23). Ezzel összhangban a beavatkozás előtti L-arginin koncentráció fordított korrelációt mutatott a kirekesztés előtti és a reperfúzió utáni juguláris laktát szinttel, a nitrogén-monoxid donor L-arginin jótékony metabolikus hatását sejtetve (24). Emellett a posztoperatív 24. órában mért S100B koncentráció alacsonyabb volt azokban, akiknél a preoperatív L-arginin szint magasabb volt, ami az L-arginin neuro - protektív hatására utalhat (4,22,23).
Az L-arginin út ilyen aktivációja az ischaemiás prekondicionálás része lehet atherosclerotikus betegekben. Ezt alátámasztja, hogy kísérletes körülmények között előidézett stroke-ban az L-argininnel történt előkezelés meg tudta előzni a hipoxiás agykárosodást (24). Továbbá az L-arginin csökkentette az ischaemiás/reperfúziós károsodást és a posztkondicionálás neuroprotektív hatását mutatta (25). Felmerül, hogy az L-arginin emelkedett biológiai hozzáférhetősége a krónikus ischaemiás állapotra adott adaptív válasz lehet, ahogy azt krónikus hipoxiában leírták (6). Az L-argininnel szemben az ADMA preoperatív koncentrációja pozitívan korrelál az anaerob agyi meta - bolizmus mutatójával, a P(j-a)CO2/C(a-j)O2 aránnyal, de a kirekesztés alatt és a reperfúziókor mért juguláris laktáttal nem. E szerint a magas ADMA szint rossz cerebrális perfúzióval jár együtt, feltehetően vazokonstriktor hatásának megfelelően (26). ADMA infúzió növelte az erek merevségét és csökkentette az agyi vérátáramlást egészséges önkéntesekben (26). A P(j-a) CO2/C(a-j)O2 arány a reperfúzió után pozitívan korrelált az S100B 2 órával a műtét után mért koncentrációjával. Valószínűleg a reperfúzió utáni magasabb juguloarteriális CO2 különbség vagy az alacsonyabb arteriojugularis vér oxigén tartalom különbség a vér-agy gát sérülésére utalhat (12). Az ischaemiás agykárosodás lehetőségét nem erősítették meg az S100B mérések, hiszen értékük normalizálódott a műtét után 24 órával az alacsony rizikójú csoportban. Az összes beavatkozás klinikailag eseménytelen volt. Tanulmányunk fontos hiányossága, hogy nem történt képalkotó vizsgálat az agyi silent ischaemiás léziók kimutatására a látszólag tünetmentes betegeknél CEA után. A preoperatív L-arginin és juguláris laktát közötti fordított korreláció megfigyelése és a nitrogén-monoxid donor L-arginin protektív szerepének feltételezése miatt meghatároztuk a preoperatív L-arginin cut off értékét, ami előre jelzi a shunt behelyezés szükségességét. Ezt az értéket használva a betegek azon alcsoportját, akiknél a kezdeti L-arginin szintje 35 mmol/Lnél kisebb volt magas rizikójúnak tartottuk a carotis kirekesztése utáni kompenzálatlan agyi keringés szempontjából. Fontos, hogy ez a határérték kifejezetten alacsony az egészséges alanyokéval összehasonlítva (23). Hasonlóképp, a 10-től 60 mmol/L-ig terjedő L-arginin értékek az ADMA 0,1 mmol/L-es emelkedésével időskorban kiemelt halálozási kockázatot jelentenek. A magasabb rizikó 60 mmol/L-es L-arginin érték felett eltűnik (27). Érdekes módon az ellenoldali carotis szűkület nem jelzi előre a shunt behelyezés szükségességét. Az L-arginin alapú alcsoport analízisből nyert adatok megmutatták, hogy a betegek küszöbérték alatti L-arginin szinttel sérülékenyebbek az anaerob metabolizmussal szemben, amit a juguláris laktát megnövekedett termelése és a vér-agy gát sérülésére vagy silent ischaemiára utaló magas S100B szint jelez klinikailag eseménytelen endarterectomiák során is. Mindeddig a következő tényezőket hozták összefüggésbe a shunt - behelyezés nagyobb gyakoriságával: idősebb életkor, női nem, az ellenoldali a. carotis interna elzáródása, illetve az ellenkező oldali a. carotis communisban Dopplervizsgálattal mérhető kisebb átlagos áramlás (28). Ezzel szemben a korábban elvégzett ellenoldali CEA csökkentette a shunt szükségességének valószínűségét (28). A mi vizsgálatunk nem hasonlítható össze ezzel a prospektív adatbázissal, mert az esetszám kisebb és az átlagos életkor alacsonyabb volt; továbbá több férfit vontunk be a vizsgálatba ellenoldali carotis elzáródás nélkül; a pre - operatív endotel diszfunkció mutatóira, az L-arginin út markereire fókuszáltunk duplex scan paraméterek helyett. Eredményeink azt mutatják, hogy a pre- és intraoperatív L-arginin és ADMA szintek mérése és értékelése klinikailag hasznos lehet az ischaemiás események megelőzésében.
Az ígéretes pozitív és negatív prediktív értékekre alapozva vizsgálatunk azt sejteti, hogy 35 mmol/L-nél magasabb preoperatív L-arginin szint esetén alacsony a shunt behelyezés szükségességének valószínűsége CEA során. Ugyanakkor a shuntölt betegek alacsony száma megnehezíti a pontos prediktív értékek kiszámítását. Más szerzők is hangsúlyozzák a shunt behelyezés szükségességét vizsgáló tanulmányok nehézségeit. A shunt-igény magasabb rizikóját előre lehet jelezni, de nem lehet előre megmondani, hogy melyik betegnek lesz ténylegesen szüksége shunt használatára, illetve kit lehet biztonságosan shunt nélkül operálni (29). Némely eredményünk alacsony esetszámon alapul (pl. shuntölt betegek), ezért újabb prospektív tanulmány szükséges nagyobb esetszámmal, hogy meghatározzuk az L-arginin szerepét a shunt igény előrejelzésében és hatását a kimenetelre. Az L-arginin mérések hasznát általános anesztéziában végzett CEA során is ellenőrizni kell.
Jövőbeli kilátások. Azoknál a betegeknél, akiknél ép a Willis-kör és ennek megfelelően az azonos oldali agyi vérellátás biztosított a carotis kirekesztése alatt, a sérült cerebrális autoreguláció feltehetően kisebb jelentőségű. Az L-arginin-szintről és az a. cerebri media vizsgálatával a Willis-kör állapotáról nyert információk segíthetnek a carotis kirekesztése alatt agyi ischaemia szempontjából fokozottan veszélyeztetett betegek pontosabb azonosításában. További vizsgálatok tisztázhatják, hogy a küszöbértéknél alacsonyabb L-arginin szintű betegeknél előnyös lehet-e az L-arginin pótlása a műtét előtt.
Irodalom
- Luiking YC, Engelen MP, Deutz NE. Regulation of nitric oxide production in health and disease. Curr Opin Clin Nutr Metab Care 2010;13:97-104
- Surdacki A. L-arginine analogseinactive markers or active agents in atherogenesis? Cardiovasc Hematol Agents Med Chem 2008;6:302-311
- Vallance P, Leiper J. Cardiovascular biology of the asymmetric dimethylarginine: dimethylarginine dimethylaminohydrolase pathway. Arterioscler Thromb Vasc Biol 2004;24:1023-1030
- Meloni BP, Brookes LM, Clark VW et al. Poly-arginine and arginine-rich peptides are neuroprotective in stroke models. J Cereb Blood Flow Metab 2015;35:993-1004
- Stühlinger MC, Stanger O. Asymmetric dimethyl- L- arginine (ADMA): a possible link between homocyst(e)ine and endothelial dysfunction. Curr Drug Metab 2005;6:3-14
- Pekarova M, Koudelka A, Kolarova H, et al. Asymmetric dimethyl arginine induces pulmonary vascular dysfunction via activation of signal transducer and activator of transcription 3 and stabilization of hypoxiainducible factor 1-alpha. Vasc Pharmacol 2015;73: 138-148
- Nishiyama Y, Ueda M, Katsura K et al. Asymmetric dimethylarginine (ADMA) as a possible risk marker for ischemic stroke. J Neurol Sci 2010;290:12-15
- Maas R, Xanthakis V, Polak JF et al. Association of the endogenous nitric oxide synthase inhibitor ADMA with carotid artery intimal media thickness in the Framingham Heart Study offspring cohort. Stroke 2009;40:2715-2719
- Zinellu A, Sotgia S, Porcu P et al. Carotid restenosis is associated with plasma ADMA concentrations in carotid endarterectomy patients. Clin Chem Lab Med 2011;49:897-901
- Arfvidsson B, Nilsson TK, Norgren L. S100B concentrations increase perioperatively in jugular vein blood despite limited metabolic and inflammatory response to clinically uneventful carotid endarterectomy. Clin Chem Lab Med 2015;53:111-117
- Capoccia L, Sbarigia E, Rizzo A et al. Silent stroke and cognitive decline in asymptomatic carotid stenosis revascularization. Vascular 2012;20:181-187
- Zanier ER, Rossi S, Conte V et al. The ratio between arterio-venous PCO2 difference and arteriojugular oxygen difference as estimator of critical cerebral hypoperfusion. Minerva Anestesiol 2006;72:543-549
- Grant EG, Benson CB, Moneta GL et al. Carotid artery stenosis: gray-scale and Doppler US diagnosis-Society of Radiologists in Ultrasound Consensus Conference. Radiology 2003;229:340-346
- AbuRahma AF, Srivastava M, Stone PA et al. Critical appraisal of the carotid duplex consensus criteria in the diagnosis of carotid artery stenosis. J Vasc Surg 2011;53:53-59
- Dellaretti M, de Vasconcelos LT, Dourado J et al. Locoregional anesthesia for carotid endarterectomy: identification of patients with intolerance to crossclamping. World Neurosurg 2016;87:61-64
- Nonaka S, Tsunoda M, Imai K et al. High-performance liquid chromatographic assay of NG-monomethyl-Larginine, NG,NG-dimethyl-L-arginine, NG,NG'- dimethyl-L-arginine using 4-fluoro-7-nitro-2,1,3-benzoxadiazole as a fluorescent reagent. J Chromatogr A 2005;1066:41-45
- Zsuga J, Torok J, Magyar MT, et al. Dimethylarginines at the crossroad of insulin resistance and atherosclerosis. Metabolism 2007;56:394-399
- Anzola GP, Limoni P, Cavrini G. Predictors of carotid clamping intolerance during endarterectomy that would be wise to apply to stenting procedures. Cerebrovasc Dis 2008;26:494-501
- Micieli G, Bosone D, Zappoli F et al. Vasomotor response to CO2 and L-Arginine in patients with severe internal carotid artery stenosis; pre- and post-surgical evaluation with transcranial Doppler. J Neurol Sci 1999;163:153-158
- Wolf O, Heider P, Heinz M et al. Frequency, clinical significance and course of cerebral ischemic events after carotid endarterectomy evaluated by serial diffusion weighted imaging. Eur J Vasc Endovasc Surg 2004;27:167-171
- Bourke VC, Bourke BM, Beiles CB. Operative factors associated with the development of new brain lesions during awake carotid endarterectomy. Eur J Vasc Endovasc Surg 2016;51:167-73
- Meloni BP, Milani D, Edwards AB et al. Neuro - protective peptides fused to argininerich cell penetrating peptides: neuroprotective mechanism likely mediated by peptide endocytic properties. Pharmacol Ther 2015;153:36-54
- Molnar T, Pusch G, Papp V et al. The L-arginine pathway in acute ischemic stroke and severe carotid stenosis: temporal profiles and association with biomarkers and outcome. J Stroke Cerebrovasc Dis 2014;23:2206-2214
- Abdel Baky NA, Zaidi ZF, Fatani AJ et al. Nitric oxide pros and cons: the role of L-arginine, a nitric oxide precursor, and idebenone, a coenzyme-Q analogue in ameliorating cerebral hypoxia in rat. Brain Res Bull 2010;83:49-56
- Gulati P, Singh N. Neuroprotective mechanism of ischemic postconditioning in mice: a possible relationship between protein kinase C and nitric oxide pathways. J Surg Res 2014;189:174-183
- Kielstein JT, Donnerstag F, Gasper S et al. ADMA increases arterial stiffness and decreases cerebral blood flow in humans. Stroke 2006;37:2024-2029
- Pizzarelli F, Maas R, Dattolo P et al. Asymmetric dimethylarginine predicts survival in the elderly. Age (Dordr) 2013;35:2465-2475
- Kretz B, Abello N, Bouchot O et al. Risk index for predicting shunt in carotid endarterectomy. Ann Vasc Surg 2014;28:1204-1212
- Pennekamp CW, van Laar PJ, Hendrikse J et al. Incompleteness of the circle of Willis is related to EEG-based shunting during carotid endarterectomy. Eur J Vasc Endovasc Surg 2013;46:631-637
DR. SZABÓ PÉTER1, DR. MENYHEI GÁBOR2, DR. LANTOS JÁNOS3, DR. NAGY LAJOS4, DR. VÖLGYI ÉVA1, DR. MÁRTON SÁNDOR1, DR. MOLNÁR TIHAMÉR1
1 PTE KK Aneszteziológiai és Intenzív Terápiás Intézet, 2 PTE KK Érsebészeti Klinika, 3 PTE KK Sebészeti Oktató és Kutató Intézet, 4 Debreceni Egyetem Alkalmazott Kémiai Tanszék
Érbetegségek: 2020/1. 5-11. oldal


