Az Érbetegségek 2009/4. számában "Ischaemiás-reperfúziós károsodás csökkentésének elvi és gyakorlati lehetőségei az érsebészetben" címmel jelent meg áttekintő közlemény az oxidatív stressz ereket érintő káros hatásairól és annak megelőzéséről, amely összefoglalta az irodalom jelenlegi állását a témakörben. Ezúttal egy, ezzel a problémakörrel foglalkozó hazai vizsgálatot mutatunk be.
Az arteria thoracica interna az első számú választás miokardiális revaszkularizáció esetén, de az endothelsérülés kapcsán kialakuló perioperatív vazospazmus limitálja funkcionalitását. Az oxidatív és nitrozatív stressz jelentős szerepet játszik az endothelsérülés kapcsán kialakuló kóros értónusban. Az oxidatív stressz sejtkárosító hatásainak egyik fő útvonala a peroxinitrit-poli(ADP-ribóz) polimeráz kaszkád. Célunk az volt, hogy megvizsgáljuk a graftok morfológiai állapotát, funkcionalitását, a kialakuló oxidatív és nitrozatív stressz mértékét, valamint a poli(ADP-ribóz) polimeráz enzim gátlásának lehetséges előnyös hatásait. A graftokból származó minták 47 koronária bypass műtéttel kezelt beteg (26 férfi, átlagos életkor 66,2±1,7 év) írásos hozzájárulásával kerültek vizsgálatra. A mintákon hisztológiai és immunhisztológiai vizsgálatokat végeztünk, valamint a funkcionális állapot meghatározásához izometriás feszülést vizsgáltunk acetilkolin és Na-nitroprusszid használatával. A dózishatás összefüggéseket megvizsgáltuk 1 µM poli(ADP-ribóz) polimeráz gátló kezelés mellett is. A metszetek érelmeszesedésre utaló elváltozásokat, valamint oxidatív és nitrozatív stresszt igazoló 3-nitrotirozin, 4-hidroxinonenal és poli-ADPribóz festést mutattak. A funkcionalitásra vonatkozó eredményeink szerint 88,1% húzódott össze a direkt simaizom-összehúzódást kialakító K-Krebs hatására, 68,7% kontrahált 1 µM fenilefrinre, 29,9% relaxált 30 µM acetilkolinra és minden összehúzódott érszegmentum ellazult 30 µM Na-nitroprusszid hatására. Nagy amplitúdójú vazomóció, a spazmus korai jele, az érminták 47,8%-ában volt megfigyelhető. A Na-nitroprusszid és a tromboxán A2 receptor antagonista ICI-192605 megszüntette a vazomóciót, azonban az érminták inkubációja poli(ADP-ribóz) polimeráz gátlóval nem javította az endothelfüggő vazodilatációt. Tehát a koronária bypass műtétre kerülő betegekből származó arteria thoracica interna graftminták mind morfológiai, mind funkcionális szempontból károsult erekre utalnak, amin a poli(ADP-ribóz) polimeráz gátló nem képes javítani. A helyileg a műtét során alkalmazott Na-nitroprusszid vagy további vizsgálatok után tromboxán A2 receptor antagonisták használata az operáció során javíthatja a graftok vaszkuláris funkcióit az ér relaxálása és a vazomóció megszűntetése révén.
Érbetegségek: 2010/2. 9-15. oldal
KULCSSZAVAK
arteria thoracica interna, perioperatív vazospazmus, oxidatív stressz, poli(ADP-ribóz) polimeráz, vazomóció, vazodilatáció
Bevezetés
Az a. coronaria bypass műtéte esetén (CABG) az elsődleges választás az arteria thoracica interna (ATI), mert a többi lehetséges grafttal (a. radialis, v. saphena) összehasonlítva az eredmények kedvezőbbek (1,2). Az ATI graftok előnyös rövid- és hosszútávú eredményeit a jobb állapotban lévő endothelfunkciónak tulajdonítják (3,4). Mégis, az ATI graftok gyakori perioperatív spazmusa csökkentheti a véráramlást és következményesen hozzájárulhat a kezdeti miokardiális ischaemiához, növelve a periperatív morbiditást és mortalitást (5). A perioperatív spazmus leküzdésére gyakran alkalmazásra kerülnek vazodilatátorok a műtét során, azonban a megfelelő szer kiválasztásához nem állnak rendelkezésre részletes és egyértelmű szakmai állásfoglalások (6-9). A klasszikus technika szerint az a. thoracica interna ún. "pedikulumként" kerül preparálásra és a disztális rész klippelése, majd elmetszése után kerülhet rá egy értágítóval átitatott lap, amíg az anastomosis kialakítása megtörténik. Immunhisztokémiai viszgálatok analízise azt mutatta, hogy ez a módszer az endothelréteg károsodásához vezet és csökkenti a nitrogén monoxid termelődését, ami a vazokonstriktor és vazodilatátor hatások közötti egyensúly megbomlásához vezet (10). A sérült egyensúly tromboxán A2 receptorokon keresztül spazmusos vazomóció kialakulását okozhatja (11). A spazmusos, nagy amplitúdójú vazomóciót számos érterületen leírták már és az értónus kóros szabályozásaként jelenik meg, ami elégtelen perfúziót hoz létre a szövetekben (12). Ez a jelenség a graftok CABG műtét alatti helyi kezelésében eddig nem került figyelembe vételre. Noha más artériás graftokkal összehasonlítva az ATI esetén alacsonyabb az atherosclerosis gyakorisága (1,2), kalcifikáció és további érelmeszesedésre utaló jelenségek ezen erekben is kimutathatóak (13). Az oxidatív és nitrozatív stressz fontos szerepet játszik az ateroszklerózis patogenezisében (14,15), amit igazol, hogy jelentős mértékű, oxidatív eredetű DNS-károsodásokat mutattak ki az ateroszklerotikus plakkokban (16). A szabad gyökök sejtkárosító hatásának egyik fő útvonala a peroxinitritpoli( ADP-ribóz) polimeráz (PARP) kaszkád. A PARP egy energiaigényes, sejtmagban lokalizálódó enzim, amely a DNS-károsodások esetén lép működésbe, majd működése során NAD+ és ATP olyan mértékben kerülhet felhasználásra, hogy az a sejt működési zavarához majd nekrotikus sejthalálhoz vezet (17). A PARP-aktiváció szerepe az atherosclerosis kialakulásában már bizonyítást nyert (18), és állatkísérletes modellekben a PARP gátlása képes volt az atherosclerosis korai jeleként kialakuló endotheldiszfunkció visszafordítására (19,20). Az ATI graft endothelfunkciója a CABG műtét során tovább is károsodhat, amikor az ischaemiás-reperfúziós folyamatok során további szabadgyök-képződés és következményes DNS-károsodás, majd PARP-aktiváció jön létre. A graftok jelenlegi helyi farmakológiai kezelése ezt a problémát csak korlátozottan veszi figyelembe.
Vizsgálatunk céljai a következők voltak: (1) felmérni a Semmelweis Egyetem Ér- és Szívsebészeti Klinikáján felhasználásra kerülő a. thoracica interna graftok morfológiáját és funkcionalitását; (2) megvizsgálni az érmintákban fellépő spazmusos vazomóció gyakoriságát és gátlásának lehetőségét; (3) immunhisztokémiai vizsgálatokkal elemezni a graftokban kialakuló oxidatív és nitrozatív stressz mértékét és a PARP aktivációját; (4) megvizsgálni annak lehetőségét, hogy a PARP-gátlás javíthatja-e a felhasznált graftok funkcionalitását.
Beteganyag és módszerek
Humán szövetminták gyűjtése
A Semmelweis Egyetem Ér- és Szívsebészeti Klinikáján koronária bypass műtéten átesett 47 betegből származó, arteria thoracica interna (ATI) mintát gyűjtöttünk (a betegek közül 26 férfi, 26 hipertenzív, 21 cukorbeteg; átlagos életkoruk 66,2±1,7 év, testtömegindex 28,6±0,8). A betegek különböző kardiovaszkuláris indikációjú gyógyszerkészítmények széles skáláját szedték, többek között statinokat, nitrátokat, ß-blokkolókat vagy kálciumcsatorna gátlókat. A tanulmányunkat az intézményi etikai bizottság engedélyével végeztük (TUKEB 8/2004.), és a betegek, megfelelő tájékoztatás után, írásos beleegyezésüket adták a minták felhasználásához.
Szövettan és immunhisztokémia
Az ATI minták egy részét (29 beteg) 4%-os pufferelt formalinban fixáltuk rögtön a mintavételt követően, majd paraffinos metszeteket készítettünk. A metszeteket vagy hematoxilin-eozin (HE) festéssel készítettük elő szövettani elemzésre, vagy immunhisztokémiai módszerekkel jelöltük. Az immunhisztokémiai jelöléshez 0,6% H2O2 metanolos oldatával inaktiváltuk az endogén peroxidázt és az antigén epitópok feltárásához mikrohullámú sütőben főztük 0,2 M-os citrát pufferban (pH 3,0). Ezután 1,5%-os normál kecske szérummal blokkoltuk a nem specifikus kötőhelyeket, és a nitrozatív stressz markereként használt anti-3-nitrotirozin antitesttel (3-NT, poliklonális, 1:80; Upstate Biotechnology, Lake Placid, NY, USA), illetve lipid peroxidációs marker anti-4-hidroxinonenal antitesttel (4-HNE; monoklonális; 1:100; Oxis International Inc., Portland, OR, USA), vagy a PARP aktivitás detektálására anti-poli-ADP-ribóz antitesttel (PAR; poliklonális; 1:100; Calbiochem, San Diego, CA, USA) jelöltük. Másodlagos antitestünk minden esetben biotinilált volt, majd az ABC módszer szerint tettük láthatóvá a jelölt antigéneket, amikor is 3, 3'-diaminobenzidin-tetrahidroklorid (DAB) és H2O2 szubszrátot használtunk (Vector, Laboratories, Burlingame, CA, USA). Az immunhisztokémiai jelölésekhez Gill hematoxilin festést használtunk háttérnek (Accustain, Sigma Diagnostics, St. Louis, MO, USA).
Funkcionális vizsgálatok
A megmaradt 18 mintát 4°C-on tartottuk Krebs oldatban, amely a következőket tartalmazta: CaCl2 1,5 mM, MgSO4 1,2 mM, NaCl 118 mM, NaHCO3 14,8 mM, KCl 4,6 mM, NaH2PO4 1,2 mM, glükóz 11,1 mM, és a mintavételezést követően két órán belül feldolgoztuk. Az erekről egy Petri csészében eltávolítottuk a kötőszövetet és egyéb szövetmaradványokat, majd 3 mm-es szegmenseket (gyűrűk) metszettünk belőlük és szervfürdőbe helyeztük, amelyeket 37°C-os, oxigenált (95% O2, 5% CO2) Krebs oldattal töltöttünk fel. Az érgyűrűk izometriás tónusát izometriás erőmérővel (myograph, HBM, Q11) határoztuk meg, amit erősítőhöz (HBM, MGA II), azt pedig regisztrálóhoz (Kipp Zonen, BD300) kapcsoltuk. 1 g-nak megfelelő előfeszítést alkalmaztunk és az ereket egy órán át hagytuk a mérési körülményekhez alkalmazkodni. A preparátumokat 20 percenként friss Krebs oldattal láttuk el. Az alkalmazkodási periódust követően káliumban gazdag depolarizáló oldattal, azaz módosított Krebs oldattal (K-Krebs, K+ 124 mM) vizsgáltuk az érgyűrűk kontrakciós válaszát, ezzel határoztuk meg funkcionális integritásukat. Az endothel és a vaszkuláris simaizom funkcionális vizsgálatához az ereket fenilefrinnel kontraháltattuk (prekontrakció, Phe 10-6 M), majd acetilkolinnal (Ach), illetve natrium-nitroprussziddal (SNP) felvettuk a relaxacios valasz dozis-hatas gorbejet (10-8 M . 3x10-5 M). A vazomocio vizsgalatara vagy SNP-t (10 ĘM) vagy tromboxan A2 (TXA2) receptor antagonista ICI-192605-t (50 µM) használtunk. Annak megállapítására, hogy a PARP gátlásnak lehet-e jótékony hatása, két vizsgálati csoportot alkottunk azokból a mintáinkból, amelyek nem mutattak vazomóciót. Ezeket a gyűrűket, miután felvettük velük az acetilkolinra és a nátrium-nitroprusszidra kialakuló dózis-hatás görbét, további 60 percig inkubáltuk a fenantridinon-származék PARP gátló PJ34-gyel (1 µM), illetve fiziológiás sóoldat hozzáadása mellett, majd újra felvettük a dózis-hatás görbéket.
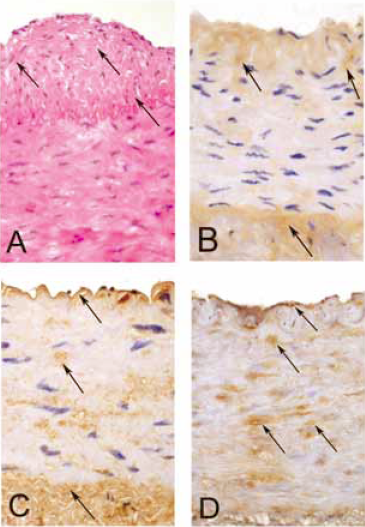
1. ábra. Hisztológiai és immunhisztokémiai eredmények (40x nagyítás). (A) Reprezentatív arteria thoracica interna szegmentum, mely intimamegvastagodást, simaizom migrációt, és habossejt-képződést mutat (nyilak). Oxidatív és nitrozatív stresszt igazol a pozitív 3-nitrotirozin (B) és 4-hidroxinonenal (C) festés. Minden vizsgált érszegmentumban megfigyelhető volt a poli-(ADPribóz) polimeráz aktiváció (a nyilak a specifikus festést jelölik).
Vegyszerek
A PARP inhibitor PJ34-et az Inotek Pharmaceuticals Corporation-tól (Beverly, MA, USA) szereztük be, az ICI- 192605-t a Tocristól (Bristol, UK). Minden egyéb vegyszer a Sigmától származott. A fenilefrin, az acetilkolin, a nátrium-nitroprusszid és a PJ34 oldatokat mindig a kísérlet előtt készítettük el, hordozóanyagként fiziológiás sóoldatot használva, míg az ICI-192605-t dimetil-szulfoxidban (DMSO) oldottuk fel. A DMSO végleges koncentrációja a preparátumon nem volt magasabb, mint 0,5%, és ebben a koncentrációban a DMSO-nak nem volt érhatása.
Statisztikai analízis
Minden eredményt átlag±standard hiba (SE) formában adtunk meg. A statisztikai értékelés GraphPad Prism 4.03 programmal, ANOVA varianciaanalízis és Dunnett-féle post hoc teszt segítségével történt. Szignifikánsnak a p<0,05 valószínűséget tekintettük.
Eredmények
Szövettani és immunhisztokémiai felismerések
A metszeteken ateroszklerotikus jeleket: megvastagodott intimát, simaizomsejtek bevándorlását, makrofágakkumulációt és habos sejtek képződését, valamint kalcifikációt figyeltünk meg. Az oxidatív és nitrózatív stressz emelkedett szintjét a pozitív 3-nitrotirozin és 4-hidroxinoneal festődés igazolta, és a következményes PARP aktiválódást szintén láthattuk minden vizsgált érgyűrűben (1. ábra).

2. ábra.
Az arteria thoracica interna érszegmentumok funkcionális tulajdonságai. (A) 67 érgyűrűből 59 (88,1%) reagált K-Krebsre, 46 (68,7%) kontrahált 1µM fenilefrinre. Minden előfeszített érgyűrű relaxált nátriumnitroprusszidra, de csak 20 minta (29,9%) mutatott mérhető relaxációt acetilkolinra. (B) Az 50 µM koncentrációjú tromboxán A2 receptor-antagonista ICI-192605 gátló hatásának reprezentatív felvétele. Hasonló eredmények voltak elérhetőek 10 µM nátrium-nitroprusszid alkalmazásával.
Az érgyűrűk funkcionális jellemzése Az érgyűrűk funkcionális karaktere jelentős különbséget mutatott, még az ugyanazon betegből származó érminták is heterogén módon viselkedtek. Összesen 67 érgyűrűt képeztünk a mintákból, és ezek közül 59 (88,1%) kontrahált K-Krebs oldat hatására, 46 (68,1%) összehúzódott 1 µM fenilefrin adását követően, és ezek mindegyike relaxált 30 µM nátrium-nitroprusszid hatására. Az endothel-dependens vazorelaxációt vizsgálva azt találtuk, hogy csupán 20 preparátum (29,9%) volt képes legalább 20%-os relaxációra 30 µM Ach jelenlétében (2A ábra). Nagy amplitúdójú vazomóciót 32 mintánál (47,8%) tapasztaltunk, ami a vazospazmus korai jele. Mind a tromboxán-A2 receptor (TXA2-R) antagonista ICI-192605, mind pedig a nátrium-nitroprusszid megszüntette a nagy amplitúdójú vazomóciót (2B. ábra).

3. ábra. (A) A fenilefrinnel előfeszített érgyűrűk csak kismértékű dilatációt hoztak létre 30 µM acetilkolin hatására, míg ugyanezen erek 10 µM az endothelfüggetlen vazodilatátor nátrium-nitroprusszid hatására jól határozott elernyedést mutattak. (B) Az erek inkubációja 1 µM PJ34 poli-(ADPribóz) polimeráz gátlóval nem javította az acetilkolinra kialakuló vazodilatáció mértékét kísérleti körülményeink között. (átlag ± standard hiba; n=5 érminta/csoport; a szórásértékeket csak szignifikancia esetén jelöltük).
Az ér relaxációs képessége és a PARP gátlás hatása Ezen vizsgálatokhoz 5 betegből 14 olyan érgyűrűt választottunk ki, amelyek nem mutattak vazomóciót. Ezek a preparátumok az 1 µM fenilefrin prekontrakciót követően csupán 12,7±10.1% relaxációt mutattak a legmagasabb, 30 µM Ach-ra, de teljesen dilatáltak 10 µM SNP-re, ami endothel-independens vazodilátor (3A. ábra). Amennyiben ezeket a preparátumokat 60 percig inkubáltuk a PARP inhibitor PJ34 1 µM-os oldatában, illetve kontrollként fiziológiás sóoldatban (vehikulum kontroll), az Ach-val kiváltott relaxációs válasz nem különbözött, a maximális vazodiláció 11,4±13,6%, illetve 19,2±12,8% volt (3B. ábra).
Megbeszélés
A bemutatott tanulmányban a graftként alkalmazott arteria thoracica interna szegmensek szövettani és funkcionális tulajdonságait vizsgáltuk, valamint azt, hogy ezeket a paramétereket hogyan befolyásolja a PARP in vitro gátlása. Az ATI szegmensekben ateroszklerózisra utaló elváltozásokat találtunk, a minták diszfunkcionális működést mutattak, valamint SNP, illetve TXA2 szenzitív spasztikus vazomóció alakult ki. A vizsgált ATI szakaszok mindegyikében jelentősen emelkedett oxidatív és nitrozatív stresszre utaló elváltozásokat találtunk, és ezzel együtt a PARP aktivitás is növekedett, de a kísérleti modellünkben a PARP in vitro gátlása nem javított a graftszegmensek csökkent vazodilatációs kapacitásán.
Szövettani vizsgálataink is alátámasztották, hogy az érgyűrűk többségében mérsékelt vagy előrehaladott ateroszklerotikus folyamatok voltak az érfalban, amely megfigyelésünk ellentétben áll azzal az általános feltételezéssel, hogy az ATI jellemzően ellenáll az érelmeszesedésnek (1, 2). A hisztológiai kép megvastagodott intimát, simaizomsejtek bevándorlását, makrofág akkumulációt és habos sejtek képződését mutatta, amelyek az ateroszklerotikus lézióra jellemző elváltozások, tehát a folyamattal ezen erekben is számolni kell.
Az emelkedett oxidatív és nitrozatív stressz fennállását a 3-nitrotirozin (3-NT) és a 4-hidroxinonenal (4-HNE) festődés támasztotta alá. A 3-NT a fehérjék tirozinjának nem enzimatikus nitrálódása során keletkezik, amely az NO és a szuperoxid reakciójából keletkező peroxinitrit jelenlétére utal, ezért megfelelő hosszútávú indikátora a nitrozatív stressz okozta fehérjekárosodásnak. A 4-HNE egy gyakran keletkező terméke az oxidatív stresszben fokozódó lipidperoxidációnak. A 4-HNE elősegíti az apoptózist és a stressz mediálta szignalizációban is szerepet játszik (3). Az emelkedett oxidatív és nitrozatív stressz következtében, amelyek jelenlétét a 3-NT és 4-HNE festődés alátámasztotta, PAR felhalmozódást, tehát PARP aktivációt láttunk valamennyi vizsgált érgyűrűben. Az érgyűrűk vazoaktív funkcionális állapota nagy variabilitást mutatott, még az azonos betegből származó szegmensek között is jelentős különbség volt mérhető. Ezt azzal magyarázhatjuk, hogy az artériák falában az ateroszklerotikus léziók eloszlása nem egyenletes (4). Fenilefrin prekontrakciót követően az erek csak kismértékű, korlátozott vazodilációval válaszoltak még a legnagyobb dózisban beadott acetilkolinra is, ugyanezen erek viszont jól relaxáltak az endothel-independens vazodilátor nátrium-nitroprusszid adását követően. Az Ach-indukálta értágulás beszűkülése, illetve a vazomóció gyakori megjelenése azt jelzi, hogy ezekben az artériákban az endothel funkcionális állapota jelentősen romlott és a vaszkuláris szabályozó mechanizmusok is károsodtak. Az érfal simaizom-elemeinek funkciója inkább megtartott, mivel a legtöbb esetben kontraháltak fenilefrin, illetve K-Krebs hatására, és a NO-donor nátrium-nitroprusszid kiváltotta a relaxációt. Ismereteink szerint ez az első olyan leírás, amely az ITA graftok nagy amplitúdójú vazomóciójáról számol be. A vazomóciót korábban többféle érszakaszon is megfigyelték, és élettani és kórélettani jelentőségét intenzív kutatások próbálják felderíteni (5). A szabálytalan, nagy amplitúdójú vazomóció megjelenése az értónus szabályozásának felborulását jelzi, ami érspazmushoz vezethet, ennek következtében a szöveti vérellátás elégtelenné válhat (6). A nagyobb amplitúdón megjelenő vazomóciós mintázat jelzi, hogy a vaszkuláris reguláció nem képes megfelelően válaszolni a megjelenő stimulusokra. A vazomóció jellegének vizsgálata ígéretes eszköz lehet a diagnosztikában, mivel a vazomóció valószínűleg a hipoxia megjelenése után igen hamar megváltozik (7). Korábbi eredmények szerint a vazokonstriktorok és vazodilatátorok egyensúlyának megbomlása az agyban vazomóciót provokál, amit tromboxán-A2 receptorok közvetítenek (6). Eredményeink, melyeket a TXA2-R antagonista ICI-192605 használatával kaptunk, megerősítik annak lehetőségét, hogy a TXA2- receptorok szerepet játszanak a nagy amplitúdójú spasztikus vazomóció kialakulásában. Annak eldöntésére, hogy az ATI perioperatív spazmusának megjelenését hogyan befolyásolják ezek a receptorok, további vizsgálatok szükségesek. Ezek a vizsgálatok arra is választ adhatnak, hogy CABG során használhatóak-e a TXA2- receptor antagonisták a perioperatív vazospazmus kockázatának csökkentésére.
Köszönetnyilvánítás
A szerzők köszönetüket fejezik ki Bornemissza Ilonának az immunhisztokémiai vizsgálatokban nyújtott segítségéért. Jelen munka az OTKA 47095, 49488, 45933, 049621, ÖAD 66öu5, TÁMOP 4.2.2-08/1/KMR-2008- 0004, Öveges és Bolyai ösztöndíjak támogatásával valósulhatott meg.
Irodalom
- Galbut DL, Traad EA, Dorman MJ, et al.: Seventeenyear experience with bilateral internal mammary artery grafts. Ann Thorac Surg 49: 195-201, 1990.
- Tomizawa Y, Endo M, Nishida H, et al.: Use of arterial grafts for coronary revascularization. Experience of 2987 anastomoses. Jpn J Thorac Cardiovasc Surg 47: 325-329, 1999.
- Brett SJ, Quinlan GJ, Mitchell J, Pepper JR and Evans TW: Production of nitric oxide during surgery involving cardiopulmonary bypass. Crit Care Med 26: 272-278, 1998.
- Sellke FW: Vascular changes after cardiopulmonary bypass and ischemic cardiac arrest: roles of nitric oxide synthase and cyclooxygenase. Braz J Med Biol Res 32: 1345-1352, 1999.
- Sarabu MR, McClung JA, Fass A and Reed GE: Early postoperative spasm in left internal mammary artery bypass grafts. Ann Thorac Surg 44: 199-200, 1987.
- Blanche C and Chaux A: Spasm in mammary artery grafts. Ann Thorac Surg 45: 586, 1988.
- Wendler O, Tscholl D, Huang Q and Schafers HJ: Free flow capacity of skeletonized versus pedicled internal thoracic artery grafts in coronary artery bypass grafts. Eur J Cardiothorac Surg 15: 247-250, 1999.
- Sivalingam S, Levine A and Dunning J: What is the optimal vasodilator for preventing spasm in the left internal mammary artery during coronary arterial bypass grafting? Interact Cardiovasc Thorac Surg 4: 365-371, 2005.
- Yorgancioglu C, Tokmakoglu H, Gunaydin S, Catav Z and Suzer K: An alternative application of sodium nitroprusside to overcome perioperative spasm of the internal thoracic artery. Cardiovasc Surg 9: 64-67, 2001.
- Buyukates M, Kandemir O, Gun BD, Aktunc E and Kurt T: Immunohistochemical comparison of traditional and modified harvesting of the left internal mammary artery. Tex Heart Inst J 34: 290-295, 2007.
- Lacza Z, Herman P, Gorlach C, et al.: NO synthase blockade induces chaotic cerebral vasomotion via activation of thromboxane receptors. Stroke 32: 2609-2614, 2001.
- Parthimos D, Edwards DH and Griffith TM: Comparison of chaotic and sinusoidal vasomotion in the regulation of microvascular flow. Cardiovasc Res 31: 388-399, 1996.
- Ozkan S, Akay TH, Gultekin B, et al.: Atherosclerosis of radial and internal thoracic arteries used in coronary bypass: atherosclerosis in arterial grafts. J Card Surg 22: 385-389, 2007.
- Daugherty A: Mouse models of atherosclerosis. Am J Med Sci 323: 3-10, 2002.
- Laursen JB, Somers M, Kurz S, et al.: Endothelial regulation of vasomotion in apoE-deficient mice: implications for interactions between peroxynitrite and tetrahydrobiopterin. Circulation 103: 1282-1288, 2001.
- Martinet W, Knaapen MW, De Meyer GR, Herman AG and Kockx MM: Elevated levels of oxidative DNA damage and DNA repair enzymes in human atherosclerotic plaques. Circulation 106: 927-932, 2002.
- Virag L and Szabo C: The therapeutic potential of poly(ADP-ribose) polymerase inhibitors. Pharmacol Rev 54: 375-429, 2002.
- Zhang C, Yang J and Jennings LK: Attenuation of neointima formation through the inhibition of DNA repair enzyme PARP-1 in balloon-injured rat carotid artery. Am J Physiol Heart Circ Physiol 287: H659-666, 2004.
- Benko R, Pacher P, Vaslin A, Kollai M and Szabo C: Restoration of the endothelial function in the aortic rings of apolipoprotein E deficient mice by pharmacological inhibition of the nuclear enzyme poly(ADPribose) polymerase. Life Sci 75: 1255-1261, 2004.
- Soriano FG, Pacher P, Mabley J, Liaudet L and Szabo C: Rapid reversal of the diabetic endothelial dysfunction by pharmacological inhibition of poly(ADP-ribose) polymerase. Circ Res 89: 684-691, 2001.
Dr. Kiss Levente
Klinikai Kísérleti Kutató- és Humán Élettani Intézet,
Semmelweis Egyetem,
Tűzoltó utca 37-47.
Budapest, H-1094
Telefon: +36 20 384 5753, FAX: +36 1 334 3162,
E-mail: Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2010/2. 9-15. oldal


