Háttér: A graft suppuratio a helyreállító érműtétek egyik súlyos, magas morbiditási és mortalitási rátával fenyegető szövődménye. A leggyakrabban CT vizsgálat adja a fertőzés diagnosztizálásának alapját; az MRI eredményei az érgraftok gennyedésének vizsgálatában – noha a használata egyre gyakoribb – máig tisztázatlan. Azokban az esetekben, amikor a posztoperatív viszonyok, hegszövet vagy valamilyen ortopédiai implantátum eltorzítja a normális anatómiai viszonyokat, az MRI szerepe megkérdőjelezhető. Az apró fémmaradványok még a fémeszközök eltávolítása után is zavaró artefaktumokat okozhatnak mind a CT, mind az MRI felvételeken. A jelzett leukocyta scan bevált módszer a feltételezett gennyedés vizsgálatában, de a graft közvetlen környezetében lévő gyulladás álpozitív eredményt is adhat. Az FDG-PET egy viszonylag új diagnosztikus lehetőség, melyet az onkológiában és kardiológiában széleskörűen alkalmaznak, a vascularis graftfertőzések esetében azonban a használatáról jóval kevesebb irodalmi adat áll rendelkezésre.
Módszer: A beültetett szintetikus graftok elgennyedésével járó esetek feldolgozása; irodalmi áttekintés az FDG-PET költséghatékonyságára vonatkozóan. A szerzők ismertetik a saját gyakorlatukat a 18-F-FDG-PET alkalmazásáról, két beteg esetismertetésével, feltételezett vagy igazolt graftgennyedés esetén aorto-iliacalis és femoro-poplitealis műtétek után.
Eredmények: Ezt a két esetet vizsgálva a szerzők azt találták, hogy az FDG-PET minden addiginál pontosabb eredményeket szolgáltatott a szintetikus műérbeültetés utáni gennyedésben szenvedő betegek esetén, és a kapott eredmények jól korreláltak a későbbi műtéti diagnózissal. Az FDG-PET akkor is pontosan jelezte a graft suppuratio kiterjedését, amikor más vizsgálatok nem voltak informatívak vagy téves eredményt adtak.
Következtetés: A szerzők feltételezett graftgennyedés esetén ajánlják az FDG-PET használatát, különösen az aorto-iliacalis régióban. Az FDG-PET diagnosztikus pontosságát illetően merülnek fel kérdések és a költsége is igen magas, ezért a PET leginkább ott alkalmazható költséghatékony módon, ahol egy intézetben relatíve sok ilyen vizsgálatot végeznek. Egy prospektív, multicentrikus (lehetőség szerint több ország bevonásával történő) vizsgálat segíthetne eldönteni, hogy az FDG-PET fel tudja-e váltani a CT-t a műér-gennyedés diagnosztikumában.
Kenézy Kórház Egészségügyi Szolgáltató Kft., Szeptikus Sebészeti Osztály, Debrecen
DEOEC Sebészeti Intézet, Érsebészeti Tanszék
PET CT Orvosi Diagnosztikai Kft., Debrecen
DEOEC Nukláris Medicina Intézet
Érbetegségek: 2009/3. 79-84. oldal
KULCSSZAVAK
műér-gennyedés, leukocyta scan, CT, FDG-PET
Bevezetés
A graftfertőzés a rekonstrukciós érműtétek egyik súlyos szövődménye, mely magas morbiditási és mortalitási aránnyal jár (1). A pontos és gyors diagnózis felállítása a klinikai tüneteken és a képalkotó vizsgálatokon nyugszik. A jelenlegi klinikai gyakorlat szerint a CT a választandó módszer a graft suppuratio igazolására: opacitás, graft körüli folyadékgyülem és gázképződés a graftgennyedés általános radiológiai jelei. A CT szenzitivitása - bizonyos esetekben - közelíthet a 100%-hoz, de a kis kiterjedésű fertőzésekben csak korlátozott információt ad. A módszer specifi citását korlátozhatják, módosíthatják a grafton kívüli egyéb fertőzéses gócok is (1-3). Az MRI szerepe a graftgennyedés diagnózisában egyelőre nem tisztázott (1- 4), noha a használata egyre elterjedtebb. Azon esetekben, amikor a műtét utáni állapot, a hegesedés vagy ortopédiai implantátumok jelenléte megzavarja a megszokott anatómiai viszonyokat, az MRI szerepe megkérdőjelezhető. Az apró fémszilánkok még a fémeszközök eltávolítása után is zavaró műtermékeket okozhatnak a CT és MRI felvételeken (5, 6). A jelzett leukocyta scan szintén használatos a feltételezett, korai stádiumú műér-fertőzés felderítésében, azonban a graft közelében lévő fertőzéses gócok álpozitív eredményt adhatnak (1, 4, 7, 8). Ezen vizsgálati módszernek számos hátránya van. Az egyik ilyen, hogy a leukocyták jelölése, újrabeadása és a fertőzés helyére történő vándorlása okozta késedelem. A nagydózisú antibiotikus kezelés a chemotacticus szignálok elvesztését okozhatja, ami megzavarja a vizsgálatot és fals negatív eredményhez vezethet (9). A 18-F-fl uoro-D-deoxyglucose (FDG) a glükóz egyik radiokatív analógja, melyet a gyulladásos sejtek felvesznek és a hexokináz enzimjük révén foszforilálják. Az FDG a foszforiláció után tovább már nem metabolizálódik és a gyulladásos sejtek belsejében marad (10). Az FDG beadása után a gyulladásos folyamat detektálása független a leukocyták migrációjától és eloszlásától. A PET segítségével néhány órán belül eredményhez lehet jutni. A 18-F-FDG egy pozitron-sugárzó radionukleotid, mely eltér a szokványos tracerektól (például 99m-Technécium), mert miután egy közeli elektron megsemmisíti a pozitront, nem egy, hanem két darab ellentétes irányú gamma sugár emittálódik. Emiatt a szignál csak akkor lesz pozitív, ha a két egymással szemben lévő detektorba egyidőben 2 gamma sugár csapódik be. Ennek köszönhetően az FDG PET anatómiai felbontóképessége nagyobb (5mm vs. 15mm) (11).
A szerzők jelen munkájukban ismertetik két esetüket a 18-F-FDG-PET alkalmazásáról feltételezett vagy igazolt graftgennyedés esetén aorto-iliacalis és femoro-poplitealis műtétek után.
Beteganyag és beavatkozások
A vizsgálatban szereplő két beteg írásban beleegyezett az esetükben szóba jövő műtétbe, illetve a tudományos eredmények anonim módon történő közlésébe.
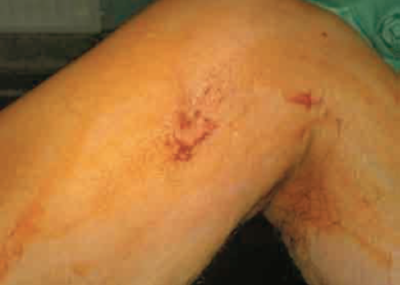
1. ábra.
Femoro-poplitealis Dacron bypass graft beültetés történt 7 évvel korábban.

2. ábra.
Az 1. ábrán szereplő eset 99m-Tc leukocyta scan felvétele a graft mentén fokozott dúsulást jelez.
1. 2004 áprilisában egy 66 éves férfi beteg került felvételre a DEOEC Érsebészeti Tanszékére. Anamnesisében 1997- ben bal oldali, térd fölé vitt femoro-poplitealis bypass műtét szerepelt 8 mm-es Dacron graft felhasználásával. A felvétele előtt a térd fölötti heg váladékozni kezdett (1. ábra). Láztalan volt, a disbasias távolsága nagyjából 200 m. Az elvégzett angiographias vizsgálat graftocclusiot és a jobb a. iliaca communis kritikus szűkületét írta le. Először 99m-Tc leukocyta scan vizsgálatot végeztünk, mely fokozott dúsulást jelzett a graft mentén (2. ábra). Ezt követően FDG-PET felvétel készült (GE 4096 Plus Whole-Body PET Scanner, General Electric Inc.), melynek eredménye az előzővel megegyezett: fokozott FDG felvétel a graft teljes hossza mentén és a graftocutan fi stula régiójában (3. ábra). Ezután a beteget a műér teljes eltávolításával, szívó-öblítő drenázzsal és célzott antibiotikum adásával kezeltük. A műtét során talált kép megfelelt a PET eredményének. A végtag nem vált ischaemiássá, így sürgős re-bypass műtét nem volt szükséges. Két hónap elteltével a jobb a. iliaca szűkülete miatt PTA és stent behelyezés történt, illetve a bal alsóvégtag re-bypass műtétére is sor került (térd alatti gyűrűs ezüstbevonatű graft felhasználásával, mivel alkalmas véna nem állt rendelkezésre).

3. ábra.
Az 1. ábrán szereplő eset FDG-PET képe, melynek eredménye az előzővel megegyezett: a graft teljes hossza mentén és a graftocutan fi stula régiójában fokozott FDG felvétel.
2. 57 éves férfi , akit több alkalommal operáltunk obliteratív érbetegség miatt. Idővel jobb oldali femoralis amputáció és bal oldali exarticulatio elvégzésére kényszerültünk. Az exarticulatio során a korábban beültetett aorto- bifemoralis szintetikus graft bal szárát eltávolítottuk. A beteg 2004 júliusában jelentkezett a femoralis csonk váladékozó sipolyával. A várakozásunkkal ellentétben a leukocyta scan nem mutatott fokozott dúsulást (4. ábra). FDG-PET vizsgálatot végeztünk a helyzet tisztázására, amely a graft teljes hosszában (aortavég és jobb szár) fokozott felvételt mutatott (5. ábra). A teljes graftot eltávolítottuk, az aortát direktben zártuk és célzott antibiotikus kezelést indítottunk. A műtéti lelet ezúttal is pontosan megfelelt az FDG-PET felvétel eredményének. A beteg felépült és haza tudtuk bocsátani.

4. ábra.
99m-Tc leukocyta scan felvétel nem igazolta az aortobifemoralis bypass graft jobb szárának suppurátioját.

5. ábra.
A 4. ábrán szereplő eset FDG-PET vizsgálata, amely a graft teljes hosszában (aortavég és jobb szár) fokozott felvételt mutat.
Megbeszélés
Kétségtelen, hogy a PET az orvostudomány számos ágában felbecsülhetetlen értékű diagnosztikus eszköz. Míg például az onkológiában (12-18), kardiológiában (19) és a neurológiában (20-22) a használata elterjedt, szerepéről az érsebészetben csak kis számú közleményben számoltak be (23-25). Noha a szerzők alig néhány olyan közleményt találtak, amelyek specikfi kusan az FDG-PET diagnosztikus értékével foglalkoztak vascularis graftfertőzések esetén (4, 9), meggyőződésük, hogy a módszer fontos szerepet tölthet be a jövőben ezen kórképek diagnosztikájában, különösen aorta- vagy iliaca-szintű graftgennyedés esetén, ahol a fertőzés jelei nem mindig egyértelműek. Ha a leukocyta scan negatív eredményt ad, de mégis graftgennyedésre van gyanú, a kiegészítő FDG-PET elvégzése ajánlott (második beteg). A jövőben esetleg fel is válthatja a leukocyta scant, mivel az általunk vizsgált betegnél azonos eredményt mutatott a két vizsgálat (első beteg). A rekonstrukciós érműtétek utáni graftfertőzés ritka, de súlyos szövődmény. A fertőzés jelei gyakran nem egyértelműek, és akár évekkel a műtét után jelentkezhetnek. A gyors és pontos diagnózis különösen fontos a műtéti tervfelállításához: a graftgennyedés végtagvesztéshez vezethet, ami igen magas mortalitással jár (1, 26). A végtagokon a gyulladás jelei általában könnyen észrevehetőek, de egy aortagraft gennyedésének tünetei sokszor nem egyértelműek. Aorto-entericus fi stula a betegek 0,5-2%-ában jelentkezik aorta-szintű rekonstrukció után, a mortalitási rátája azonban 85% (27). Ezeknek a szövődményeknek a korai felismerése jelenti az egyik legnagyobb kihívást az érsebészetben. Gastrointestinalis (GI) vérzés - az aorto- entericus fi stulán keresztül -, hasi fájdalom és septicus tünetek jellemzőek leggyakrabban az aortagraft infekciójára. Noha az aortaműtét után jelentkező GI vérzésnek mindig fi gyelmeztető jelnek kell lennie, a két utóbbi tünet nem specifi kus (28). A bőrfelszínhez közeli fertőzésekhez könnyen hozzá lehet férni és a diagnózis is könnyebben felállítható, ellenben a mélyen fekvő gyulladás/gennyedés komoly probléma elé állítja a klinikust. Számos diagnosztikus lehetőség áll rendelkezésre, mint a CT, MRI és a 111-Indium vagy 99m-Technécium jelzett leukocyta scan, azonban az alkalmazásuk esetenként kontraindikált (például MRI fémimplantátumok esetén), vagy az általuk szolgáltatott diagnosztikus adatok korlátozottak.
A 18-F-fl uoro-D-deoxyglucose PET manapság gyakran használt képalkotó eljárás a különböző daganatok kimutatásában. Az FDG a fokozott intracellularis cukormetabolizmus specifi kus jelzőanyaga, mely nemcsak a malignus sejtekben halmozódik fel, hanem a gyulladásos területeken is, de ezért a módszer nem tud különbséget tenni a kétfajta elváltozás között.
A szerzők saját tapasztalata és a PET egyre szélesebb körű alkalmazásáról beszámoló irodalmi hivatkozások alapján nyilvánvaló volt, hogy az FDG-PET számításba jön egy feltételezett graftgennyedés diagnosztikus protokolljában, illetve azon esetekben, amikor egy már ismert suppuratio kiterjedése nem ismert, különösen, ha az előzetes leukocyta scan negatív volt. Két kérdés marad megválaszolatlanul: az FDG-PET felválthatja-e teljes mértékben a CT-t a szintetikus graftok gennyedésének diagnosztikájában, illetve, hogy eléggé költséghatékony-e ahhoz, hogy fi nanszírozás szempontjából is teljes értékű alternatíva legyen?
Számos cikk foglal úgy állást, hogy az első kérdésre a válasz igen (azokban az intézetekben, ahol a PET rendelkezésre áll), illetve, hogy a PET valóban egy költséghatékony diagnosztikus módszer, feltéve, hogy relatíve nagy számban alkalmazzák.
Egyes cikkek arról számolnak be, hogy az FDG-PET diagnosztikus pontossága a CT-hez képest magasabb (16-18, 29), azonban ezt az onkológiában egyértelműen megfi gyelhető "döntő előnyt" hiba lenne feltétel nélkül extrapolálni az érsebészeti fertőzések területére is (18). Másrészt azonban ezt a különbséget érdemes fi gyelembe venni, amikor a leukocyta scan és a CT vizsgálat eredményei ellentmondóak.
A költségeket illetően a különböző, Európából és az Egyesült Államokból származó publikációk eltérő számadatokat közölnek. Egy német vizsgálat a PET költségét 961 euróra, a CT-ét 391 euróra teszi (1999-es árak) (16). Ugyanebben a vizsgálatban az összesített költséghatékonysági mutató (a hatékonyabb diagnosztikus stratégia felára osztva a hatékonyság egységével [ez esetben a még pontosabb stagingben részesült beteg]) a CT esetében 478 euró volt korrekt stagingben részesült betegenként a „nulla diagnosztikával” összehasonlítva, az FDG-PET pedig 3133 eurós felárat jelentett a CT-vel összehasonlítva (16). Egy másik, holland közlemény a PET költségét 736-1488 euróra taksálta a kórházi környezettől és attól függően, hogy az 18-FDG-t meg kellett vásárolni vagy helyileg elő lehetett állítani (13). Amerikai kutatók nagyjából hasonló számokat közöltek és a PET vizsgálat átlagos költségét 900 és 1400 USD közé tették (beleértve a munkabéreket is) (30), míg más publikációk magasabb összegekről számoltak be (1885-1998 USD per FDG-PET vizsgálat) (31). Egy másik amerikai cikk szerint az összesített költséghatékonysági mutató az FDG-PET-et tartalmazó protokoll esetében 8718 USD volt megmentett életévenként, illetve 2505 USD az életminőséghez igazított életévenként (QALY) (15).
Noha számos cikk támogatja szinte egybehangzóan az FDG-PET költséghatékonyságát egy sor alkalmazási területen (12-14, 16, 18, 19, 29-34), a szerzők véleménye szerint a használata az érsebészetben a graftgennyedések diagnosztikájában óvatosabb (de alapvetően pozitív) hozzáállást igényel. Úgy hisszük, hogy a PET-et legalábbis meg kell fontoln a feltételezett graft suppuratiók esetén, illetve, amikor a már kimutatott gennyedés mértéke nem tisztázott. A PET érsebészeti alkalmazását illetően két kulcskérdést találtunk. Az egyik, hogy az onkológiában, onkológiai sebészetben a PET költséghatékonysága abban rejlik, hogy segítségével esetleg fel lehet ismerni olyan okkult metasztázisokat, amelyeket a CT nem mutatott ki, és ezáltal a fölösleges, megterhelő műtétek elkerülhetők (13, 18). Ezzel szemben az érsebészetben a költséghatékonyság abban mutatkozik meg, hogy ha a graft nem teljes hosszában fertőzött, kevésbé kiterjedt műtét végezhető, illetve fordítva, ha a hagyományos módszerekkel nem felfedezett elgennyedt graftot nem távolítjuk el, akkor a beteg végtagját vagy akár az életét veszélyeztetjük, és a későbbiekben még nagyobb, költségesebb műtét válik szükségessé.
A másik kulcskérdés a PET vizsgálatok kapacitása. Több közlemény (14, 15, 30, 31) álláspontjával megegyezően úgy hisszük, hogy amint a PET szélesebb körben meghonosodik az érsebészetben, a nagyszámú PET vizsgálat révén az egyes vizsgálatok relatív költsége lecsökken, vagyis ezen megfontolás alapján a minél gyakoribb alkalmazása volna indokolt.
A szintetikus grafttal végzett bypass-műtétek utáni suppuratio ritka szövődmény, ezért a szerzők véleménye az, hogy csakis egy multicentrikus, prospektív tanulmány (lehetőség szerint Európa több országának bevonásával) tudna választ adni arra a kérdésre, hogy az FDG-PET válhat- e ezen betegcsoport elsőként választandó diagnosztikus eszközévé. A szerzők örömmel fogadják minden érdeklődő intézmény csatlakozását egy ilyen tanulmány felállításához.
Irodalom
- Orton DF, LeVeen RF, Saigh JA et al. Aortic prosthetic graft infections: radiologic manifestations and implications for management. Radiographics 2000;20:977-993.
- Vogelzang RL, Limpert JD, Yao JS. Detection of prosthetic vascular complications: comparison of CT and angiography. AJR Am J Roentgenol 1987;148:819-823.
- Ramo OJ, Vorne M, Lantto E et al. Postoperative graft incorporation after aortic reconstruction-comparison between computerized tomography and Tc-99m-HMPAO labeled leukocyte imaging. Eur J Vasc Surg 1993;7:122-128.
- Keidar Z, Engel A, Nitecki S et al. PET/CT using 2-Deoxy-2-(18F)Fluoro-D-Glucose for the Evaluation of Suspected Infected Vascular Graft. Mol Imaging Bio.2003;5:23-25
- ChackoTK, Zhuang H, Nakhoda KZ et al. Application of fl uorodeoxyglucose positron emission tomography in the diagnosis of infection. Nucl Med Commun 2003;24:615- 624.
- Kaim A, Ledermann HP, Bongartz G et al. Chronic posttraumatic osteomyelitis of the lower extremity: comparison of magnetic resonance imaging and combined bone scintigraphy/ immunoscintigraphy with radiolabelled monoclonal antigranulocyte antibodies. Skeletal Radiol 2000;29:378- 386.
- Williamson MR, Boyd CM, Read RC et al. 111 In-labeled leukocytes detection of prosthetic vascular graft infection. AJR Am J Roentgenol 1986;147:173-176.
- Liberatore M, Iurilli AP, Ponzo F et al. Clinical usefulness of technetium-99m-HMPAO-labeled leukocyte scan in prosthetic vascular graft infection. J Nucl Med 1998;39:875-879.
- Krupnick AS, Lombardi JV, Engels FH et al. 18-Fluorodeoxyglucose Positron Emission Tomography as a Novel Imaging tool for the Diagnosis of Aortoenteric fi stula and Aortic Graft Infection. Vasc Endovascular Surg 2003;37(5): 363-366.
- Pauwels EK, Sturm EJ, Bombardieri E et al. Positron emission tomography with 18-f-fl uorodeoxyglucose. Part I. Biochemical uptake mechanism and its implication for clinical studies. J Cancer Res Clin Oncol 2000;126:549-559.
- Winter FD, Vogelaers D, Gemmel F et al. Promising role of 18-f-fl uoro-d-deoxyglucose positron emission tomography in clinical infectious diseases. Eur J Clin Microbiol Infect Dis 2002;21:247-257.
- Sloka JS, Hollett PD, Mathews M. Cost-effectiveness of positron emission tomography for non-small cell lung carcinoma in Canada. Med Sci Monit. 2004;10:73-80.
- Verboom P et al. The PLUS Study Group. Cost-effectiveness of FDG-PET in staging non-small cell lung cancer: the PLUS study. Eur J Nucl Med & Mol Imaging 2003;30: 1444-9.
- Keith CJ, Miles KA, Griffi ths MR, Wong D, Pitman AG, Hicks RJ. Solitary pulmonary nodules: accuracy and cost-effectiveness of sodium iodide FDG-PET using Australian data. Eur J Nucl Med & Mol Imaging 2002;29:1016-23.
- Hollenbeak CS, Lowe VJ, Stack BC Jr. The cost-effectiveness of fl uorodeoxyglucose 18-F positron emission tomography in the N0 neck. Cancer 2001;92:2341-8.
- Klose T, Leidl R, Buchmann I, brambs HJ, Reske SN. Primary staging of lymphomas: cost-effectiveness of FDG-PET versus computed tomography.
- Imdahl A, Reinhardt MJ, Nitzsche EU et al. Impact of 18F-FDG-positron emission tomography for decision making in colorectal cancer recurrences. Langenbecks Arch Surg 200;385:129-34.
- Valk PE, Pounds TR, Tesar RD, Hopkins DM, Haseman MK. Cost-effectiveness of PET imaging in Clinical Oncology. Nucl Med &Biol 1996;23:737-43.
- Beanlands R et al. Parr-2 Investigators. Evaluation of outcome and cost-effectiveness using an FDG-PET guided approach to management of patients with coronary disease and severe left ventricular dysfunction (PARR-2); rationale, design and methods. Contr Clin Trials 2003;24:776-94.
- Tai YF, Piccini P. Applications of positron emission tomography (PET) in neurology. J Neur, Neurosurg & Psych 2004;75:669-76.
- McMahon PM, Araki SS, Sandberg EA, Neumann PJ, Gazelle GS. Cost-effectiveness of PET in the diagnosis of Alzheimer disease. Radiology 2003;228:515-22.
- Silverman DH, Gambhir SS, Huang HW & al. Evaluating early dementia with and without assessment of regional cerebral metabolism by PET: a comparison of predicted costs and benefi ts. J Nucl Med 2002;43:253-66.
- Marwick TH, Shan K, Go Rt, MacIntyre WJ, Lauer MS. Use of positron emission tomography for prediction of perioperative and late cardiac events before vascular surgery. Am Heart J 1995;130:1196-1202.
- Tenjin H, Ueda S, Mizukawa N et al. An evaluation of cerebral blood fl ow and metabolism of reconstructive vascular surgery using positron emission tomography – a report of 4 cases (Japanese) Shinkei-Brain & Nerve 1991;43:882-7.
- Cone JB. Positron emission tomography: new analytic tool for vascular disease. J Vasc Surg 1985;2:360-6.
- Seeger JM. Management of patients with prosthetic vascular graft infection. Am Surg 2000;66:166-177.
- Peck JJ, Eidemiller LR. Aortoenteric fi stulas. Arch Surg 11992;27:1191-1193, discussion 1193-1194.
- Pipinos II, Carr JA, Haithcock BE et al. Secondary aorto- enteric fi stula. Ann Vasc Surg 2000;14:688-696.
- Bongers V, Hobbelink MG, van Rijk PP, Hordijk GJ. Cost-effectiveness of dual-head 18F-fl uorodeoxyglucose PET for the detection of recurrent laryngeal cancer. Canc Bioth & Radiopharm 2002;17:303-6.
- Keppler JS, Conti PS. A cost analysis of positron emission tomography. Am J Roentg 2001;177:31-40.
- Berger M, Gould MK, Barnett PG. The cost of positron emission tomography in six United States Veterans Affairs Hospitals and two academic medical centers. Am J Roentg 2003;181:359-65.
- Tron L. Positron emission tomography and the Hungarian PET program. Orv Hetil 2002;143(21 Suppl 3):1235-40. (in Hungarian)
- Bradbury I, Facey K, Laking G, Sharp P. Investing in new technology: the PET experience. Br J Canc 2003;89:224-7.
- Lottes G, Gorschluter P, Kuwert T, Adam D, Schober O. Costs of F-18-FDG PET: experience with a satellite concept. Nucl Med 1998;37:159-64; discussion 165.
Dr. Tóth Csaba
Kenézy Kórház Egészségügyi Szolgáltató Kft.,
Szeptikus Sebészeti Osztály, Debrecen
Érbetegségek: 2009/3. 79-84. oldal


