A hevenyen elzáródott verőerek érsebészeti rekanalizációja mára gyakorlatilag megoldott, a keringés helyreállításáért azonban időnként igen nagy árat kell fizetni. Az iszkémia-reperfúzió során kaszkádszerű patofiziológiai folyamatok sorozata indul el, amelyek végül sejthalálhoz vezethetnek, veszélyeztetve az egész szervezet integritását. A reperfúzió során meglepő módon tovább károsodhatnak a még életben maradt sejtek, előáll az úgynevezett "oxigén paradoxon", amelynek kialakulásában az oxigén szabadgyökök jelentős szereppel bírnak. A szerzők a máig jelentős diagnosztikai és terápiás gondot okozó kérdéskört többféle aspektusból vizsgálták. Vizsgálataikat kiterjesztették az iszkémiás harántcsíkolt izom fény- és elektronmikroszkópos elemzésére, az iszkélmia-reperfúzió során létrejövő szabadgyök és antioxidáns védelmi rendszer változásaira, a revaszkularizációs szindróma szisztémás hatásainak kialakulásában döntő szerepet játszó fehérvérsejtek aktivációját jelző CD 11a és 18 sejtfelszíni adhéziós molekulák követésére. A fasciotomia indikálása során a szubjektív elemek kiküszöbölésére a tibialis anterior rekesz direkt nyomásmérését alkalmazzák kiterjedten.
Reményeik szerint a fenti több irányú megközelítés a klasszikus biokémiai monitorizálás mellett segít a folyamat jobb megértésében, amelynek terápiás hozadéka is megnyilvánul majd az eredményekben.
Érbetegségek: 2004/4. 115-121. oldal
KULCSSZAVAK
kritikus végtagiszkémia, reperfúziós károsodás, oxigén szabadgyökök, kompartment szindróma
Bevezetés
Az érsebészeti osztályok tevékenységében mindennapos kihívás az akut verőérelzáródás miatti keringéshelyreállítás. A fenyegető végtagiszkémia hátterében zömmel embolizáció, akut artériás trombózis áll, vagy kis százalékban érsérülés is felelős lehet a heveny keringészavarért. Az embolektomiákat, illetve az akut rekonstrukciókat követően a gyógyulás mind funkcionálisan, mind morfológiailag rendszerint teljes. Az esetek mintegy két-három százalékában (főleg az előrehaladott iszkémiák esetében) a sikeres rekanalizáció ellenére az egész szervezetet érintő "crush syndroma"-szerű tünetegyüttes alakul ki. Utóbbit az érsebészeti irodalomban először Henry Haimovici 1960-ban írta le és "revaszkularizúciós szindrómaként" ismert. Az elnevezés szinonimájaként az angol irodalomban gyakran használatos a "myonephropatic-metabolic syndrome", amely tömören utal a revaszkularizációt követő patológiai történésekre (1). A klinikai tünetek pregnánsak:
- súlyos végtagfájdalom extrém ödémával,
- szöveti iszkémia,
- izomrigiditás.
A fentiekhez metabolikus acidozis, hyperkalaemia, myoglobinaemia, myoglobinuria, tubularis nephropathia, ARDS társul. Az egész folyamat középpontjában a harántcsíkolt izomzat destrukciója áll. Klinikai megfigyelés, hogy minél nagyobb izomtömeget érint az iszkémia, annál nagyobb a valószínűsége a revaszkularizációs szindróma kialakulásának. Amikor a szövet vérellátása megszakad, biokémiai folyamatok sorozata indul el, amely celluláris diszfunkcióhoz, celluláris és szöveti ödémához, reverzibilis, majd irreverzibilis károsodáshoz vezet. Az iszkémiás sérülés lényege, hogy csökken az ionhomeosztázis fenntartásához szükséges energia, károsodnak a membránfunkciók és az enzimrendszer zavara végül sejthalálhoz vezet. A mikrocirkuláció és a homeosztázis finom egyensúlya megbomlik.
Az iszkémia következtében anaerob folyamatok indulnak el az izomszövetben, amelyek következtében savanyú metabolitok szaporodnak fel, acidozis alakul ki. A membránfunkciók sérülésének következtében többek között a Na-Pumpa működése is zavart szenved. Ennek következményeként Na áramlik a sejtbe, amely vizet visz magával, ezzel egyidejúleg a K felé áramlik. A Na és a víz intracelluláris duzzadáshoz vezet. A végtagi zárt fasciarekeszekben a nyomás megnövekszik (nagyobb lesz, mint 40 Hgmm), és ez szekunder artériás kompresszióhoz vezet. Így tehát a szabaddá tett érpálya ellenére az oxigéntranszport továbbra is zavart. Számos esetben előfordult, hogy sikeres embolektomiát követően, nyitott érpálya mellett a súlyos, generalizált, életet veszélyeztető tünetek miatt amputációra kényszerültünk (2, 3, 4).
Beteganyag, módszer
Osztályunkon (Pécsi Tudományegyetem OEC, ÁOK Sebészeti Tanszék, Baranya Megyei Kórház) 1998-2004 között 378 műtéti beavatkozás történt akut verőérbetegség következtében. 195 esetben tiszta embólia miatt Fogarty szerinti embolektomiát végeztünk.
A fennmaradó esetekben az akut verőérelzáródás oka artériás trombózis volt. Utóbbi esetben a betegek egy részében konzervatív terápia hatására volt idő hagyományos angiográfia elvégzésére; amelyet aztán követett a definitív érrekonstrukció.
A betegek másik csoportjában azonnali műtétre kényszerültünk. Itt nagy segítségünkre van az intraoperatív angiográfiás lehetőség (DSA), amelynek birtokában nem csupán a trombektomia végezhető el, hanem végleges rekonstruktív ellátást nyújthatunk.
A műtéti eredményeket befolyásoló tényezők:
- az elzáródás időtartama,
- az iszkémia súlyossága, azaz
- enyhe (Vollmar-féle "felfér iszkémia),
- súlyos ("kék" iszkémia, az izomzat érzékeny, érzés-, mozgászavar),
- irreverzibilis elváltozás (izomrigiditás, bullák, gangré na),
- az érrendszer állapota,
- az iszkémiás terület nagysága.
A sikeres helyreállító műtéteket követően az összhalálozás 14%-os volt. A bifurcatio vagy biiliacalis embolektomiákat követően a mortalitás megközelítette az 50%-ot! 13 betegünknél alakult ki súlyos revaszkularizációs szindróma, amelynek következtében intenzív kezelés ellenére is 7 beteget elvesztettünk.
Az iszkémia-reperfúzió hagyományos monitorizálási lehetőségei
1. A vérnyomás regisztrálása helyreállítás után:
Minél nagyobb az iszkémiás terület reperfúziója, annál valószínűbb a vérnyomásesés, shock kialakulása (tourniquet shock, declamping phenomen). Kialakulásában szerepet játszik a metabolikus acidozis, hypovolémia, csökkent perifériás rezisztencia, a hypoxiás szövetekbő1 felszabaduló vazodilatátor anyagok.
2. A szérum kálium-szint változásai:
A hyperkalaemia közvetlen életet veszélyeztető állapot (ingerületvezetési zavarok, myokardium kontraktilitás csökkenése). A laboratóriumi meghatározásnál is gyorsabban jelzi a se-K emelkedését az EKG-görbe. Acidozis, hypoxia potenciálja a K intoxikációt. A 7 maeq/l feletti K-szint életveszélyes állapot.
3. Az artériás vér ph-változás regisztrálása a helyreállítás alatt:
A keringés helyreállítását követően a mért ph szignifikánsan csökken. A metabolikus acidozis önmagában is káros, de a ph-csökkenés számos életfontosságú enzim működését gyengíti.
4. Veseműködési zavarok regisztrálása:
- vizelet mennyiségének mérése,
- CN, se-kreatinin emelkedés a helyreállítás után, - myoglobinuria.
A szérum myoglobin-szint változását osztályunkon AxSym készülékkel, MEIA módszerrel végezzük. A veseműködési zavarért a helyreállítást követően kialakuló vérnyomásesés és az esetleges myoglobin kicsapódás felelős (5).
5. Szérum enzim-változások követése:
Az iszkémiás sejtmembránkárosodás vagy sejtpusztulás következtében az enzimkészlet kilép az extracelluláris térbe, megjelenik a keringésben és mérhetővé válik. A CK, GOT, GPT már az iszkémiás periódusban is emelkednek. Az LDH-szint emelkedése csak a rekanalizációt követően volt megfigyelhető (6).
6. Pulmonális mikroembolizáció:
Reperfúziót követően jön létre károsodott keringés mellett. A RES és a fibrinolyticus rendszer diszfunkciója miatt az embolusok eliminációja csökken.
A kialakult revaszkularizációs szindrómában a terápia komplex:
- a hyperkalaemia elleni küzdelem (glucose + inzulin adása, ioncserélő gyanta adása),
- a metabolikus acidozis megszüntetése (bicarbonat, TRIS puffer adása stb.),
- akut urémia esetén peritonealis, illetve haemodialízis), - ARDS esetén gépi lélegeztetés,
- fasciotomia (késői vagy elkésett rekanalizációt követően),
- végtagamputáció a tünetek progressziója esetén.
A szabadgyökök szerepe a reperfúziós károsodásban
A hypoxiás és reoxigenált szövetekben keletkező károsodások különböznek a tartós iszkémia okozta sejtkárosodástól. Az iszkémia alatt az idő függvényében károsodott szövetekben a reperfúzió során heveny sejtduzzadást, kontrakciós sávok megjelenését és fokozott intracelluláris Ca2+ ionbeáramlást tapasztaltak, amelyek végül sejtnekrózishoz vezettek. Az iszkémia alatt károsodott harántcsíkolt izom reperfúziót követően funkcionális zavarokat mutat, mint az úgynevezett átmeneti kontrakciós zavar (stunning).
Így a hypoxiás szövetek keringésének helyreállítása kétélű fegyver a kezünkben: bár a véráramlás helyreállítása védelmet nyújt a további irreverzibilis iszkémiás károsodástól, az ugyanakkor kialakuló reperfúziós károsodások sokszorosíthatják a fatális szövődmények kialakulását. A reperfúziós károsodás (reperfusion injury) alapvető oka az, hogy a korai reperfúzió alatt keletkező oxigén szabadgyökök mennyisége meghaladja az endogén antioxidáns rendszer (szuperoxiddizmutáz, kataláz, glutation peroxidáz, scavangerek) kapacitását, és kialakul az oxidatív stressz. Ennek ismert celluláris következményei: a membrán lipid-peroxidáció fokozódása, membrán fehérje szerkezeti elváltozások, különböző ioncsatornák és receptorok károsodása, valamint DNS denaturáció. Mindezen patológiás elváltozások az intracelluláris ion homeosztázis megváltozásához, a sejtmembrán permeabilitás fokozódásához, a kálciumion kontrollálatlan intracelluláris beáramlásához és sejthalálhoz vezetnek.
A szuperoxid anion a fiziológiás respiráció során a felhasznált oxigén legalább 0,4-4%-ából keletkező, igen rövid életű szabadgyök. Legnagyobb mennyiségben mégis a fehérvérsejtek aktiválódása során kerül az extracelluláris térbe, a NADPH oxidáz enzim működése révén.
A teljes vérben lévő fehérvérsejtek szabadgyök termelését luminometriás módszerrel vizsgáltuk (Chrono-Log lumino-aggregometer). A szuperoxid anion képződést phorboll2-myristil-13 acetáttal (PMA), a hatékony PKC és NADPH oxidáz aktiváló vegyülettel serkentettük. A keletkezett szabadgyököt luminol hozzáadásával tettük mérhetővé. A szabadgyök méréssel párhuzamosan az antioxidáns védelmi rendszer tagjai közül a szuperoxid dizmutáz (SOD) aktivitását és a redukált glutathion (GSH) mennyiségét mértük. A lipidperoxidáció mértékét a malondialdehid (MDA) mennyiségével jellemeztük.
A szuperoxid anion mennyisége már a műtét előtt levett mintákban is duplája volt az egységnyi fehérvérsejt-számra vonatkoztatott normálértéknek (10-50 AU 104 sejtre), és ez az érték az egyhetes megfigyelési idő alatt sem érte el a fiziológiás értéket. Ez a jelenség részben a megemelkedett fehérvérsejt-számmal magyarázható, másfelől azonban a megnövekedett szabadgyök produkcióban a fehérvérsejtek aktivitásának fokozódása is szerepet játszik, hiszen a fehérvérsejtek száma csak kis mértékű emelkedést mutat. Ezt támasztja alá az a tény is, hogy a szabadgyök termelés indukációja (PMA hozzáadása) és a szuperoxid produkció megindulása között eltelt idő ("lag time") már az általunk vizsgált perifériás érbetegek műtét előtt levett mintáiban is rövidebb volt, mint az egészséges személyeken mért normál érték (150-200 sec). A reperfúzió során a kiindulási értékhez képest további csökkenést tapasztaltunk. A műtét másnapján visszaállt a műtét előtti érték (1. ábra).
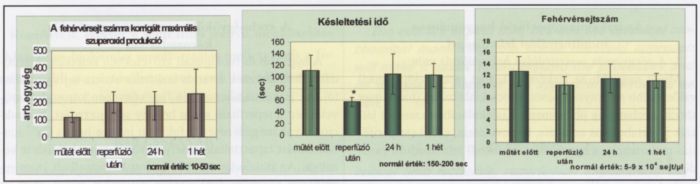
1. ábra.
A PMA-val indukált szabadgyök produkció és a fehérvérsejtszám.
Az általunk vizsgált valamennyi beteg (n=7) a műtét előtt megfelelő GSH- és SOD-szinttel rendelkezett a betegségből eredő megemelkedett számú és aktivitású fehérvérsejtből származó fokozott szabadgyök mennyiség közömbösítéséhez. A műtét után és az azt követő napon mért szignifikáns változások egy hét múlva rendeződtek. Az MDAszinttel jellemzett lipidperoxidáció a fiziológiás tartományban maradt az egyhetes periódus alatt (2. ábra). Vizsgálataink azt mutatták, hogy azok a betegek, akiknek az antioxidáns enzim értékei a fiziológiás tartományon belül vannak, jó eséllyel képesek a műtéttel járó stresszhatások közömbösítésére. Azoknál a betegeknél viszont, akiknek az antioxidáns kapacitása csökkent, vagy krónikus betegség miatt kimerült, nagyobb a kockázata az antioxidáns-prooxidáns egyensúly felborulásának, következményesen a szisztémás szövődmények - reperfúziós szindróma - kialakulásának is. Ezen veszélyeztetett betegeknél javasolt az antioxidáns státusz preoperatív laboratóriumi mérése, szükség esetén terápiás támogatása.
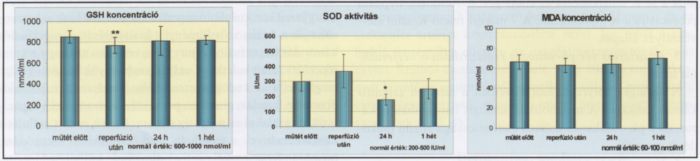
2. ábra.
A SOD, a redukált glutathion és a malondialdehid jellemző értékei a vizsgálat során.
A reperfúziós szindróma szisztémás hatásainak kialakulásában döntő szerepük van a fehérvérsejteknek. Az iszkémia-reperfúzió által érintett szövetekben aktiválódó leukociták bejutnak a keringésbe, majd különböző szervekben (tüdő, vese) kitapadnak és gyulladásos folyamatokat generálnak (ARDS, tubuláris nefropátia, SIRS). Aktivációjuk során a fehérvérsejtek különböző, a sejttípusra specifikus sejtfelszíni adhéziós molekulákat expresszálnak, amelyek a célszerv endothelén lévő receptoraikhoz kapcsolódnak, ezzel irányítva a sejtek kitapadását és átjutását az endothelen. Az adhéziós molekulák tanulmányozása az elmúlt években a biológiai kutatások egyik legintenzívebben vizsgált területévé vált, azonban a reperfúziós szindrómában betöltött szerepük pontos mechanizmusa máig tisztázatlan. Akut verőérelzáródás miatti revaszkularizációs műtéten átesett betegeinknél vizsgáltuk a granulociták aktivációját jelző CD I la és 18 sejtfelszíni adhéziós molekula expresszióját a reperfúziótól eltelt idő függvényében. Eredményeink azt mutatták, hogy a műtét után közvetlenül lecsökken, majd fokozatosan egészen a 7. posztoperációs napig emelkedik az aktivált leukociták száma (3. ábra), amely azt mutatja, hogy a szisztémás gyulladásos folyamatok kockázata a műtétet követően a hetedik napig fokozódik.
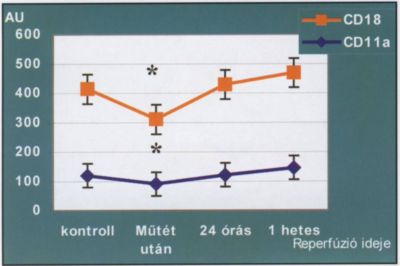
3. ábra.
Granulociták CD18 és 11a sejtfelszíni adhéziós molekulák mennyiségének változása a revaszkularizációs műtétet követő hét napban (* = p <0,05).
A Harántcsíkolt izomszövet strukturális és ultrastrukturális változásai
A heveny végtagiszkémiában a végtag sorsát az izmok állapota dönti el. Az iszkémia kezdetén csak kevés elváltozás látható (a szubszarkolemmáris magvak duzzadtak, lekerekítettek). Az iszkémiás idő előrehaladtával az izomrostok egy izomkötegen belül is különbséget mutatnak. A sejtmagok duzzanatán kívül a fibrilláris állomány hasadozottsága is megfigyelhető, másutt vakuolás degeneráció látható. Ismét másutt kiterjedt nekrózis észlelhető. A reperfúzió során az ödéma a vezető tünet, perikapilláris lobsejtes beszűrődéssel, fokozott makrofág sejtszaporulattal, amely a korai reoperációra utal (10, 11).
Módszerek
A vizsgálati minta a m. tibialis anteriorból származik, amelyet a fasciotomia során nyerünk. Folyékony nitrogénben izopentáton keresztül gyorsfagyasztást alkalmaztunk az izomminták feldolgozásakor. Ezt követően 10 mikronos metszeteken végeztük cl a következő festési eljárásokat: hematoxilin-eosin, PAS, oil-red, módosított Gömöri- és enzimhisztokémiai (ATP-aze, savas foszfatáz, NADH, SDH, COX) festéseket alkalmaztunk. A minta másik részét glutáraldehides fixálás és műgyantába ágyazást követően elektronmikroszkópos vizsgálatnak vetettük alá.
Eredmények
Három beteg mintája került feldolgozásra. Mindegyik esetben a fénymikroszkópos vizsgálat myopátiás elváltozásokat mutatott. Jellemzőik: közepes fokú rostméret-változás, elszórtan atrófiás rostok, I. rost predominancia, II/b. rostarány csökkenése, helyenként mérsékelt kötőszövet szaporulat volt megfigyelhető. Mindegyik esetben előfordultak töredezett vörös rostok (RRF), amelyek kóros mitokondriumok felszaporodását tükrözték. Ezek száma változó, 1-5% közötti volt. A töredezett vörös rostokban a succinat dehidrogenáz (SDH) és a citokróm oxidáz (COX) aktivitás fokozott volt (4. és 5. ábra).
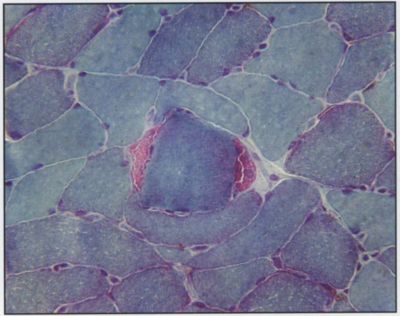
4. ábra.
Hisztológiai kép: mGT festéssel közepes fokú rostméret-változás látható, pirosra festődő ragged red rosttal (RRF), (negyvenszeres nagyítás).
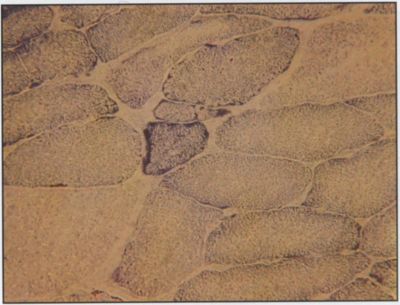
5. ábra.
Hisztológiai kép: SDH festéssel a ragged red rost sötétkékre festődik, (negyvenszeres nagyítással).
Az elektronmikroszkópos vizsgálat változó súlyosságú, nem specifikus eltéréseket mutatott. Két enyhébb esetben a miofibrillumok mérsékelt fokú károsodása mellett kifejezett szubszarkolemmáris mitokondrium és mérsékelt fokú glikogén szaporulat volt látható. Egy esetben a fibrillumok súlyos károsodása mellett extrém mennyiségű, súlyosan károsodott (duzzadt, széttöredezett krisztarendszer) mitokondriumokat láttunk, amelyet a lipidek és a glikogén szaporulata is kísért (6. és 7. ábra) (12).
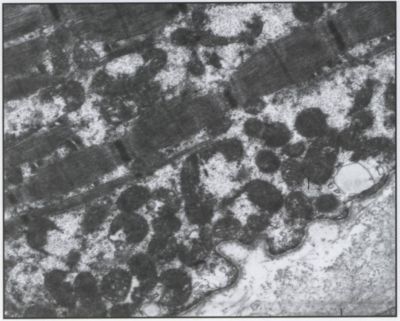
6. ábra.
Elektronmikroszkópos képen kisfokú rostkárosodás, szubszarkolemmáris mitokondrium szaporulattal, néhány helyen mitokondrium duzzanattal. (Hétezerötszás nagyítás.)
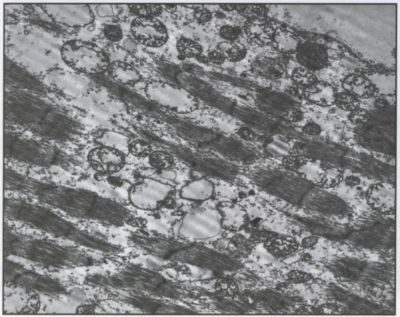
7. ábra.
Elektronmikroszkópos feldolgozás során súlyos fokú fibrillum károsodás figyelhető meg, kifejezett mitokondrium duzzadással, a kriszták csaknem teljes destrukciójával, néhány lipid vakuolummal. (Tizenötezerszeres nagyítás.)
Komparment szindroma - nyomásmérés a fasciarekeszekbcn, fasciotomia
A revaszkularizált végtagban reaktív hyperaemia lép fel, amely a kapillárisok és az AV-összeköttetések tágulata következtében alakul ki. Ez az anaerob anyagcseretermékekkel együtt a kapilláris-permeabilitás fokozódásához és nagyfokú ödémához vezet, amelynek következtében hypovolaemia alakulhat ki. A zárt fasciarekeszben fellépő súlyos izom-ödéma először a kiserek, majd az átjárhatóvá tett értörzs kompressziójához és újbóli iszkémiához vezethet (13). A fasciotomia további indikációja meglehetősen individuális volt. Általában a kései rekanalizációs ödéma, izomrigiditás esetén javasolták az izomrekeszek felnyitását (8. ábra).
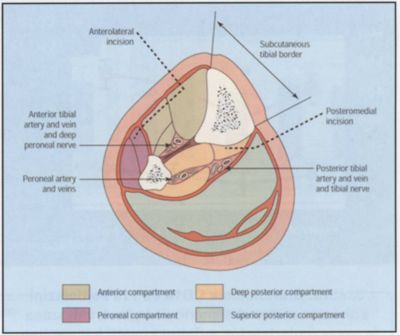
8. ábra.
A fasciarekeszek anatómiai sémája, valamint a javasolt incíziós behatolások.
Osztályunkon lehetőség van direkt rekesznyomás mérésére. Az eljárás egyszerű, tetszés szerint reprodukálható, gyakorlatilag fájdalmatlan. A készülék portábilis. A kritikus 40 hgmm-es nyomás meghaladása esetén minden esetben elvégezzük a minden rekeszre kiterjedő félig zárt fasciotomiát (9. ábra), (14).
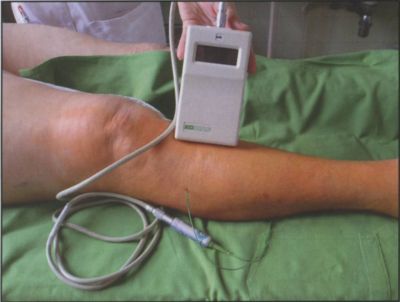
9. ábra.
Nyomásmérés a musculus tibialis anterior fasciarekeszben KODIAG mérőműszerrel.
Összefoglalás
A revaszkularizációs szindróma igen súlyos, nagy mortalitással járó elváltozás, ezért mielőbbi felismerése és megfelelő kezelése rendkívül fontos. A korai rekanalizáció változatlanul a legfontosabb a tünetek kialakulásának meggátlásában. A folyamatos biokémiai és képalkotó monitorizálás és az anyagcsere elváltozások korrekciója elengedhetetlen. Emelkedett rekesznyomás esetén fasciotomia végzendő. A kialakult revaszkulációs szindrómában terápiás eredménytelenség esetén az amputációval késlekedni nem szabad.
Munkánkban a klasszikus metabolikus elváltozások regisztrálása és analizálása mellett a harántcsíkolt izomszövetben létrejövő strukturális és ultrastrukturális elváltozásokat is vizsgáltuk. A szabadgyök-reakciók hatásának vizsgálata, az antioxidáns védekező mechanizmusok követése és befolyásolása reményeink szerint közelebb visz a reperfúzió során létrejövő öngerjesztő, paradox reakciók megértéséhez.
Irodalom
- Haimovici, H.: Myopathic-nephrotic-metabolic syndrome and massive acute arterial occlusions. Arch. Surg. 1973., 106:628.
- Blaisdell, F. W.: The pathophysiology of skeletal muscle ischemia and the reperfusion syndrome: a review. Cardiovasc. Surg. 2002. december, 10(6):620-630.
- Engledow, A. H., Crinnion, J. N.: Acute lower limb ischemia. Hosp. Med. 2002. július, 63(7):412-415.
- Haimovici, H.: Arterial embolism with acute massive ischaemic myopathy and myoglobinuria. Surgery 1960., 47:739747.
- Morsey, H., Aslam, M., Standfield, N.: Patients with critical ischemia of the lower limb are at risk of developing kidney dysfunction. Am. J. Surg. 2003. április, 185(4):360363.
- Mondek, P., Sefranek, V., Tonika, J., Pechan, 1., Silvanova, E., Nosal, R., Slysko, R.: Regional biochemical and hematologic changes in patients after revascularization of the lower extremities in ischemia of the extremities. Rozhl. Chir. 2002. május, 81(5):265-270.
- Kloner, R. A., Pryzyklenk, K., Whittaker, P.: Deleterious effects of oxygen free radicals in ischemia reperfusion. Circulation 1989., 80:1115-1127.
- Stevens, J. B. et al.: Induction of superoxide dismutase by oxygen in neonatal rat lung. J. Biol. Chem. 1977., 252:3509.
- Richter, H. E., Loewen, P. E. et al.: Induction of catalase in Escherichia coli by ascorbic acid involves hydruge pero xide. Biochem.-Biophys. Res. Commun. 1981., 100:10391046.
- Hayashi, M., Hirose, H., Sasaki, E., Senga, S., Murakawa, S., Mori, Y., Furusawa, Y., Banodo, M.: Evaluation of ischemic damage in the skeletal muscle with the use of electrical properties. J. Surg. Res. 1998. december, 80(2):266271.
- Rácz 1. B., Illyés G., Sarkadi L., Hamar J.: The functional and morphological damage of ischemic reperfused skeletal muscle. Eur. Surg. Res. 1997., 29:254-263.
- Santavirta, S., Luoma, A., Arstila, A. U.: Ultrastructural changes in striated muscle after experimental tourniquet ischemia and short reflow. Eur. Surg. Res. 1978., 10:415424.
- Tiwari, A., Haq, A. I., Myint, F., Hamilton, G.: Acute compartment syndromes. Br. J. Surg. 2002., 89:397-412.
- Whitesides Jr., T. E., Haney, T. C., Morimoto, K., Harada, H.: Tissue pressure measurements as a determinant for the need of fasciotomy. Clin. Orthop. 1975., 113:43-51.
Dr. Arató Endre
Pécsi Tudományegyetem OEC,
ÁOK Sebészeti Tanszék,
Baranya Megyei Kórház,
7623 Pécs, Rákóczi út 2.
Érbetegségek: 2004/4. 115-121. oldal


