Munkánkban az ér- és szívsebészet egyik legfontosabb biológiai pótló anyagát a humán saphena magnát vettük górcső alá, annak is biomechanikai változásait, eltéréseit vizsgáltuk különböző tárolási feltételek és időtartam után. A kísérletekhez összesen 32 betegtől származó 72 véna szegmentumot használtunk fel, amit a tárolás alapján 8 csoportra osztottunk: (1) friss, (2) 4°C nKR-1 hetes, (3) 4°C nKR-2 hetes, (4) 4°C X-VIVO-1 hetes, (5) 4°C X-VIVO-2 hetes, (6) 4°C X-VIVO-3 hetes, (7) 4°C X-VIVO-4 hetes, (8) mély - fagyasztott tárolás csoportra. A nKR (normál Krebs Ringer) oldatban tárolt minták egy hét után elveszítették aktív és passzív rugalmasságukat. A tápfolyadékban tárolt minták egy hét elteltével is megőrizték kontrakciós képességüket, és ez a további tárolás (2, 3, 4 hét) során is csak lassan csökkent. Ezen minták a tárolás alatt megőrizték változatlan geometriai sajátságaikat, és a friss vénákéhoz hasonló elasztikus tulajdonságokat mutattak. A mélyfagyasztott-felolvasztott minták falvastagsága megnövekedett és rugal - masságuk részben megmaradt. Biomechanikai profil alapján az X-VIVOTM10 tápfolyadékban hűtve tárolt véna homograftok, potenciális alternatívát jelenthetnek az érpótlásban, amennyiben nem áll rendelkezésre megfelelő mennyiségű vagy minőségű autológ véna. Hosszú távú klinikai vizsgálatok szükségesek ezen tárolási módszer széles körű felhasználhatóságának további igazolására.
Érbetegségek: 2013/3. 55-59. oldal
KULCSSZAVAK
Véna saphena magna, tápkultúra médium, hűtve tárolás, szövet prezerváció, kontraktilitás, elaszticitás.
Bevezetés
A véna autografttal történt legelső kísérleteket az 1800-as évek legvégén Gluck (1894), illetve tőle függetlenül Exner és Höpfner (1903) végezték. Bár ezek a véna graftok mind elzáródtak, Carrel és Guthrie (1906) már sikerrel alkalmaztak kísérletes, autológ vénás áthidalást (1). Az első humán autológ vénával végzett áthidalás Goyanes (1906) nevéhez fűződik, aki egy szifiliszes poplitea aneurysma excisioja után, az artériás defektust véna poplitea interpositummal pótolta (2). Még ugyanebben az évben Lexer véna saphena magna felhasználásával végzett artériás rekonstrukciót egy posttraumatikus axillaris aneurysma excisio után (3).
A későbbi Nobel-díjas (1912) francia sebész, Alexis Carrel nevéhez fűződik az a sikeres érátültetéses kísérletsorozat is, amit 1907-ben publikált ér hetero - transzplantációs vizsgálatairól kutya-macska modellen: hűtve tárolt explantált véna és artéria szegmenteket helyezett aorta pozícióba(4) Carrelnek az érsebészetben végzett sokrétű, úttörő munkássága még inkább figyelemre méltó annak fényében, hogy akkoriban a manapság esszenciálisnak tartott diagnosztikus (képalkotó) és terápiás eszközök javarészt még hiányoztak.
Az ugyancsak Nobel-díjjal (1901) jutalmazott Röntgen a gamma-sugárzást, azaz a ”Röntgen sugarat” már 1895-ben felfedezte, de az erek funkcionális vizsgálatára, így például a cerebrális angiográfiára csak 1927-ben került először sor (Egas Moniz, Lisszabon). A heparin humán terápiás felhasználhatósága 1935 óta lehetséges.
Az első artériás allografttal sikeresen végrehajtott kardiovaszkuláris rekonstrukciót 1948-ban Gross végezte, majd Kunlin 1949-ben leírja a modern popliteális bypasst (5) Holden 1950-ben vena saphena magnaval végzett, occludalt arteria femoralis superficialis áthidalásáról számol be (6). Nem sokkal ezután az első sikeres infrarenalis aorta rekonstrukciót, ugyancsak artériás homografttal 1951-ben Dubost hajtotta végre, ami fontos mérföldkőnek számított az akkor még sebészileg kezelhetetlen aorta aneurysma gyógyításában (7).
Az ötvenes évek elején Dubost (1952) és DeBakey (1954) a resecalt hasi aortát olyan friss allografttal pótolták, amelyeket a beültetésig antibiotikumos oldatban akár 6 héten keresztül is tároltak. DeBakey és Hufnagel (1953) etilén-oxiddal dezinficiálták majd tartósításként liofilizálták (fagyasztva szárították) az artériás allograftokat. Gross sterilizáció gyanánt a besugárzást választotta, majd a tartósításra fagyasztott szén-dioxidot (száraz jeget) használt. A glutáraldehid fixált v. umbilicalist (HUV) a '70-es évek közepétől használják conduitként, leggyak - rabban polyester Dacron háló erősítéssel. A tárolás 50%-os vizes ethanolban történik, amit a beültetés előtt kiöblítenek. O’Bryan 1975-ben mutatta be a mélyfagyasztást dimethyl sulfoxid (DMSO) krioprotektáns használatával, amely alkalmas a kardiovaszkuláris szövetek hosszú távú tárolására. Ezzel a szívsebészek és az érsebészek számára elérhetővé tette a szívbillentyűket és az érgraftokat acut és electiv beavatkozásokhoz is.
Logisztikai szempontokat figyelembe véve kívánatos, hogy a graftok tárolása minél hosszabb időn át, költség - hatékony és egyszerű módon legyen megoldható. Ennek több lehetséges variációja kínálkozik, kardiovaszkuláris téren legelterjedtebb a szövetek mélyfagyasztott tartósítása és tárolása.
A mélyfagyasztás speciális műszereket igényel, amiknek nemcsak a beszerzési, hanem a fenntartási és szerviz - költsége is terheli a szövetbank működtetőjét. Ennél fogva tovább folyik a keresés egyszerűbb, olcsóbb prezervációs eljárások, metódusok után. Éppen ezért az utóbbi időben újra előtérbe kerültek az egyszerű, hideg anoxiás oldatban 4°C-on történő tárolás lehetőségei, azzal a különbséggel, hogy bő 100 évvel Carrel heterotranszplantációs kísérletei után olyan komplex tápfolyadékok birtokában vagyunk, amelyek nagymértékben képesek lassítani, minimalizálni a sejt, illetve szövet károsodásokat. A transzplantáció sikere szempontjából a tároló oldat összetétele meghatározó jelentőségű (8,9). A jelenleg használt oldatoknak egyik fő célja, hogy megelőzze a sejtek duzzanatát, ami a sejt - membrán ionpumpáinak hypoxiás hideg tárolás okozta gátlása miatt következik be, illetve megelőzze az energiaháztartás következményes leromlását, ami végül az intracelluláris ionhomeosztázis elvesztéséhez vezet (10).
A hideg és hypo/anoxia kiváltotta intra/intercelluláris folyamatok intenzív kutatás tárgyát képezik nemcsak az érszövet esetében, hanem az idegszövet, szívizomszövet vagy egyéb transzplantálható parenchymás szerv esetén is. Érgraftok esetén a beültetéskor fennálló biomechanikai tulajdonságok kritikus fontosságúak a rövid és hosszú távú nyitva maradás, azaz a későbbi graftfunkció szempontjából. Galambos és munkatársai komplex szövet kultúra médium felhasználásával tároltak véna szegmentumokat hideg anoxiában, és azt találták, hogy 6 hetes tárolási idő múltán csökken a graft viabilitása kb.60 %-ra, ami megfelel a mélyfagyasztás és felolvasztás után tapasztaltakkal (11,12). E gondolat folytatásaként tűztük ki célul a véna saphena magna biomechanikai vizsgálatát és értékelését a különböző tárolási eljárások függvényében.
Anyag és Módszer
A mérésekhez felhasznált vénákat a coronaria bypass műtétre kerülő páciensektől gyűjtöttük, a műtét befejeztével a fennmaradó véna szakaszt - amennyiben az legalább 40mm hosszú volt - használtuk fel további vizsgálatainkhoz. Az anyagyűjtést, tárolást és a biomechanikai kísérleteket TUKEB engedéllyel (2006/123) végeztük. Összesen 32 betegtől származó 72 véna szegmentumot vizsgáltunk. 8 különböző csoportot határoztunk meg:
- Friss szegmentumok – a kivétel után közvetlenül mérésre kerültek.
- Hűtött (4°C) normál Krebs-Ringer oldatban 1 hétig tárolt minták.
- Hűtött (4°C) normál Krebs-Ringer oldatban 2 hétig tárolt minták.
- Hűtött (4°C) X-VIVOTM10 oldatban 1 hétig tárolt minták.
- Hűtött (4°C) X-VIVOTM10 oldatban 2 hétig tárolt minták.
- Hűtött (4°C) X-VIVOTM10 oldatban 3 hétig tárolt minták.
- Hűtött (4°C) X-VIVOTM10 oldatban 4 hétig tárolt minták.
- Mélyfagyasztott és felolvasztott minták.
A normál Krebs-Ringer (nKR) oldatot a legtöbb esetben szállító és két csoportban tároló médiumként használtunk, illetve ez volt a mechanikai tesztelés során a szervfürdő alap összetevője is. Ennek összetétele: 119 NaCl, 4.7 KCl, 1.2 NaH2PO4, 2.5 CaCl2, 1.2 MgSO4, 24 NaHCO3, 5.5 glukóz és 0.02 EDTA mmol/L-ben kifejezve.
Szövetkultúra médiumként az X-VIVOTM10 (Bio - Whittaker, Walkersville, MD, US, BW04380Q) használtuk, ami egy szérummentes, kémiailag meghatározott médium. Rekombináns humán fehérjéket (albumint, transferrint és inzulint) továbbá fenol vöröst, és antibiotikumként gentamicint tartalmaz. A médiumot többek között csontvelői őssejtek tárolására, szaporítására is alkalmazzák. A mintákat sterilizált üvegedényekben tároltuk gumi - dugóval légmentesen lezárva, majd külső jeges hűtéssel szállításhoz előkészítettük, vagy a megfelelő csoportok szerint 1-4 hétig hűtve tároltuk. Az nKR és X-VIVOTM10 csoportokban a tárolás 4°C fokon történt. Az explantált véna szegmentumok mélyfagyasztását a Városmajori Szív- és Érgyógyászati Klinika protokolljának megfelelően végeztük. A mintákat először antibiotikum tartalmú Ringer-laktát oldatba helyeztük, és krioprotektánsként fokozatosan DMSO-t adtunk hozzá, míg el nem értük a 10%-os koncentrációt. Körülbelül 20 perc szoba - hőmérsékleten történt equilibratio után a mintákat a programozott mélyfagyasztó készülékbe helyeztük és -40 °C eléréséig 1 °C/perc hűtési sebességgel, majd ezt követően a -150 °C hőmérséklet eléréséig 5 °C/perc hűtési sebességgel fagyasztottuk. Ezután a mintákat néhány hétig folyékony nitrogén gőzében tároltuk -140/-150 °C hőmérséklet tartományban. A felolvasztásnál a gyors protokollt használtuk, azaz a mintákat 37 °C fokos fürdőbe merítettük. A vénákat sztereomikroszkóp alatti óvatos preparálással készítettük elő a mérésre, eltávolítva a kötő- és zsírszövetet. Ezután 37 °C–os nKR szervfürdőbe helyeztük, amiben 95% O2 és 5% CO2 gázt buborék - oltattunk. Az angiométer szervfürdőjében a szegment mindkét végét kanüláltuk, majd az érszakasz eredeti hosszának 110%-ára nyújtottuk, hogy a fiziológiás in vivo axiális hosszat szimuláljuk. Az intraluminális nyomást egy infúziós pumpa (Harvard Apparatus, Holliston, MA, USA), és egy rezervoir segítségével állítottuk be az adott értékekre. A szegmentum középső részét látótérbe hoztuk egy video mikroszkóppal, ami egy Leica mikroszkópból, egy Philips analóg videó kamerából és Cole-Palmer száloptikából épült fel. A szegmentum képe megjelent a képernyőn, ahol az érszakasz külső és belső átmérője mérhetővé vált egy analog minicomputer segítségével, az egyes mérési pontok kézi beállításával. A kalibrációkat Wild mikrométer segítségével végeztük.
Az érszakaszok első lépésben preinkubáción estek át 30 percen keresztül 10 Hgmm-es intraluminális nyomáson. Ezt követően a nyomást lépésről lépésre (7,5 Hgmm) emeltük 0-85 Hgmm között, minden egyes mérési ponton/nyomáson 2 percnyi equilibratio után olvastuk le a mérési pontok távolságát.
A mérési folyamatot megismételtük 10µM noradrenalin jelenlétében a maximális kontrakció kiváltása érdekében, majd ezt követően Ca2+ mentes Krebs-Ringer oldatban - a teljes érfal relaxáció érdekében - 150 Hgmm eléréséig. Végezetül nyomáspróbát hajtottunk végre 300 Hgmm–es nyomáson és regisztráltuk az esetleges szivárgást. A biomechanikai számításokat a következőképp végeztük:
A tangenciális feszülést a Frank-Starling egyenlőség alapján számítottuk ki:
- ð = p*ri/h
p az intraluminális nyomás, az ri a belső sugár, a h pedig az érfal vastagsága.
Kiszámoltuk az inkrementális disztenzibilitást:
- Dinc=ΔV/(V*Δp)
Dinc az inkrementális disztezibilitás, a ΔV a lumen térfogatának változása a Δp mértékű nyomásváltozásra a V kiindulási térfogathoz viszonyitva.
Az inkrementális elasztikus modulust a következő egyenlet felhasználásával számoltuk:
– Einc=(2ri2ro/(ro22-ri2)) (Δp/Δro)
ri és az ro az érfal belső és a külső sugara, Δro pedig a külső sugár változása, Δp nyomásváltozás hatására.
A mintákban létrejövő kontrakciót minden egyes nyomásértéken a belső átmérő teljesen relaxált állapotához viszonyítottuk, és százalékos változásként értékeltük. A statisztikai értékelést egy és kétváltozós ANOVA–val végeztük. Egyes esetekben a korrelációs koefficienst, illetve annak szignifikancia szintjét is meghatároztunk. A p<0,05 értéket fogadtuk el statisztikailag szignifikánsnak.
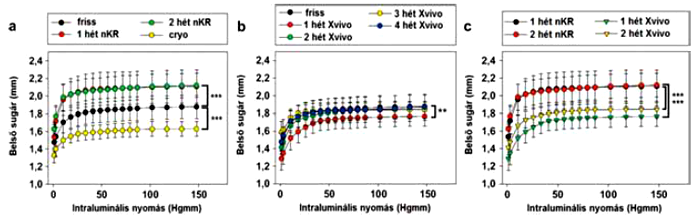
1. ábra. Különböző módon tárolt VSM szegmentumok geometriai tulajdonságainak változásai különböző összehasonlításokban, a szegmentumok belső sugár – intraluminális nyomás jelleggörbéi alapján.
a. friss, 1, 2 hét nKR tárolt és krioprezervált minták jelleggörbéi.
b. friss és különböző ideig X-VIVOTM10 oldatban tárolt minták jelleggörbéi.
c. különböző oldatokban 1, 2 hétig tárolt graftok jelleggörbéinek összehasonlítása (két változós ANOVA **p<0,01***p<0,001)
Eredmények
A tárolás során bekövetkező eltéréseket az aktív és passzív biomechanikai tényezők változásán keresztül követtük nyomon, illetve értékeltük.
A hideg nKR-ben történt tárolás, tágulást idézett elő az ellazult (relaxált) állapotban lévő ér szegmentekben, ugyanakkor a falvastagság nem változott. Az 1. ábra a különböző ideig más-más médiumban tárolt friss, illetve mélyfagyasztott minták nyomás-átmérő görbéit mutatja. Mind az nKR–ben tárolt minták átmérő növekedése, mind a mélyfagyasztott szegmentumoknál mért kisebb átmérő a friss (kontroll) csoporthoz képest szignifikáns (p<0,001) eltérést mutatott (1/a. ábra). A kontroll (friss) csoport belső átmérője 1,70 ± 0,12 mm volt 10 Hgmm nyomásértéken és 1,98 ± 0,15 mm-re emelkedett a tárolási időszak végére nKR oldatban. Ugyanakkor a falvastagság nem változott számottevően (2/a. ábra).
Mérsékelt, de statisztikailag szignifikáns csökkenés mutatkozott az izobárikus disztenzibilitás (8.9 ± 1.3 x 10-3 szemben 4.9 ± 1.9 x 10-3 1/Hgmm) tekintetében (2/b. ábra). Ugyanakkor az elasztikus modulus változatlan maradt (2/c. ábra).
A maximális koncentrációjú norepinephrinnel kiváltott kontrakciós képesség közel teljes mértékben megszűnt 1 hetes nKR oldatban végzett tárolás után a friss szegmentumokhoz viszonyítva (1.6 ± 0.8% -ra csökkent a kiindulási 10.1 ± 1.5% értékről, p<0.01).
Felolvasztás és inkubáció után a mélyfagyasztott minták csökkent lumen átmérőt és megnövekedett falvastagságot mutattak (586 ± 56µm), szemben a kontroll csoportban mért 408 ± 17µm, (p<0.001) relaxált szegmentumok esetén, 10 Hgmm intraluminalis nyomáson. Elasztikus tulajdon - ságait jórészt megőrizte és a kontrakciós képességét sem vesztette teljesen el (2. és 3. ábra).
A szövet kultúra médiumban tárolt véna szakaszok biomechanikai tulajdonságait tekintve szignifikánsan különböztek az nKR oldatban tárolt szegmentekétől. A tárolás kezdetén átmérő csökkenést tapasztaltunk szemben az nKR oldatban tárolt szegmentumok dilatációjával. Az X-VIVOTM10 tápfolyadékban történő tárolás a lumen méretét a 2-4 hét között nem befolyásolta (1/b. és 1/c. ábra).
Figyelemre méltó, hogy a passzív nyomásgörbe 2 hét tárolás után is majdnem tökéletes mása volt a friss szegmenteknél mért görbének (1/b. ábra). Ezeknél a mintáknál, ellentétben a mélyfagyasztott szegmentumokkal, a falvastagság fokozatosan csökkent a tárolási idő előre - haladtával (a korrelációs koefficiens szignifikancia szintje p<0.01). Az nKR-ben tárolt szegmentumoktól eltérően, a mélyfagyasztott mintáknál az elaszticitás változása sem ért el szignifikáns szintet.
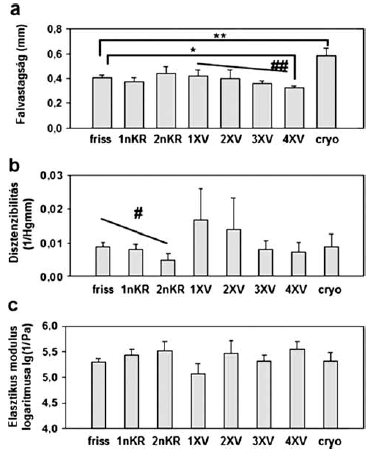
2. ábra. A falvastagság és a véna graftok az elasztikus tulajdonságainak változásai különböző tárolási feltételek esetén.
a. A falvastagság értékei 10 Hgmm intraluminális nyomáson.
b. Inkrementális disztenzibilitás 15 Hgmm intraluminális nyomáson.
c. Inkrementális elasztikus modulus logaritmusa 15 Hgmm intraluminális nyomáson (egy változós ANOVA *p<0,05;**p<0,01;***p<0,001; statisztikai differencia a korrelációs koefficiens szignifikancia szintjében #p<0,05; ##p<0,01)
Eredmények
A tárolás során bekövetkező eltéréseket az aktív és passzív biomechanikai tényezők változásán keresztül követtük nyomon, illetve értékeltük.
A hideg nKR-ben történt tárolás, tágulást idézett elő az ellazult (relaxált) állapotban lévő ér szegmentekben, ugyanakkor a falvastagság nem változott. Az 1. ábra a különböző ideig más-más médiumban tárolt friss, illetve mélyfagyasztott minták nyomás-átmérő görbéit mutatja. Mind az nKR–ben tárolt minták átmérő növekedése, mind a mélyfagyasztott szegmentumoknál mért kisebb átmérő a friss (kontroll) csoporthoz képest szignifikáns (p<0,001) eltérést mutatott (1/a. ábra). A kontroll (friss) csoport belső átmérője 1,70 ± 0,12 mm volt 10 Hgmm nyomásértéken és 1,98 ± 0,15 mm-re emelkedett a tárolási időszak végére nKR oldatban. Ugyanakkor a falvastagság nem változott számottevően (2/a. ábra).
Mérsékelt, de statisztikailag szignifikáns csökkenés mutatkozott az izobárikus disztenzibilitás (8.9 ± 1.3 x 10-3 szemben 4.9 ± 1.9 x 10-3 1/Hgmm) tekintetében (2/b. ábra). Ugyanakkor az elasztikus modulus változatlan maradt (2/c. ábra).
A maximális koncentrációjú norepinephrinnel kiváltott kontrakciós képesség közel teljes mértékben megszűnt 1 hetes nKR oldatban végzett tárolás után a friss szegmentumokhoz viszonyítva (1.6 ± 0.8% -ra csökkent a kiindulási 10.1 ± 1.5% értékről, p<0.01).
Felolvasztas es inkubacio utan a melyfagyasztott mintak csokkent lumen atmer.t es megnovekedett falvastagsagot mutattak (586±56<m), szemben a kontroll csoportban mert 408±17<m, (p<0.001) relaxált szegmentumok esetén, 10 Hgmm intraluminalis nyomáson. Elasztikus tulajdon - ságait jórészt megőrizte és a kontrakciós képességét sem vesztette teljesen el (2. és 3. ábra).
A szövet kultúra médiumban tárolt véna szakaszok biomechanikai tulajdonságait tekintve szignifikánsan különböztek az nKR oldatban tárolt szegmentekétől. A tárolás kezdetén átmérő csökkenést tapasztaltunk szemben az nKR oldatban tárolt szegmentumok dilatációjával. Az X-VIVOTM10 tápfolyadékban történő tárolás a lumen méretét a 2-4 hét között nem befolyásolta (1/b. és 1/c. ábra).
Figyelemre méltó, hogy a passzív nyomásgörbe 2 hét tárolás után is majdnem tökéletes mása volt a friss szegmenteknél mért görbének (1/b. ábra). Ezeknél a mintáknál, ellentétben a mélyfagyasztott szegmentumokkal, a falvastagság fokozatosan csökkent a tárolási idő előre - haladtával (a korrelációs koefficiens szignifikancia szintje p<0.01). Az nKR-ben tárolt szegmentumoktól eltérően, a mélyfagyasztott mintáknál az elaszticitás változása sem ért el szignifikáns szintet.
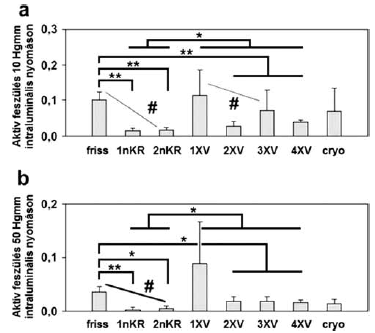
3. ábra. Különböző módon tárolt VSM szegmentumok kontrakciós tulajdonságainak változásai két nyomás szinten:
a. 10 Hgmm intraluminális nyomáson;
b. 50 Hgmm intraluminális nyomáson (egy változós ANOVA *p<0,05;**p<0,01; statisztikai differencia a korrelációs koefficiens szignifikancia szinjében #p<0,05)
Értékelés
Megállapíthatjuk, hogy az X-VIVOTM10 tápfolyadékban tárolt szegmentumok relatíve jól megőrizték a kontrakciós képességüket: ugyan a tárolás során ez folyamatosan csökkent, de a megfelelő nKR szegmentekhez viszonyítva szignifikánsan jobb kontrakciós képességet mutattak (p<0,05), mind 10 Hgmm mind 50 Hgmm intraluminális nyomásértéken (3/a. és 3/b. ábra).
A biomechanikai tulajdonságok rövid és hosszú távú megőrzése kardinális fontosságú a tárolás során. A mi kísérletes modellünkben alkalmazott 4 hetes tárolási idő alatt az érgraftok, ellentétben más tárolási metódusokkal, megőrizték a geometriájukat és rugalmasságukat. Az, hogy ez milyen mértékben segíti a rövid és hosszú távú graftfunkciót az implantáció után, várhatóan további összehasonlító klinikai vizsgálatokból fog kiderülni.
A világ számos országában növekvő igény van a homológ érpótlás szélesebb körű felhasználhatóságára. A 4 hetes tárolás elegendő időt biztosít a részletes mikro - biológiai vizsgálatokra, donor screeningre és az electiv műtétek tervezésére, kivitelezésére. Megfelelő graftszámú érbank esetén szóba jöhet akut műtét során történő felhasználás is.
Köszönetnyilvánítás
A munka az OTKA TO32019 és TO 42670, az ETT 128/2006 progamok és a Magyar Vese Alapítvány támogatásával készült. Az első szerzőt (dr MGF) Köznevelési Minisztérium PhD programja támogatta. Oravecz Ildikót köszönet illeti a szakszerű technikai segítségért. Az automatikus átmérő-mérő berendezés Sedlacsek Sándor dipl. villamosmérnök és teamjének alkotása. Az Elsevier nagylelkűen engedélyezte angol nyelven már publikált cikkből az ábrák átvételét.
Irodalom
- Carrel A, Guthrie CC. Anastomosis of blood vessels by the patching method and transplantation of the kidney. JAMA 47:1648-51.(1906)
- Goyanes DJ. Substitution Plastica de las Arterias por Pas Vena o Arterioplastica Venosa, Aplicado Como Naevo Metodica Tratamiento de los Anemismas. El Siglo Medico 1: 346-62. (1906)
- Lexer F. Die ideale Operation des Arteriellen und des Arteriennen-venosen aneurysma. Archiv Klin Chir 83:459-60.(1907)
- Carrel A. Heterotransplantation of bood vessels preserved in cold storage. J Exp Med 14;9(2): 226-8.(1907)
- Kunlin J. Le traitment de l’arterite obliterante par la greffe veineuse. Arch Mai Coeur 42:371-2.(1949)
- Holden WD. Reconstruction of the femoral artery for atherosclerotic thrombosis. Surgery 27:417.(1950)
- Dubost C, Allary M, DeConomos N. A propos du traitement des aneurysmes de l’aorte: ablation de l’aneurysme et retablissment de la continuaté par greffe d’ aorte humaine conservée. Mem Acad Chir 77: 381–383.(1951)
- Hooper TL, Jones MT, Thomson DS, Cook L, Owen S, Wilkes S, Woodcock A, Webster AH, Hasleton P, McGregor CG. Hypertonic citrate solution as an alternative to modified Euro-Collins' solution for lung preservation. Transplantation 51(5):1043-8.(1991)
- Collins GM, Wicomb WN. New organ preservation solutions. Kidney Int Suppl 38:S197-202.(1992)
- Fuller BJ. The effects of cooling on mammalian cells. In:Fuller BJ. Grout BW, eds. Clinical applications of cryobiology. Boca Raton, Florida: CRC Press, 1-21.(1991)
- Galambos B, Csonge L, Olah A, von Versen R, Tamas L, Zsoldos P. Quantitative reduction of methyl tetrazolium by fresh vein homograft biopsies in vitro is an index of viability. Eur. Surg. Res. 36:371.(2004)
- Galambos B, Csonge L, von Versen R, Olah A, Tamas L, Zsoldos P. Preservation of vein allograft viability during longterm storage. Eur. Surg. Res. 37:60.(2005)
Dr. Molnár Gábor Ferenc
Érbetegségek: 2013/3. 55-59. oldal


