A nitrogén-monoxid fontos szerepet tölt be több élettani folyamatban, csökkent koncentrációja patofiziológiás hatásokhoz vezet, ezért klinikailag alkalmazható nitrogénmonoxid-donorok fejlesztése és azok jellemzése nagy jelentőségű. Az S-nitrozotiolok csoportja ígéretes lehet, tekintve, hogy eddigi tapasztalatok alapján nem szokik hozzá a szervezet, és több betegségmodellben is hatékony. Az S-nitrozotiolok közül az egyik fő endogén vegyület az S-nitrozoglutation, amit már számos humán vizsgálatban is eredményesen használtak. Az eddigi bíztató eredmények ellenére az S-nitrozoglutationt még nem használják egyetlen gyógyszer hatóanyagaként sem. A fő nehézséget az S-nitrozotiolok használatában az okozza, hogy vizes közegben a bomlás gyors és gyakran kiszámíthatatlan kinetikájú. Cikkünkben az S-nitrozoglutation és más nitrogénmonoxid-donorok kardiovaszkuláris kórállapotokban történő alkalmazásával kapcsolatos lehetőségeket tekintjük át, előtérbe helyezve a terápiás alkalmazást érintő kémiai és biológiai tulajdonságokat, valamint a további kutatást igénylő területeket.
Érbetegségek: 2010/4. 55-59. oldal
KULCSSZAVAK
S-nitrozoglutation, nitrogén-monoxid, trombocita aktiváció, vazodilatáció
Bevezetés
A nitrogén-monoxid (NO) fontos szerepet tölt be több élettani folyamatban (1. táblázat), csökkent koncentrációja patofiziológiás hatásokhoz vezet, ezért klinikailag alkalmazható nitrogénmonoxid-donorok fejlesztése és azok jellemzése nagy jelentőségű.
A 2. táblázat a jelenleg ismert NO-donorok jellegzetességeit mutatja be a farmakodinamikai tulajdonságok, a stabilitás, és az első alkalmazás szempontjából. A táblázat alapján a fő farmakokinetikai hátrány a nitritek és nitrátok esetében a rövid ideig tartó hatás és a szervezetben kialakuló tolerancia [1]. A szervetlen nitrozokomponensek fő problémája, hogy melléktermékként cianidot termelnek. A molsidomin egy stabil NO donor "prodrug", hosszútávon használható stabil anginás betegek kezelésére. A hatóanyag egyik előnye, hogy a szervezet nem szokik hozzá, ellentétben a nitroglicerinnel, azonban lebomlása közben szuperoxid anionok is keletkeznek. A felsorolt hatóanyagok mindegyike szisztémás hatású, amivel szemben az S-nitrozoglutation fő előnye, hogy endotelfüggő relaxációt okozva helyi értágítóként használható.

1. táblázat.
A nitrogén-monoxid főbb hatásai

2. táblázat.
Nitrogénmonoxid-donorok összefoglalása
A nitrogén-monoxid felszabadítására képes S-nitrozoglutation (GSNO), illetve az S-nitrozotiolt tartalmazó fehérjék (RSNO) az emberi szervezetben jönnek létre, és a GSNO képes NO-leadásra a sejten belül és azon kívül is [4]. Az eddigi bíztató eredmények ellenére az S-nitrozoglutationt még nem használják egyetlen olyan kórképben sem, ahol kívánatos lenne a nitrogén-monoxid szint emelése, és nem szerepel egyetlen gyógyszer hatóanyagaként sem. A fő nehézséget a használatában az okozza, hogy vizes közegben a bomlás gyors és gyakran kiszámíthatatlan kinetikájú. A hosszabb ideig fenntartható hatáshoz igen magas kezdeti koncentrációra lenne szükség, ami nem kívánatos, mert a sejtben lévő RSNO-k képesek S-nitrozilálni több fontos fehérjét a sejtmagban, plazmában és a mitokondriumban. Az S-nitrozilált mitokondriális fehérjék között az elektronszállító lánc és a Krebs-ciklus tagjait is megtalálhatjuk [5]. Általánosságban a fehérjék S-nitrozilálása GSNO vagy más NO-donor által, megváltoztatja azok aktivitását és működését, és számos betegség kialakulásáért bizonyos speciális célfehérjék S-nitrozilációja tehető felelőssé [6]. Ezért az olyan magas koncentrációk, ahol az NO-felszabadítás helyett már az S-nitrozilációs hatások jelennek meg nem megengedhetőek, azaz olyan formulációra van szükség, mely hosszan képes NO-t felszabadítani, de nem okoz káros S-nitrozilációs mechanizmusokat. A GSNO alkalmasnak látszik erre, de stabilitásának és az NO-felszabadulás mértékének kontrollálása még nem teljesen megoldott.
S-nitrozoglutation kémiai tulajdonságai
Az S-nitrozoglutation - mint a legtöbb S-nitrozotiol instabil kristályos formában, és vizes oldatban. A GSNO és általában a primer nitrozotiolok (S-nitrozocisztein, S-nitrozo-N-acetilcisztein) szobahőmérsékleten, UV és/vagy látható fényben órák alatt lebomlanak, emellett közös tulajdonságuk a narancssárga-vörös szín [7]. Ezzel szemben a tercier S-nitrozotiolok (S-nitrozo-N-acetilpenicillamin és származékai) általában stabilak, és zöld színűek [8]. A tercier RSNO-k mellett stabil S-nitrozotiol komplexeket is szintetizáltak már [9]. A GSNO előállításának legelterjedtebb módja a glutation (GSH) és egy NO forrás reakciója. Az S-nitrozotiolok (RSNO-k) kristályos formáit fagyasztva (-20°C vagy az alatt), mikronizálva, RSNO sóképzés vagy inert gáz használatával tárolhatjuk [10]. Az RSNO bomlása során a megfelelő diszulfid és NO keletkezik, ez a hatás fokozható a megfelelő hullámhosszú fénnyel [11]. A vizes oldatok stabilitása az RSNO-k két fő izomerjének egyensúlyán alapszik, ami az adott RSNO szerkezeten belüli elektrofil és nukleofil csoportoktól, a kémiai környezettől (oldat, film, párna) függ. A kémiai környezethez hozzátartozik a jelenlevő fémionok típusa és töltése, a pH és a jelenlévő egyéb RSNO-k [12].
S-nitrozoglutation formulációk
Mivel az RSNO-k tárolási lehetőségei limitáltak, az alkalmazható egyszerű formulációk a mikronizált por, vizes oldat és szuszpenzió. Általánosságban a vizes oldatainak lebomlása főleg a hőmérséklettől függ [10]. Vizsgálataink szerint 4°C-on 3%, 37°C-on 32% bomlik el 12 óra alatt A formulációkat 7,4-es pH-n tároltuk, és a bomlás a 0,01-20mg/ml közötti tartományban függött a koncentrációtól is. Egy, a GSNO klinikai felhasználására irányuló szabadalom szilárd formulációról számol be, ami kombinálja a mikronizált RSNO port, vagy RSNO sót inert gázzal, illetve oxigén csapdával, vagy szárítószerrel. Ugyanez a szabadalom beszámol még egy vizes formulációról, specifikus pH-n, pufferrel, gyógyászatban elfogadott oldószerről, és RSNO koncentrációintervallumról. Mindent összevetve az igénypontok széles körű formulációkat fednek le topikális kompozíciók terén, de nem szerepel benne egy specifikus használatra kész termékötlet sem [10]. Ezzel ellentétben, egy másik szabadalom [13] egyértelműen olyan készítményt ír le, amely inhalálható, és egy mikronizált RSNO por és egy hajtóanyag kombinációja. Habár a GSNO és általánosan az RSNO-k fontos, terápiásan alkalmazható NO donorok lehetnének, mindössze ez a két szabadalom jelzi, hogy gyógyászati használatra alkalmas termékek készíthetők a felhasználásukkal.
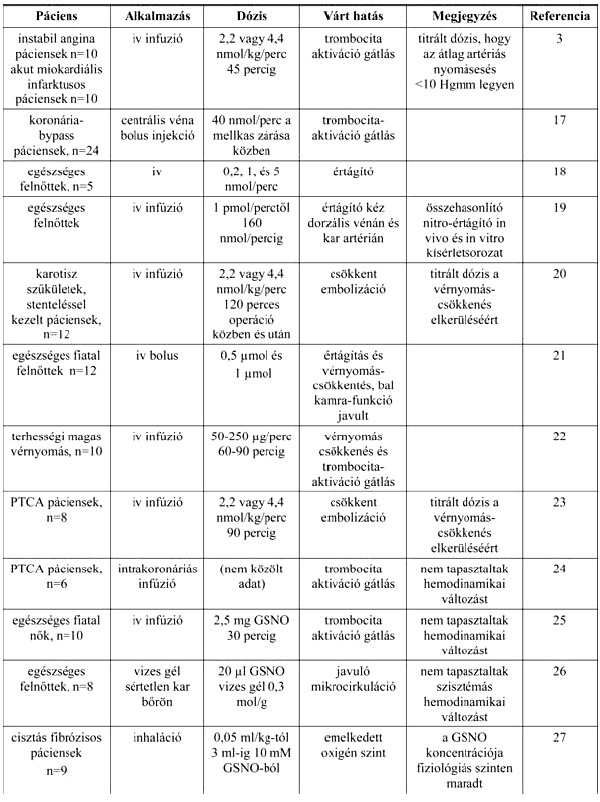
3. táblázat.
Az S-nitrozoglutation alkalmazásainak eredményei klinikai vizsgálatokban
Komplexebb formulációkat tekintve ígéretes lehetőség a nyálkahártyán át történő felszívódás, ahol a hatóanyag egy filmben található, a film GSNO-t, vizet, gélképzőt és sűrítőanyagot tartalmaz. A formulációt azonban azonnal fel kell használni vagy fagyasztva kell tárolni [14]. Seabra és kollégái használtak egy GSNO tartalmú víz alapú gélt topikális értágítóként [15], de ezt a formulációt is azonnal fel kellett használni elkészítés után. A legstabilabb készítményt szintén ez a kutatócsoport készítette el, ami egy GSNO/PEG (poli-etilénglikol) kompozíció volt. Ebben a polimer mártixban szintetizálni és tárolni is tudták a GSNO-t, és a csökkent NO-felszabadulás jelezte a stabilitás növekedését. Az elegyet fagyasztva tárolták, és kísérleteik alapján 65 nap után sem tapasztaltak bomlást. Mivel a GSNO így stabilabb, célszerű lenne a készített elegyet tesztelni, mert elképzelhető, hogy a megnőtt stabilitással az NO-felszabadulás is csökken.
További érdekes lehetőséget jelenthet a fotoszenzitizáció, mely egy akár terápiásan is felhasználható, de jelenleg nem kihasznált tulajdonsága a nitrozotioloknak. Furchgott és kollégái fedezték fel az 50-es években, hogy a látható fény tágította az izolált ereket [16]. A két karakterisztikus hullámhossz a 320nm és 450nm volt, de a mechanizmust akkor még nem ismerték. Mára már tudjuk, hogy a két fő emissziós sáv UV-ban a 320nm-es, látható fényben a 450nm-es, ami egyben a vegyület színéért is felelős. Néhány tanulmány foglalkozott azzal is, hogy helyi toxikus NO koncentráció előállítása fotoszenzitátizáció segítségével hatásos lehet tumorterápiában.
Klinikai vizsgálatok S-nitrozoglutationnal
A GSNO előnyeinek köszönhetően, számos vizsgálatot végeztek a hatóanyaggal. 1994-ben Moncada csapata kis dózisú intrakoronáriás GSNO-t adott be betegeknek, ami nem okozott hemodinamikai elváltozást, viszont megakadályozta a trombocita aktivációt perkután karotisz angioplasztikával (PTCA) kezelt betegekben [3]. Ezt a tanulmányt több hasonló vizsgálat követte, amelyekben még nem hemodinamikus hatásokkal bíró dózisban használták a GSNO-t, és a hatóanyagot megelőzés céljából parenterálisan adagolták olyan invazív sebészeti beavatkozások után mint a PTCA, koronária bypass műtét, illetve karotisz szűkületek stenteléssel történő kezelése. Az összes tanulmány a GSNO előnyeiről számolt be, ami főleg a trombocitaaktiváció csökkenésében nyilvánult meg. Azt is fontos kiemelni, hogy egyik kísérletben sem tapasztaltak súlyos mellékhatást, ami feltehetően annak is köszönhető, hogy a GSNO koncentrációt a hemodinamikailag aktív koncentráció alatt tartották. Ezzel szemben egy klinikai vizsgálatban terhesség során kialakuló, súlyos magas vérnyomás esetében magasabb dózisú GSNO-t használtak kimondottan annak érdekében, hogy csökkentsék azon terhes nők vérnyomását, akik nem reagáltak a korábbi terápiára. Az eredmények azt mutatták, hogy az értágító hatás és a vérnyomáscsökkentő hatás nem járt együtt magzati keringésbeli változással, ami tovább növeli a GSNO, mint terápiás hatóanyag felhasználhatóságának körét.
A GSNO topikális alkalmazásait szintén vizsgálták. Egy GSNO tartalmú vizes gélt helyeztek egészséges alkarra, ami a helyi mikrocirkuláció javulását eredményezte szisztémás mellékhatás nélkül. A helyi mikrocirkuláció növekedését saját vizsgálatainkban is igazoltuk (1. ábra). Itt jegyezzük meg kitekintésként, hogy az NO a bőr mellett a nyálkahártyán keresztül szintén jól felszívódik, főként a légzőrendszerben. Az NO-t ezért több formulációban használják asztma és más légzőszervi megbetegedésekben, és az S-nitrozoglutationnal kapcsolatosan az eredmények alapján a GSNO bronchodilatációt hozott létre. Egy tanulmányban, amelyben cisztás fibrózissal kezeltek betegeket nebulizált GSNO-t inhaláltattak, javult az oxigén ellátás minden káros mellékhatás nélkül. A 3. táblázat összefoglalja a GSNO-val végzett vizsgálatok tapasztalatait. A szignifikáns alkalmazásbeli és dóziskülönbségek azt jelzik, hogy egy előrelátóan megválasztott GSNO formuláció képes szelektíven hatni, annak ellenére, hogy a GSNO elég széles körben fejti ki hatását. A kísérletek mindegyike előnyösen számol be a GSNO használatáról, ezért is meglepő, hogy még mindig nem létezik engedélyezett gyógyszer formájában. Az egyik ehhez közeli eredmény egy N30 Pharma nevű kezdő cég, amely asztma elleni GSNO formulációval hamarosan a klinikai kipróbálás fázisához érkezik. Az egyik magyarázata annak, hogy a GSNO humán tesztelése ennyire ritka, az lehet, hogy mivel a vegyület teljesen ismert, ezért nehéz lehet szabadalmi oltalom alá helyezni, illetve az instabilitás miatt nehéz és költséges lehet a megfelelően stabil formuláció gyártása.
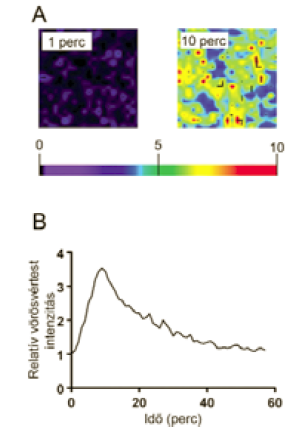
1. ábra
40mM-os GSNO oldat hatása az alkar véráramlására.
(A) GSNO alkalmazás előtt és után jellemző vörösvértest eloszlás. A színskála a relatív intenzitást jeleníti meg 0 (fekete) és 10 (vörös) között.
(B) A vizsgálat során mért relatív intenzitás időbeli lefutása.
A felsorolt kísérletek egyikében sem számoltak be súlyos mellékhatásról GSNO alkalmazása esetén, az említett mellékhatások pedig a GSNO hemodinamikai hatásával kapcsolatosak. A klinikai vizsgálatok alapján kijelenthető, hogy a hemodinamikus hatású koncentrációk alatti dózisok hatásosan csökkentik az embolizációt és gátolják a trombocita-aktivációt akut beavatkozásoknál. Magasabb dózisok korábban hatástalan vérnyomáscsökkentő kezelés esetén használhatóak. Krónikus GSNO használatról szóló beszámoló egyenlőre nem jelent meg az irodalomban. Másrészről a GSNO helyi alkalmazása bőrön, vagy nyálkahártyán hatékonyan használható simaizom lazítóként mindenféle szisztémás mellékhatás nélkül.
Következtetés
A klinikai vizsgálatok eredményei bizonyítják, hogy a GSNO ígéretes terápiás hatóanyag több betegségben, amelyekben a jól ismert és egyedi kémiai és biológiai tulajdonságai hasznosíthatóak. Alacsony dózisú GSNO infúzió például rutin alkalmazássá válhat embolizáció megelőzésére PTCA-n átesett betegeken. Egy másik fontos vonal lehet a GSNO dermális alkalmazása fekélyes sebek esetén. Elegendő humán eredmény támasztja alá, hogy a GSNO használata lehet szelektív, a mellékhatások pedig kontrollálhatóak, vagyis a klinikai alkalmazás indokolt, de még nem megvalósított. Ez valószínűleg annak köszönhető, hogy technikai és szabadalmazhatósági akadályok nehezítik a stabil és könnyen használható GSNO készítmény előállítását, akár az intravénás akár a dermális applikációkat tekintve.
Köszönetnyilvánítás
Jelen munka az OTKA 47095, 49488, 45933, 049621, 83803, ÖAD 66öu5, TÁMOP 4.2.2-08/1/KMR-2008- 0004, Öveges és Bolyai ösztöndíjak támogatásával valósulhatott meg.
Irodalom
- Nossaman, V. E.; Nossaman, B. D.; Kadowitz, P. J. Nitrates and nitrites in the treatment of ischemic cardiac disease. Cardiol. Rev., 18 (4), 190-197.
- Arnold, W. P.; Longnecker, D. E.; Epstein, R. M. Photodegradation of sodium nitroprusside: biologic activity and cyanide release. Anesthesiology, 1984, 61 (3), 254-260.
- Langford, E. J.; Wainwright, R. J.; Martin, J. F. Platelet activation in acute myocardial infarction and unstable angina is inhibited by nitric oxide donors. Arterioscler. Thromb. Vasc. Biol., 1996, 16 (1), 51-55. 4. Yang, Y.; Loscalzo, J. S-nitrosoprotein formation
- Yang, Y.; Loscalzo, J. S-nitrosoprotein formation and localization in endothelial cells. Proc. Natl. Acad. Sci. U S A, 2005, 102 (1), 117-122.
- Steffen, M.; Sarkela, T. M.; Gybina, A. A.; Steele, T. W.; Trasseth, N. J.; Kuehl, D.; Giulivi, C. Metabolism of Snitrosoglutathione in intact mitochondria. Biochem. J., 2001, 356 (Pt 2), 395-402.
- Foster, M. W.; Hess, D. T.; Stamler, J. S. Protein S-nitrosylation in health and disease: a current perspective. Trends Mol. Med., 2009, 15 (9), 391-404.
- Askew, S. C.; Barnett, D. J.; McAninly, J.; Williams, D. L. H. Catalysis by Cu2+ of nitric oxide release from Snitrosothiols (RSNO). J. Chem. Soc., Perkin Trans., 1995, 2 (4), 741-746.
- Field, L.; Dilts, R. V.; Ravichandran, R.; Lenhert, P. G.; Carnahan, G. E. An unusually stable thionitrite from Nacetyl- D,L-penicillamine; X-ray crystal and molecular structure of 2-(acetylamino)-2-carboxy-1,1- dimethylethyl thionitrite. J. Chem. Soc., Chem. Commun. 1978, 6, 249-250.
- Perissinotti, L. L.; Estrin, D. A.; Leitus, G.; Doctorovich, F. A surprisingly stable S-nitrosothiol complex. J. Am. Chem., Soc 2006, 128 (8), 2512-2513.
- Looker, D. L.; Beyer, W. F. S-NITROSOTHIOL FORMULATIONS AND STORAGE SYSTEMS, Patent Treaty Cooperation WO 2008/153762A2, May 25 2007
- Williams, D. L. H. The Chemistry of S-Nitrosothiols. Acc. Chem. Res., 1999, 32 (10), 869-876.
- Heikal, L.; Martin, G. P.; Dailey, L. A. Characterisation of the decomposition behaviour of S-nitrosoglutathione and a new class of analogues: S-Nitrosophytochelatins. Nitric Oxide, 2009, 20 (3), 157-165.
- Hurley, K. P.; Bovet, L. L.; Stamler, J. S. Stable SNitrosthiol Formulations Patent Treaty Cooperation WO 2007/076053A2, December 21. 2005.
- Yoo, J. W.; Acharya, G.; Lee, C. H. In vivo evaluation of vaginal films for mucosal delivery of nitric oxide. Biomaterials, 2009, 30 (23-24), 3978-3985.
- Seabra, A. B.; Pankotai, E.; Feher, M.; Somlai, A.; Kiss, L.; Biro, L.; Szabo, C.; Kollai, M.; de Oliveira, M. G.; Lacza, Z. S-nitrosoglutathione-containing hydrogel increases dermal blood flow in streptozotocin-induced diabetic rats. Br. J. Dermatol., 2007, 156 (5), 814-818.
- Furchgott, R. F.; Ehrreich, S. J.; Greenblatt, E. The photoactivated relaxation of smooth muscle of rabbit aorta. J. Gen. Physiol., 1961, 44, 499-519.
- Salas, E.; Langford, E. J.; Marrinan, M. T.; Martin, J. F.; Moncada, S.; de Belder, A. J. S-nitrosoglutathione inhibits platelet activation and deposition in coronary artery saphenous vein grafts in vitro and in vivo. Heart, 1998, 80 (2), 146-150.
- de Belder, A. J.; MacAllister, R.; Radomski, M. W.; Moncada, S.; Vallance, P. J. Effects of S-nitroso-glutathione in the human forearm circulation: evidence for selective inhibition of platelet activation. Cardiovasc. Res., 1994, 28 (5), 691-694.
- MacAllister, R. J. Calver, A. L. ; Riezebos, J. ; Collier, J. ; Vallance, P., Relative potency and arteriovenous selectivity of nitrovasodilators on human blood vessels: an insight into the targeting of nitric oxide delivery. J. Pharmacol. Exp. Ther., 1995, 273 (1), 154-160.
- Kaposzta, Z.; Baskerville, P. A.; Madge, D.; Fraser, S.; Martin, J. F.; Markus, H. S. L-arginine and S-nitrosoglutathione reduce embolization in humans. Circulation, 2001, 103 (19), 2371-2375.
- Rassaf, T.; Kleinbongard, P.; Preik, M.; Dejam, A.; Gharini, P.; Lauer, T.; Erckenbrecht, J.; Duschin, A.; Schulz, R.; Heusch, G.; Feelisch, M.; Kelm, M. Plasma nitrosothiols contribute to the systemic vasodilator effects of intravenously applied NO: experimental and clinical Study on the fate of
- Lees, C.; Langford, E.; Brown, A. S.; de Belder, A.; Pickles, A.; Martin, J. F.; Campbell, S. The effects of Snitrosoglutathione on platelet activation, hypertension, and uterine and fetal Doppler in severe preeclampsia. Obstet. Gynecol., 1996, 88 (1), 14-19.
- Kaposzta, Z.; Clifton, A.; Molloy, J.; Martin, J. F.; Markus, H. S. S-nitrosoglutathione reduces asymptomatic embolization after carotid angioplasty. Circulation, 2002, 106 (24), 3057-3062.
- Langford, E. J.; Brown, A. S.; Wainwright, R. J.; de Belder, A. J.; Thomas, M. R.; Smith, R. E.; Radomski, M. W.; Martin, J. F.; Moncada, S. Inhibition of platelet activity by S-nitrosoglutathione during coronary angioplasty. Lancet, 1994, 344 (8935), 1458-1460.
- Ramsay, B.; Radomski, M.; De Belder, A.; Martin, J. F.; Lopez-Jaramillo, P. Systemic effects of S-nitrosoglutathione in the human following intravenous infusion. Br. J. Clin. Pharmacol., 1995, 40 (1), 101-102.
- Seabra, A. B.; Fitzpatrick, A.; Paul, J.; De Oliveira, M. G.; Weller, R. Topically applied S-nitrosothiol-containing hydrogels as experimental and pharmacological nitric oxide donors in human skin. Br. J. Dermatol., 2004, 151 (5), 977-983.
- Snyder, A. H.; McPherson, M. E.; Hunt, J. F.; Johnson, M.; Stamler, J. S.; Gaston, B. Acute effects of aerosolized S-nitrosoglutathione in cystic fibrosis. Am. J. Respir. Crit. Care. Med., 2002, 165 (7), 922-926.
Hornyák István
Klinikai Kísérleti Kutató és Humán Élettani Intézet
1094, Budapest, Tűzoltó utca 37-47.
E-mail: Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2010/4. 55-59. oldal


