A szerzők 12 aorta és 12 pulmonális szívbillentyű immunhisztokémiai feldolgozását végezték el. A vizsgálat célja a különböző sejtek megoszlásának és sűrűségének megfigyelése volt a billentyűk egyes rétegeiben. Megállapították, hogy a billentyűk szöveteiben a kollagén mátrixot termelő fibroblastok előfordulása a leggyakoribb. E sejtek a billentyűk mindhárom szövettani rétegében előfordultak. Sűrűségük fokozatosan csökkent a basalis régiótól az apiealis régió irányába. A sejtek előfordulási gyakoriságában a maerofágok álltak a következő helyen. Alakjukat könnyen változtatják, felismerésüket az immunhisztokémiai módszer azonban egyértelművé tette. Megjelenésük multifocalis jellegű volt, amely fokozatosan csökkent a billentyű basalis része felől az apiealis rész irányába. Kevés simaizom- és Langerhans-sejtet sikerült kimutatni. T- lymphoeitát nem találtak. A sejtek sűrűsége és megoszlása szempontjából a nemek és a korcsoportok között lényeges különbséget nem észleltek.
Érbetegségek: 1996/4. 1-4. oldal
KULCSSZAVAK
aorta billentyű, pulmonális billentyű, sejtsűrűség, sejtmegoszlás, immunhisztokémia
Bevezetés
A humán szívbillentyű szívsebészeti eljárásokban történő alkalmazása iránt egyre fokozódó igény a szövet morfológiájának pontosabb megismerését teszi szükségessé. A szívbillentyűszövetet gyűjtő és tároló szövetbankok világszerte egyre szigorúbb kövtelményeket támasztanak a beültetésre kerülő szövetek vizsgálatával szemben.
Hazai viszonylatban Budapesten az Országos Kardiológiai Intézetben és a Szegedi Orvostudományi Egyetemen foglalkoznak szívbillentyű homograftok előállításával. Évente átlagosan 50-60 szívbillentyű homograft kerül felhasználásra a különböző szívsebészeti beavatkozások során. A humán szívbillentyűszövetben fellelhető különböző sejtek rutin hisztokémiai eljárással történő azonosítása és differenciálása gyakran nehéz feladatnak ígérkezik a sejtek morfológiájának hasonlósága miatt. Az immunhisztokémiai módszer alkalmazása jóval precízebb morfológiai elemzéshez nyújt segítséget.
Az immunhisztokémíai módszer széles körű elterjedése lehetővé tette, hogy fibroblastokat anti-vimentin, makrofá- gokat anti CD68, sima izomsejteket anti-alfa actin, endothel sejteket anti-factor VIII., Langerhans sejteket anti-S lOO, T-lymphocytákat anti-CD3 antitestekkel vizsgáljunk.
A speciális morfológiai eljárásokkal elemezhetjük az egyes sejtféleségek előfordulását a szívbillentyűk különböző szövettani rétegeiben, figyelemmel a nemre, életkorra és a billentyű típusára is.
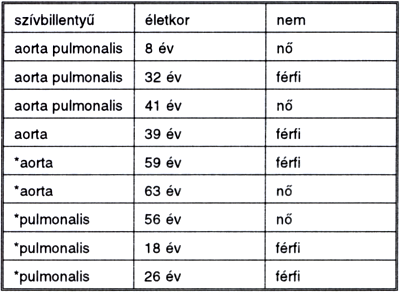
1. táblázat. *-gal jelölve: fagyasztva tárolás után felhasznált szívbillentyű.
Anyag és módszertan
Vizsgálataink során 12 aorta és 12 pulmonális szívbillentyűt dolgoztunk fel. A szívbillentyűket szervdonorok és szívátültetésen átesett egyének szívéből távolítottuk el. 5 szívbillentyű (2 aorta és 3 pulmonális) fagyasztva tárolás után került feldolgozásra, mivel tapasztalataink arra utalnak, hogy a fagyasztásí és felolvasztási eljárás a billentyűk morfológiáját nem befolyásolja. Ezeket a billentyűket antibiotikum koktélban fertőtlenítettük, majd TCM-100 oldatban 10%-os DMSO (dimethylsulfoxide) hozzáadásával -100 °C-ig fagyasztottuk. A fagyasztást számítógépes program irányította oly módon, hogy a gyorsfagyasztó készülék kamrájában -1 °C / perc volt a hőmérsékletcsökkenés -40 °C-ig, majd -5 °C / perc -100 °C-ig. Ezt követően a billentyűket folyékony nitrogén fölötti gőzlégtérben tároltuk -150 °C- on. (1. táblázat.) Az ún. postischemias idő minden esetben elhanyagolható volt. A billentyűkből a keringés irányával párhuzamosan hosszanti keresztmetszeteket készítettünk a nodulusokkal egy síkban. A szöveteket 4-6 órára Bouin fixálóba helyeztük, paraffinba ágyaztuk. A metszeteket poly- L-lysinnel bevont tárgylemezre helyeztük, majd az alábbiak szerint az immunoperoxidáz módszert alkalmaztuk Strepta- vidin-Biotin jelöléssel. A deparaffinálást követően az endogén peroxidázgátlást 10%-os hidrogénperoxiddal végeztük deionizált vízben 30 percig. Öblítésre Tris HCL PH 7,4; 0,05 M (TBS) pufferoldatot használtunk. Az aspecifikus reakciók gátlását 1/100 hígításban normál kecske szérummal (NGS) és 1% szarvasmarha szérum-albuminnal végeztük 30 percig. A primer antitesteket az alábbi hígításban alkalmaztuk és inkubáltuk 4 °C-on 12 óráig: anti-vimentin (DAKO) 1/50, anti-alfa actin (ENZO, USA) 1/100, anti-CD68 (DAKO) 1/50, anti-CD3 (DAKO) 1/2000, anti-factor VIII. (DAKO) 1/1000, anti-protein S100 (DAKO) 1/2000. Tris pufferoldattal történő öblítés után a másodlagos antitesteket az alábbi hígításokban alkalmaztuk és inkubáltuk szobahőmérsékleten 30 percig: monoclonalis anti-egérsavó (BOEHRIN- GER-M ANNHEIM) 1/500, polyclonalis anti-nyúlsavó (BOEHRINGER-MANNHEIM) 1/500. A monoclonalis rendszerben az aspecifikus reakciókat 10%-os tejjel gátoltuk, majd a metszeteket Tris pufferoldattal öblítettük. A streptavidin-POD conjugatumot (BOEHRINGER-MANNHEIM) 1/100 hígításban alkalmaztuk és inkubáltuk szobahőmérsékleten 30 percig. A megjelenítéshez (DAB) Diam- nino-benzidint (SIGMA) használtunk. 0,05 g DAB-ot hígítottunk 100 ml Tris pufferoldattal, majd hozzáadtunk további 30 µ/l 30%-os hidrogénperoxidot. 7-10 percig inkubáltuk az anyagot szobahőmérsékleten, majd vízzel állítottuk meg a reakciót és Mayer's Hematoxylin háttérfestés után permanens médiumba (PERTEX) ágyaztuk. Kontrollként nyirokcsomó, érfal- és szívizomszövetet alkalmaztunk. CARL ZEISS fénymikroszkóppal vizsgálva, szubjektív szemikvantitív módszer alkalmazásával igyekeztünk a különböző sejtek megoszlását és sűrűségét megfigyelni az aorta és pulmonális szívbillentyűk szövettani rétegeiben, tekintettel a nemre és az életkorra is.
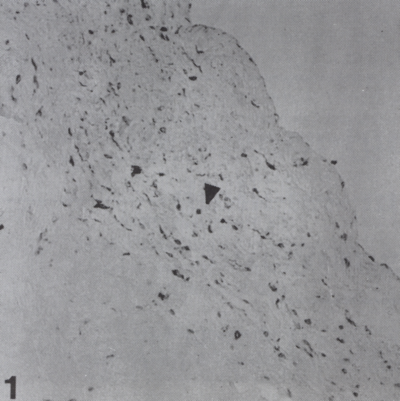
1. ábra.
Anti-vimentin pozitív fibroblast sejtek a fibrosában (25x).
Eredmények
Immunhisztokémiai vizsgálattal - az elvásároknak megfelelően - az anti-vimentin pozitív fibroblastok előfordulása bizonyult a leggyakoribbnak a szívbillentyűk szöveteiben.
Sűrűségük fokozatosan csökkent a billentyűk basalis régióitól az apicalis rész irányába. Ezen sejtek a billentyűk mindhárom szövettani rétegében jelen voltak, ezért nehéz volt megítélni, hogy mely rétegben gyakoribb az előfordulásuk. A vizsgált billentyűk nagyobb hányadában a fibroblastok sűrűsége a spongiosában fokozottabbnak bizonyult, ellentétben a ventricularis és fibrosa rétegekkel (1. ábra).
Anti-actin pozitív simaizomsejtek előfordulását elvétve észleltük a billentyűszövetben. Főként a ventricularis réteg basalis régióiban mutattak enyhe pozitivitást. Néhány antifaktor VIII. endothel sejtet figyeltünk meg, főleg a ventricularis réteg marginalis részén. Erős pozitivitást csak a billentyűtasakok mögötti érfal endothel bélelése mutatott.
A billentyűszövetben a második leggyakoribb sejtféleség a fibroblastok után a macrofág. Az anti-CD68 ellenanyaggal erős pozitivitást mutattak, főleg a ventricularis marginalis részein, ugyanakkor a spongiosában és a fibrosában is nagy számban voltak felismerhetők. Megjelenésük multifocalis jellegű volt, ami fokozatosan csökkent a billentyű basalis részétől az apex irányába. Egyes macrofág sejtek fusiform alakúnak, míg többségük kereknek mutatkozott. (2. ábra.) Gyenge pozitivitását tapasztaltunk az anti S-100 proteinnel, három aorta és két pulmonális szívbillentyű esetében. A Langerhans sejtek igen kis számban voltak fellelhetők, főként a ventricularis basalis részén. Az anti-CD3 ellenanyaggal negatív eredményt kaptunk. A billentyűkben T-lymphocyta nem volt kimutatható. A sejtek megoszlása hasonlónak bizonyult mind az aorta, mind a pulmonális billentyűkben. A pulmonális szívbillentyű sejt- sűrűsége minimális különbséget mutatott. E tekintetben főleg a fibroblastok száma volt kevesebb, mint az aorta billentyűk szövetében. A sejtek sűrűsége és megoszlása szempontjából jelentős különbséget nem tapasztaltunk a különböző korcsoportok és nemek között.
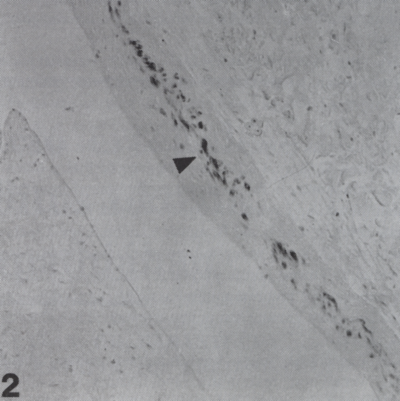
2. ábra.
Anti-CD68 pozitív macrofág sejtek a ventricularisban (25).
Megbeszélés
A szívbillentyűk vizsgálatára alkalmazott immunhisztokémiai módszerek a sejtek megoszlásának és sűrűségének pontos meghatározását teszi lehetővé, ellentétben a rutin hisztológiai festésekkel. A fibroblastok szerepet játszanak a billentyűszövet collogén matrixának termelésében. Elvárásainkat igazolta, hogy a fibroblast sejtek képezik a legnagyobb sejtpopulációt a billentyűszövetben (5, 6, 7). Megoszlásuk hasonló mindkét billentyűszövet rétegeiben. Sűrűségük - összehasonlítva az aorta billentyűvel - kevesebbnek mutatkozik a pulmonális billentyűkben, ami feltehetően a szövettani rétegek relatíve vékonyabb jellegével magyarázható (7, 9, 12).
A macrofágok megoszlása a billentyűszövetben hasonló a fibroblastokéhoz a tekintetben, hogy számuk fokozatosan csökken az apex irányába. A sejtek sűrűsége főleg ventricularisan számottevő. Gyakori fusiform megjelenésük megnehezíti felismerésüket a hagyományos szövettani festések alkalmazásakor, mert könnyen összetéveszthetők a simaizomsejtekkel és a fibroblastokkal. A macrofágok fokozott migrációs készséggel rendelkező sejtek, ami magyarázatot adhat a billentyűkben való megjelenésükre (8). Ezen tulajdonságuk alapján származhatnak a környező szövetekből, vagy akár a véráramból is. A másik magyarázat megjelenésükre a billentyűk funkcionális aspektusával függ össze, miszerint a billentyűk gyors nyitó-záró működése során keletkezett mikrotraumák vonzó hatása érvényesülhet a macrofágokra (1, 8).
A rutin szövettani festésekkel végzett vizsgálatokkal összehangban, simaizomsejtek csak kis számban fordulnak elő, főleg a billentyű basalis részének ventricularis rétegében (5, 10).
A billentyűk endothel borítása csak a basalis régiókban ismerhető fel. Ezek a sejtek egy rétegben borítják a billentyűk széli részét, és feltehetően a preparáláskori maceratio miatt válnak le. További elősegítője a sejtek leválásának a halál utáni ischemias idő is, annak ellenére, hogy a tanulmányban felhasznált anyagok esetében ez elhanyagolhatóan rövid volt. Vitatott kérdés jelenlétük szükségessége, mivel az endothel sejt fokozott antigenitással bír, és a szívbillentyűk beültetése közismerten immunszupresszió nélkül történik (2, 11).
A Langerhans sejtek szervátültetések esetén fellépő "graft versus host" reakció résztvevői lehetnek, így a billentyűkön való jelenlétük figyelemre méltó, annak ellenére, hogy erre magyarázatot nem találtunk. T-lymphocyták nem lelhetők fel a billentyűk szövetében (3, 4). A sejtek sűrűségében számottevő különbség nem mutatkozik a nemek és a korcsoportok között. Ezt a megfigyelést valószínűleg az egyébként alacsony esetszám is befolyásolja.
Tapasztalataink arra utalnak, hogy a szövetbankokban alkalmazott preparálási módszerek és a kriobiológia fejlődésével a graftok morfológiája gyakorlatilag megegyezik az élő szövetével. A tanulmányban a tárolási eljáráson keresztül esett billentyűk morfológiája nem mutat különbséget az ún. "friss" szövetekhez képest.
Irodalom
- Angel, W. W. et al: Durability of the Viable Aortic Allograft. J. Thorac. Cardiovasc., 1989., 98: 48-56.
- Armiger, L. C. et al: Histological Assessment of Orthotopic aortic Valve Leaflet Allografts: Its Role in Selecting Graft Pretreatment. Pathology, 1983., 15: 67-73.
- Fox, S. B. et al: Langerhans Cell in Humán Lung Tumors: an Immunhistological Study. Histopathology, 1989., 14: 269-275.
- Gatter, K. C. et al: Langerhans Cells and T-cells in Humán Skin Tumors: an Immunhistological Study. Histopathology, 1984., 8: 229-244.
- Gavin, J. B. et al: Histopathology of Fresh Humán Aortic Valve Allografts. Thorax, 1973., 28: 473-487.
- Gavin, J. B. et al: Pathology of Antibiotic Treated Humán Heart Valve Allografts. Thorax, 1973., 28: 473-481.
- Gross, L. et al: Topographic Anatomy and Histology of the Valves in the Humán Heart. Anatomy and Histology of Valves in Heart. 1931. Pp. 445-471.
- Johnston, R. B. Jr.: Monocytes and Macrophages. The New England Journal of Medicine, 1988., 318: 747-752.
- Kay, Ph. et al: Pulmonary Homograft. In: Bodnár, E., Yaco- ub, M. eds: Biologic Bioprosthetic Valves. lst ed. New York: York Medical Books, 1986: 58.
- Kosek, J. C. et al: Morphology of Fresh Heart Valve Ho- mografts. Surgery, 1969., 66: 269-274.
- Sebested, M. et al: Factor VIII. Related Antigén as an En- dothelial Cell Marker in Benign and Malignant Diseases. Virchows Arch., Pathol. Anat. 1981., 391: 217-225.
- Waller, B. F.: Pathology of the Heart and Great Vessels. 1988. Chirchill Livingstone.
Dr. Szombathelyi Tibor
Semmelweis Orvostudományi Egyetem
Igazságügyi Orvostani Intézet
1450 Budapest, Pf. 9/41
Yves Goffin M. D.
European Homograft Bank
International Association, Belgium
Érbetegségek: 1996/4. 1-4. oldal


