A vékonybél erein a splanchnikus területen átáramló vérmennyiségnek a fele jut keresztül. Az összes véráramlás és egyes területek vérellátása fiziológiásán is tág határok között változik. A szövetek lokális véráramlásának szabályozásában részben az enterális idegrendszer, részben számos, helyileg keletkező vazo-aktív anyag elsősorban a munkahyperaemia kialakításában vesz részt. A központi idegrendszer a vérellátás szabályozásában leginkább a pere térfogat újraelosztása révén a vékonybélben jelentős érszűkületet hoz létre. Ez különösen fontossá válik a súlyos stresszel járó állapotokban, mint például vérkeringési sokkban, amikor is a szöveti hipoxia a mucosa károsodásához vezet. A kialakuló bélnyálkahártya-elhalás részben közvetlenül, részben közvetve (eiulotoxin, esetleg baktériumok transzlokációja következtében) az immunrendszer túlaktiválásához vezet, és ez a továbbiakban mind a vékonybélben, mind egyéb szervekben a szövetek további destrukcióját eredményezi. Mindezek a folyamatok a vérkeringési sokkra jellemző pozitív visszacsatolásos folyamatok felerősödését hozzák létre.
Érbetegségek: 1997/1. 1-6. oldal
KULCSSZAVAK
nyugalmi véráramlás, központi idegrendszer, munkahyperaemia, szöveti vérellátás, hipoxin
A vékonybél a splanchnikus érterület vérellátásában meghatározó szerepet játszik.
A splanchnikus terület szervein keresztül nyugalomban a perctérfogat 25%-a áramlik át. Ezt az értéket humán vizsgálatokban a Fick-elv alapján működő indikátor-kiválasztásos módszer segítségével már a negyvenes években megmérték (1). A splanchnikus területen összesen átfolyó vér mennyiségét a máj teljes vérellátásának a mérésével határozhatjuk meg. Nyugalomban az artéria hepatica 30, a vena portae 70%-ban vesz részt a szerv vérellátásában. A vena portae-n átfolyó vérnek több mint a fele (60-70%-a) a vékonybélből származik. Ez percenként 700-800 ml vérátfolyásnak felel meg, amely mind fiziológiás, mind kóros állapotokban jelentősen módosulhat. A legfontosabb fiziológiás állapotváltozások közül az emésztési időszakokban jelentkező munkahyperaemiát, az izommunkához és a fokozott hőleadáshoz való alkalmazkodást érdemes megemlíteni. Ez utóbbi állapotokban a perctérfogat redisztribűciójában a splanchnikus érterület jelentős szerepet játszik. A számos kóros állapot közül a fokozott bélszekrécióval együtt járó nagyfokú értágulatot és a súlyos stressz állapotokban jelentkező érszűkületet emeljük ki.
A vékonybél vérellátását számos idegi és humorális mechanizmus szabályozza.
A vékonybél több méter hosszú szerv, amely az étkezés utáni időszakban, attól függően, hogy a béltartalom összetétele az adott helyen hogyan változik, és az éppen melyik szakaszt ingerli leginkább, szakaszos (szegmentális) aktiválódást mutat. A funkciók, mint az emésztés, a szekréció és a felszívódás fokozódása természetesen a emunkahyperamia kialakulásának kedvez. Ez utóbbit mind az enterális idegrendszer, mind a lokálisan felszabaduló vazodilatátor anyagok szabályozzák. A témával kapcsolatban több fontos összefoglaló jelent meg, főképpen skandináv szerzőktől (2, 3, 4, 5, 6), akik elsősorban a neuronális hatásokat elemezték. A lokálisan keletkező értágulat kialakulásában az afferens neuronok fontos szerepét több szerző is hangsúlyozza (7, 8, 9).
A klasszikusnak számító hormonok vagy transzmitterek hatását a mezenteriális érterületen szintén leírták már. Ezek közül fontos a ß2 receptorok és a dopamin értágítő hatása (10, 11). Érszűkületet az al receptorok ingerlése (pl. a noradrenalin), az angiotenzin és a vazopresszin hozhatnak létre (12, 13, 14).
Az utolsó egy-két év irodalma szinte kizárólag a lokálisan felszabaduló, vagy ott keletkező vazoaktív anyagok érhatásaival foglalkozik. Ezek közül legfontosabbak az eikozanoidok (az arachidonsav származékok), a nitrogén monoxid (NO), az endotelin és számos peptid. A témával foglalkozó összefoglalóknak akár csak a felsorolása is messze meghaladná a jelen ismertetés célját és kereteit.
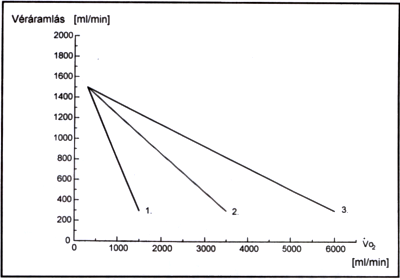
1. ábra.
A splanchnikus terület (a máj) véráramlása izommunkában. A véráramlás változását az izommunka mértékét jellemző oxigénfogyasztás függvényében láthatjuk. 1.: Szívbeteg, 2.: Normál fiatalember, 3.: Élsportoló.
A szövetek lokális (egy körülírt területre vonatkozó) vérellátásának szabályozásában elsősorban az adott bélszakaszban keletkező és felszabaduló vazoaktív anyagok játsszák a legfontosabb szerepet. Ez utóbbiak vagy a funkcióváltozást érzékelő vagy az azokat végrehajtó A szövetek lokális (egy körülírt területre vonatkozó) vérellátásának szabályozásában elsősorban az adott bélszakaszban keletkező és felszabaduló vazoaktív anyagok játsszák a legfontosabb szerepet. Ez utóbbiak vagy a funkcióváltozást érzékelő vagy az azokat végrehajtó sejtekben (esetleg neuronális elemekben) termelődnek, majd az adekvát ingerre onnan felszabadulnak, és az adott helyen parakrín módon fejtik ki a hatásukat. A felgyülemlett hatalmas ismeretanyag ellenére sem tudjuk még megállapítani, hogy az egyes élettani, főleg kóros körülmények között a számos lokális mechanizmus hogyan, és különösen milyen arányban vesz részt. A generalizált válaszokban, mint például az izommunkához való alkalmazkodásban főképpen a központi idegrendszeri, vagy az ún. hosszúpályás szabályozási mechanizmusok érvényesülnek.
A vékonybél véráramlásának központi idegrendszeri szabályozását elsősorban azok a mechanizmusok jelentik, amelyek a szimpatikus idegrendszeren keresztül érvényesülnek. A szimpatikus posztganglionáris rostok ingerlése a splanchnikus területen érszűkülethez vezet (15, 16). Hasonlóan vazokonstrikciót lehetett létrehozni a hypothalamus ingerlésével (17). Más agyi struktúrák ingerlése ugyanakkor az izomzatban érszűkülethez, a vékonybélben pedig kisebb fokú értágulathoz vezetett (18). Ez utóbbi megfigyelés arra utal, hogy az étkezési ingerhez kapcsolódóan akár kisebb mértékű idegrendszeri eredetű értágulat is kialakulhat a vékonybélben. Ennek ellenére a központi idegrendszer elsősorban a vérkeringés redisztribúciójának a szabályozásában vesz részt, és ez a hatás a splanchnikus árterületen érszűkületet jelent. Az 1. ábra jól érzékelteti azt, hogy különböző szervezetekben (sportolókban, normál fiatalokban és szívbetegekben) a vérkeringés hogyan alkalmazkodik az izommunkához. Mindhárom esetben a splanchnikus területen jelentős, azonos perfúziócsökkenéshez vezető érszűkület jön létre (19). Érdemes külön kiemelni azt is, hogy a nyugalmi szintet jelentő, kb. 1500 ml/perces véráramlás megközelítőleg az egyötödére csökken mindhárom esetben.
Az 1. táblázatban összefoglaltuk azokat a legfontosabb érszűkítő és értágító hatásokat, amelyek a mezenteriális keringés szabályozásában fontosak.

1. táblázat.
A vékonybél véráramlásának szabályozásában résztvevő fontosabb érszűkítő és értágító hatások.
A vékonybél vérellátásának mérésére számos módszer! alkalmaznak, de a humán vizsgálatokban egyik sem mondható ideálisnak.
A vékonybél vérellátásának mérésére alapvetően kétféle eljárást alkalmaznak. Az egyik az ellátó erek (leginkább az artéria mesenterica superior, AMS) összes vérátfolyását méri meg. A másik fő csoportot azok az eljárások képezik, amelyek közvetve vagy közvetlenül a szöveti véráramlást mérik. Az AMS vérátfolyásának a meghatározásával a teljes vékonybél összes véráramlását kapjuk meg anélkül, hogy a szövetek ellátásáról lenne információnk. Ezek a mérések elsősorban a perctérfogat elosztásának a meghatározásához fontosak. A szöveti vérellátás mérésére kidolgozott számos módszer segítségével egy kisebb bélszakasz és azon belül az egyes szövetek (mucosa, submucosa, vagy a muscularis réteg) vérellátását mérhetjük meg. A 2. táblázatban összefoglaltuk a legfontosabb mérő módszereket.
Állatkísérletekben bármelyik eljárást alkalmazhatjuk, és ezek segítségével pontos mérési adatokhoz juthatunk. A humán vizsgálatok azonban sokkal több nehézséggel járnak. A direkt mérések közül műtétek közben alkalmazhatjuk a véráramlásmérő (ultrahangos vagy elektromágneses) fejet. Egyéb invazív eljárások is számításba jöhetnek, mint például a Fick-elv alapján működő indikátor extrakciós módszer (1). Ebben az esetben azonban artériás és a szervet elhagyó vénás vérmintákat kell gyűjtenünk. Az állatkísérletekben sikerrel alkalmazott clearance módszereket humán fiziológiai mérésekre alig lehet felhasználni. Leginkább az indirekt mérési eljárások jönnek számításba. Ezek segítségével a szöveti vérellátásról nyerhetünk hasznos, de csak megközelítően pontos információkat. Ilyenek például a béllumenben végzett PO2, pH vagy potenciálkülönbség (PD) mérések. Az utóbbi időben kezd elterjedni a béllumenen belüli PCO2 tonometrián alapuló pH meghatározás, amely jó indikátora a csökkenő szöveti (mucosa) vérellátásnak (20, 21). A gyomor és a felső vékonybél, valamint a vastagbél szöveti véráramlásának a csökkenését lehet a módszerrel követni.
Újabban egyre több árterület véráramlás-változásainak a mérésére alkalmazzák az ultrahangos eljárást, amely igen fontos non invazív módszer. Ennek segítségével akár az AMS mellékágaiban is megmérhetjük a vörösvértestek lineáris áramlási sebességváltozásait. A módszer nagy előnye továbbá, hogy bármikor alkalmazható, ugyanakkor azonban csak a változások kimutatására alkalmas, mert abszolút mérőszámokat nem ad.

2. táblázat.
A vékonybél véráramlásának mérésére felhasználható fontosabb áramlásmérő módszerek. PD: feszültségkülönbség.
Tartós hipoxiával járó állapotokban (vérkeringési sokkban) a vékonybél vérellátása lecsökken, és a kialakuló bélkárosodás a sokkos állapotot tovább rontja.
A vérkeringési sokk egyik legfontosabb jellemzője a tartós szöveti hipoxia. Ez részben a sokkos állapotot legtöbbször ugyancsak jellemző alacsony perfúziós nyomás miatt, részben pedig a sokkos állapotnak különösen a kompenzációs szakaszában megfigyelhető keringési centralizáció miatt jön létre. Ebben a szakaszban a szív és az agy vérellátása többé-kevésbé megtartott, míg az egyéb árterületeken, a bőrben, az izomban, a vesében, a splanchnikus területen jelentós vazokonstrikció figyelhető meg. Az érösszehúzódás a keringési ellenállás fokozódásával jár (22, 23, 24). Jóllehet a vékonybél vérkeringését jellemző autoreguláció (25) a sokkos folyamat kezdetén még egy metabolikus autoregulációval is kiegészül (26, 27), végül a tartósan elégtelen szöveti vér- és oxigénellátás a bélnyálkahártya súlyos sérüléséhez vezet (28, 29, 30).
Felmerülhet a kérdés, hogy megállapítható-e az a kritikus vérellátási szint, amelyik már biztosan tartós szöveti károsodáshoz vezet. A fentiekben láthattuk, hogy az izommunkához való alkalmazkodás során a splanchnikus terület vérátfolyása akár a nyugalmi érték 20%-ára is csökkenhet (19). Hasonló szintű perfúziócsökkenés, ha az 60 percnél tovább tart, már a nyálkahártya elhalását hozza létre (31). Fiziológiás körülmények között - és az izommunka ilyen - egyrészt érvényesül az ún. "autoregulatory escape" mechanizmus (16, 32), másrészt a véráramláscsökkenés nem tart ilyen hosszú ideig.
A bélnyálkahártya elhalását legjobban a tartós ischaemiát követő reperfúziós kísérletekben lehet tanulmányozni (33, 34, 35, 36). Az ilyenkor kialakuló változások hasonlítanak azokhoz, amelyeket az ún. sokkos bélben találtak. A reperfúziós károsodás kórélettanának ismertetése meghaladja jelen összefoglaló kereteit. A folyamatok sematikus összefoglalását a 2. ábra mutatja.
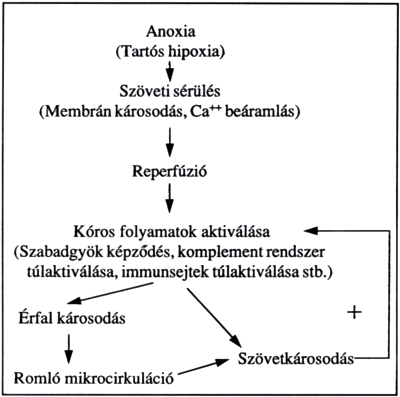
2. ábra.
A vékonybél reperfúziós károsodásának kialakulása. A nyilak az események sorrendiségét tüntetik fel. A + visszajelzés a kóros circulus vitiosus kialakulását jelenti.
A splanchnikus területnek, mint a vérkeringési sokk patogenezisében fontos szerepet játszó árterületnek a jelentőségét már korán felismerték (37). A számos kórélettani folyamat közül érdemes kiemelni a baktériumok és a bakteriális endotoxin transzlokációjának (38, 39, 40), a károsodon nyálkahártyában az immunsejtek aktiválódásának (41, 42), továbbá az aktivált immunsejtekből nagy mennyiségben felszabaduló sokk-mediátoroknak a (43, 44. 45) szerepét. Mindezek végül is a sokkos folyamat további progressziójához vezetnek: circulus vitiosus alakul ki. A 3. ábrán láthatjuk a legfontosabb események összefoglalását.
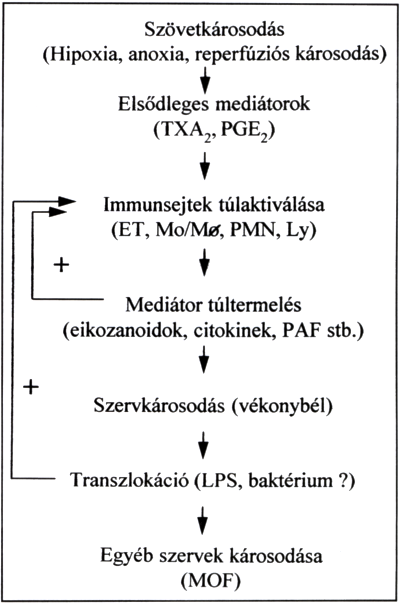
3. ábra.
A vérkeringési sokk kialakulásának vázlata. A nyilak az események sorrendiségére utalnak. A + jel az öneró'sító' visszajelzést jelenti.
TXA2: tromboxán, GE2: prosztaglandin, ET: endothel sejt, Mo/Mo: monocita/makrofág, PMN: granulocita, Ly: limfocita, PAF: platelet activating factor, LPS: bakteriális endotoxin, MOF: multi organ failure.
Irodalom
- Bradley, S. E, Ingelfinger, F. .J. Bradley, G. P, and Curry ,.J. .J. (1945.): The estimation of hepatic blood flow in man. J. Clin. Invest. 24. 890-897.
- Lundgren, O. (1967.): Blood Flow Distribution and Counter- currant Exchange in the Small Intestine. Acta Physiol. Scand. Suppl. 303.
- Biber, B. (1973.): Vasodilator mechanisms in Ihe small intestine. Acta Physiol. Scand. Suppl. 401
- Gastrointestinal and liver circulations. (1971.) In: Folkow B., Neil, E.: Circulation pp. 466-493. Oxford University Press. London, Toronto.
- Svanvik, .J. (1973.): Mucosal blood circulation and its influence on passive absorption in the small intestine. Acta Physiol. Scand. Suppl. 385.
- Lundgren, O., Svanvik, .J., Jivegard, .J. (1989.): Enteric Nervous System I. Physiology and Pathophysiology of the In- testinal Tract. Dig. Dis. Sci. 34. 264-283.
- Miller, V. M. (1991.): Interactions between neural and endothelial mechanisms in control of vascular tone. N1PS. 6. 60- 64.
- Maggi, C. A. (1991.): The pharmacology of the efferent function of the sensory nerves. J. autonom. Pharmacol. 11. 173-208.
- Rózsa Zs., Sharkey, K. A., Jancsó G" Varró V. (1986.): Evidence for a role of capsaicin-sensitive mucosal afferent nerves in the regulation of mesenteric blood flow in the dog. Gastroenterology. 90. 906-910.
- Karnpp, M" Lundgren, ()., Sjöstrand, ./. (1968.): The distribution of intravascularly administered lipid soluble and insoluble substances in the mucosa and the submucosa of the small intestine of the cat. Acta Physiol. Scand. 72. 469- 480.
- Dobi I., Kékesi V. (1989.): Factors influencing the vascular action of dopamine in the canine mesenteric bed. Acta Chirurg. Hung. 30. 251-20.
- Selkurt, E. E" Scibetta, M. P., Cull, T. E. (1958.): Hemodynamics of intestinal circulation. Circ. Res. 6. 92-99.
- Jonsson, ()., Svanvik, .J., Vikgren, P. (1967.): Régiónál differences in vascular tachiphylaxis to angiotensin in the cat. Angiologica 4. 299-309.
- Dresel, P., Wallentin, 1. (1966.): Effect of sympathetic vasoconstrictor fibers, noradrenaline and vasopressine on the intestinal vascular resistance during constant blood flow or blood pressure. Acta Physiol.Scand. 66. 4727-436.
- Folkow, B., Lewis, D. H., Lundgren, ()., Mellander, S., Wallentin, I. (1964.): The Effect of graded vasoeonstrictor fibre stimulation on the intestinal resistance and capacitan- ce vessels. Acta Physiol. Scand. 61. 445-457.
- Baker, R., Mendel, D. (1967.): Somé observations on the "autoregulatory escape" in cat intestine. J. Physiol. 190. 229-240.
- Cobbold, A., Folkow, B., Lundgren, O., Wallentin, 1. (1964.): Blood flow, capillary filtration coefficient and régiónál blood volume responses in the intestine of the cat during stimulation of the hypothalamic defence" area. Acta Physiol. Scand. 61. 467-475.
- Folkow, B., Rubinstein, E. H. (1965.): Behavioural and au- tonomic patterns evoked by the stimulation of the lateral hypothalamic area in the cat. Acta Physiol. Scand. 65. 292- 299.
- Rowell, L. B., Blackmon, .J. B., Bruse, R. A. (1964.): Indocyanine green clearance and estimated hepatic blood flow during mild and maximai exercise in upright man. J. Clin. Invest. 43. 1677-1690.
- Fiddian-Green, R. G., McGough, E, Pittenger, G., Rotliman, E. (1983.): Predictive value of intramural pH and other risk factors for massive bleeding from stress ulcerati- ons. Gastroenterology 85. 613-620.
- Bass, B. L, Seliweitzer, E. .J., Harmon, J. W., Kramer, J. (1985.): Intramural PCO2: a reliable indicator of intestinal ischemia. J. Surg. Res. 39. 351-360.
- Selkurt, E. E., Brecher, G. A. (1956.): Splachnic hemodynamics and oxigén consumption during hemorrhagic shock in the dog. Circ. Res. 4. 693-704.
- Haglund, U. (1973.): The small intestine in hypotension and hemorrhage. Acta Physiol. Scand. suppl. 387.
- Hamar J., Gergely M., Nyári L, Kovách A. G. B. (1972.): Adv. Exper. Med. Biol. 33. 313-321.
- Johnson, P. C. (1960.): Autoregulation of intestinal blood flow. Am. J. Physiol. 199. 311-318.
- Hamar .J., Ligeti L., Kovách A. G. B., Tkachenko, B. I., Ovsjcmnikov, V. I., Tcherniavskaja, G. V. (1978.): Blood supply and O2 consumption of the small intestine in low flow. Acta Physiol. Acad. Sci. Hung. 52. 381-390.
- Hamar J., Polenov S. A., Tcherniavskaja, G. V., Berezina, T. P., Dézsi L. (1981.): Effect of hypoxia on microcirculation and energy supply of the small intestine in cats. In: Adv. Physiol. Sci. 25. Oxygen Transport to Tissue. AGB Kovách, E Dóra, M Kessler, IA Silver (eds.) pp. 173-174. Akadémiai Kiadó, Pergamon Press.
- Fine, .J. (1967.): The intestinal circulation in shock. Gastroenterology. 52. 454-460.
- Lillehei, R. C., Longerbeam, .J. K., Rosenberg, .J. C. (1962.): The nature of irreversible shock: its relationships to intestinal changes. In: Block KD (ed.) Shock: Pathogenesis and Therapy. pp. 106-129. Springer Verlag. Berlin, Göttingen. Heidelberg.
- Áhrén, C" Haglund, U. (1973.): Mucosal lesions in the small intestine of the cat during low flow. Acta Physiol. Scand. 88. 541-550.
- Haglund, U. (1993.): Hypoxic damage. In: Pathophysiology of Shock, Sepsis, and Organ Failure. G. Schlag, H. Redl (eds.) pp. 314-321. Springer Verlag. Berlin, Heidelberg, New York, London, Paris, Tokyo, Hong Kong, Barcelona, Budapest.
- Folkow, B., Lewis, D. H., Lundgren, ()., Mellander, S., Wallentin. 1. (1964.): The effect of graded vasoeonstrictor fibre stimulation on the intestinal resistance and capacitan- ce vessels. Acta Physiol. Scand. 61. 445-457.
- Parks, D. A., Granger, D. N. (1986.): Contribution of ischemia and reperfusion to mucosal lesion formation. Am. J. Physiol. 250. G749-G753.
- Park, P. O., Haghund, U., Bulkley, G. B" Fält, K. (1990.): The sequence of development of intestinal tissue injury after strangulation and reperfusion. Surgery 107. 574-580.
- Illyés G., Hamar .J. (1992.): Sequence of morphological alterations in a small intestinal ischemia/reperfusion model of the anesthetized rat. A light microscopy study. Int. J. Exp. Pathol. 73. 161-172.
- Boros M., Takaichi, S" Hatanaka, K., Nagy S. (1995.): The relationship of ischemia- and reperfusion-induced mucosal lesions following complete arterial occlusion in the small intestine. Shock. 3. Suppl. 59.
- Fine, J., Frank, E. D., Ravin, H. A., Rutenburg, S. H., Schweinburg, F. B. (1959.): The bacterial factor in traumatic shock. New Eng. J. Med. 260. 214-220.
- Fine, J., Palmerio, C., Rutenburg, S. (1968.): New development in therapy of refractory traumatic shock. Arch. Surg. 96. 163-175.
- Deitch, E. A., Berg, R., Specian, R. (1987.): Endotoxin promotes the translocation of bacteria from the gut. Arch. Surg. 122. 185-190.
- Fink, M. P. (1991.): Gastrointestinal mucosal injury in experimentál models of shock, trauma, and sepsis. Crit. Care Med. 19. 627-641.
- Otamiri, T. (1989.): Oxygen radicals, lipid peroxidation, and neutrophil infiltration after small-intestinal ischemia and reperfusion. Surgery. 105. 593-597.
- Zimtnerman, B. J., Amdt, H., Kubes, P., Kurtel, H., Granger, D. N. (1993.): Reperfusion injury in the small intestine. In: Pathopysiology of Shock, Sepsis, and Organ Failu- re. G. Schlag, H. Redl (eds.) pp. 322-335. Springer Verlag. Berlin, Heidelberg, New York, London, Paris, Tokyo, Hong Kong, Barcelona, Budapest.
- Lefer, A. M. (1978.): Properties of cardioinhibitory factors produced in shock. Fed. Proc. 37. 2734-2740.
- Filep .J., Herman F., Braquet, P" Mózes T. (1989.): Increased levels of piatelet-activating factor in blood following intestinal ischemia in the bog. Biochem. Biophys. Res. Comm. 158. 353-359.
- Redl, H., Schlag, G., Bahrami, S., Davies, J., Waage, A., Ceska, M., Buurman, W. A., Adolf, G. (1993.): The cytoki- ne network in trauma and sepsis I: TNF and IL-8. In: G. Schlag, H. Redl (eds.) Pathophysiology of Shock Trauma, and Sepsis. pp. 468-490. Springer Veri. Berlin. Heidelberg, New York, London, Paris, Tokyo. Hong Kong, Barcelona, Budapest.
Dr. Hamar János
Országos Traumatológiai Intézet
1081 Budapest, Fiumei út 17.
Érbetegségek: 1997/1. 1-6. oldal


