Az agyi aneurizmák kialakulása, valamint ruptúrájuk bekövetkezésének oka még napjainkban sem tisztázott, ezért műtétből és kadaverekből származó agyi aneurizmazsákok biomeehanikai tulajdonságait vizsgáltuk. Hosszanti és körkörös csíkokat vágtunk az ér vastagabb (az aneurizmazsák nyakához közeli) és vékonyabb (ruptúrához közeli) részéből. Kadaverekből származó artéria cerebri médiát használtunk hosszanti, és artéria basilarist körkörös kontroll csíkok preparálására. A 3 mm hosszú csíkokat két végükön rögzítve, 2 percenként 200 mikrométeres lépésekben hirtelen meghúztuk, miközben az erőt folyamatosan mértük. Számítógép segítségével meghatároztuk a viszkoelasztikus paramétereket (soros, párhuzamos elasztikus modulus, viszkozitási együttható), valamint a szakítási szilárdságot. A regisztrált stressz relaxációs görbékre jól illeszthetők a Kelvin-féle szolíd viszkoelasztikus modell függvények. Eredményemk szerint a vastag csíkok szakítási szilárdsága mindkét irányban kisebb, mmt a megfelelő kontrolloké. A vékony csíkok szakítási szilárdsága hosszanti irányban szignifikánsan nagyobb a vastagokhoz képest, viszont körkörös irányban a vékony csíkok sokkal alacsonyabb megnyúlás érték mellett szakadnak el. Az egyes viszkoelasztikus paraméterek egymással párhuzamosan változnak: körkörös irányban a vékony és vastag csíkok koefficiensei szignifikánsan kisebbek a kontrollokhoz képest, hosszanti irányban pedig a vékony csíkok együtthatói szignifikánsan nagyobbak, mint a vastagoké.
Eredményeink alapján megállapítható, hogy az agyi aneurizmafal mechanikailag kevésbé ellenálló, mint az ép artéria szövet, ami valószínűleg a simaizomzat eltűnésének következménye. Ugyanakkor az érfal elvékonyodása nem jár a szakítási szilárdság csökkenésével mindkét irányban, ennek oka a kötőszöveti roststruktúra reorientációja lehet.
Érbetegségek: 1997/2. 1-12. oldal
KULCSSZAVAK
agyi aneurizma, artéria biomechanika, artéria basilaris, artéria cerebri média, elasztikus modulus, viszkoelaszticitás
Bevezetés
Az agyi aneurizmák kialakulása és ruptúrája biomechanikai szempontból a viszkoelasztikus paraméterek és a szakítási szilárdság függvénye (1, 2, 3, 4). Az aneurizma képződés okai között feltételezik a megváltozott véráramlás miatt megnövekedett nyíró feszültség hatását az endothelium sejtekre (5, 6), továbbá öröklött (7, 8, 9), vagy szerzett (7, 10, 11), illetve lokális (8, 12, 13), vagy generalizált (14, 15) artériafal gyengeséget. Az aneurizmás erek falában hemodinamikai erők hatására ébredő mechanikai erők az aneurizma növekedését, az érfal megvastagodását, ugyanakkor lokálisan az aneurizmazsák elvékonyodását és végül ruptúráját eredményezik (14, 15, 16, 17).
Az agyi aneurizmazsákok viszkoelasztikus tulajdonságainak részletes elemzése ezideig nem történt meg. Agyi aneurizmazsákok globális mechanikájával két publikáció foglalkozott. Roach és munkatársai az agyi aneurizmákban szférikus szimmetriát és homogén elasztikus tulajdonságokat tételeztek fel (3). A preparátum viszkoelasztikus tulajdonságait a szerzők nem határozták meg, bár jelentőségét kiemelték. A kiindulási megnyújtásnál a kontroll agyi artériákkal összehasonlítva csökkent rugalmasságot tapasztaltak, amely különbség nagyobb megnyújtásnál tovább növekedett. Az elasztikus modulus x falvastagság szorzatból számított mennyiség nem jellemzi egyértelműen az artériafal anyagának valódi rugalmasságát. Steiger és munkatársai későbbi munkájukban (4) agyi aneurizmazsákból származó csíkok mechanikai tulajdonságait tanulmányozták. Eredményeik szerint az aneurizmaszövet a kontrollal megegyező maximális megnyúlást sokkal kisebb szakítási szilárdságot mutatva ért el. Az aneurizmazsákot két részre - nyaki és alapi részre - osztották, azonban a különböző irányokban feltételezhető inhomogenitást nem tanulmányozták.
Az agyi aneurizma kialakulása, valamint a ruptúra bekövetkezés okainak mélyebb feltárása érdekében jelen vizsgálatainkban agyi aneurizmazsákból, valamint kontroll agyi artériák falából származó szövetcsíkok viszkoelasztikus tulajdonságait tanulmányoztuk a nyújtás függvényében. Az aneurizmafal inhomogenitásának, valamint a kötőszöveti rostok irányának figyelembevételével az aneurizma csíkokat négy csoportba soroltuk: hosszanti vastag és vékony, valamint körkörös vastag és vékony csíkokra. A csíkok kis mértékű, hirtelen - időben lépcsőszerű - megnyújtásra adott stressz-relaxációs válaszait regisztráltuk. Előkísérleteink eredményei szerint mind az agyi aneurizmaszövet, mind a kontroll erek viselkedése jól modellezhetők a Kelvin "standard" viszkoelasztikus modellel, amely egy viszkózus elemből és azzal sorosan, illetve párhuzamosan kapcsolt két elasztikus komponensből áll. A szövetpreparátumok elasztikus modulusainak és viszkózus együtthatóinak identifi- kálása ezért e modellek komputerizált alkalmazásával történt.
Vizsgálatainkban az alábbi kérdésekre kerestünk választ: Modellezhető-e célszerűen az aneurizmák stressz-relaxációs viselkedése a Kelvin modellel? Észlelhető-e összefüggés a modellben szereplő soros és párhuzamos rugalmas elemek modulusa, illetve a viszkózus koefficiens között? Van-e különbség a biomechanikai paraméterekben (szakítási szilárdság, az elasztikus és viszkózus modulusokban) az aneurizmazsák és a kontroll érfal között? Megfigyelhető-e az aneurizmazsák falában az aneurizmák hossztengelyével párhuzamos (körkörös) és arra merőleges (hosszanti) irányban különbség a mechanikai paraméterekben (sztérikus inhomogenitás)?
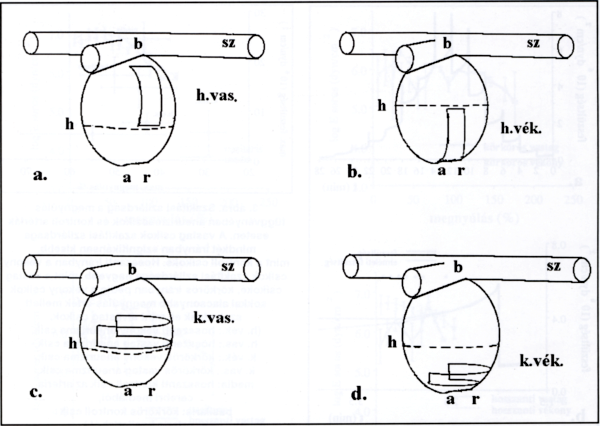
1. ábra.
A csíkok kimetszésének módja az agyi aneurizmazsákokból. a. hosszanti vékony csík, b. hosszanti vastag csík, c. körkörös vékony csík, d. körkörös vastag csík.
(b: bifurkáció, sz: szülő ér, a: apex, r: ruptúra helye, h: a vékony és a vastag csík közötti elméleti határ a metszés során.)
Metodika
Öt agyi aeurizmaruptúra következtében elhunyt friss kadaverből származó, valamint 16 műtét során eltávolított agyi aneurizmazsákot vizsgáltunk. A preparálás után az aneurizmákat azonnal hűtött nKR oldatba helyeztük, majd preparáló mikroszkóp segítségével csíkokat vágtunk a következőkben leírt módon. Az aneurizma zsákokat két részre osztottuk: vékonyabb részre, amely az apexhez (és általában a ruptúrához) közeli, és vastagabbra, amely az aneurizma nyakához (a bifurkációhoz) közeli rész. 1,5 mm széles és 6- 8 mm-es hosszanti (meridionális, az apex felé irányuló) és körkörös (cirkuláris, az aneurizma egyenlítőjével párhuzamos) csíkokat metszettünk, lehetőség szerint mindkét területről (1. ábra).
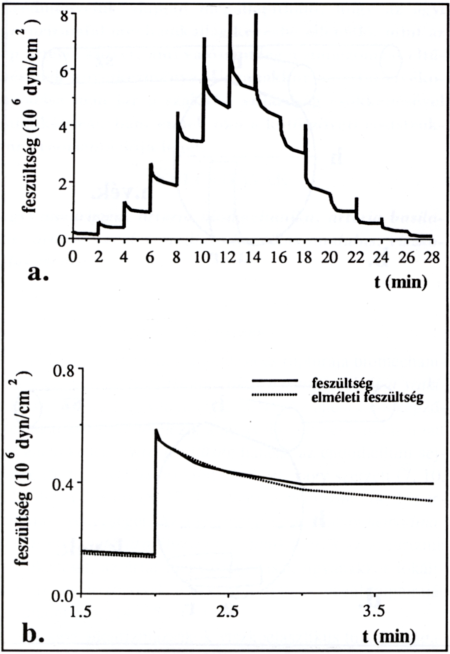
2. ábra.
A mechanikai teszt lépései. a. A kísérlet során regisztrált görbe. b. A számított görbe (modell) illeszkedése az eredeti (regisztrált) görbére
Kontrollként 8 nemben és korban illesztett, agyi érbetegségben nem szenvedő kadaver agyi artériából hasonló méretű csíkot metszettünk. Méretbeli és geometriai tulajdonságok, valamint az aneurizmák leggyakoribb előfordulási helye alapján és viszonylag oldalágmentes szakasz igényével az artéria cerebri médiát mint hosszanti, az artéria basilarist mint körkörös kontrollt választottuk. Összesen 7 hosszanti vastag, 8 hosszanti vékony, 7 körkörös vastag, 4 körkörös vékony aneurizma csík, valamint 9 artéria basilaris és 9 artéria cerebri média csík mechanikai tulajdonságait vizsgáltuk. A csíkokat 37 °C-os, oxigenizált (pH = 7,4) nKR oldatba helyeztük, és a 6-8 mm-ből 3 mm képezte a befogók között mért szakaszt. A szegmentumok kiindulási hosszát az éppen mérhető minimális terhelés (kb. 100 mg) mellett állítottuk be. A kísérlet során a csíkok hosszát kétpercenként mikrométercsavar segítségével 200 mikrométerrel hirtelen (<100 msec), lépcsőzetesen növeltük. A feszítőerőt nyúlásmérő bélyeges jelátalakítóval mértük, és Soltec 500sp Signal Processor segítségével a jeleket felerősítve folyamatosan regisztráltuk az idő függvényében.
A kalibráció a kísérlet elején és végén súlysorozattal történt. A csíkok tömegét a kísérlet végén mikromérleggel határoztuk meg. A szövet térfogatát 1,06 g/cm3-es fajsúllyal számoltuk.
A mechanikai teszt során mind az artériák, mind az agyi aneurizmák falából preparált csíkok jellegzetes viszkoelasz- tikus viselkedést (stressz relaxáció) mutattak. Egy jellemző kísérlet regisztrátuma látható a 2. ábrán. A stressz relaxációs görbéket a kalibrált regisztrátumról olvastuk le, majd EXCEL, MAPLEV és MATLAB programok segítségével végeztük el a számításokat. Előkísérleteink szerint a regisztrált stressz relaxációs görbékre jól illeszthetők a Kelvin-féle standard viszkoelasztikus komputer modell alkalmazásával előállított függvények (18). A viszkózus és elasztikus komponensek paramétereinek identifikálása ezért e modell alkalmazásával történt. Az elméleti modell egy viszkózus komponensből és azzal sorosan és párhuzamosan kapcsolt két elasztikus egységből áll (a számítás részletei az Appendixben találhatók). Kiszámítottuk a soros (Es) és párhuzamos rugalmassági modulust (Ep), valamint a viszkozitási együtthatót (η), és ábrázoltuk a megnyúlás függvényében. A szövetcsíkok szakítási szilárdságát a nyújtás során elért maximális feszültség értékével jellemeztük.
A különböző szövetminták mechanikai paramétereinek statisztikai összehasonlítását azonos megnyúlás mellett egy- faktoros ANOVA program segítségével végeztük. A különböző mechanikai paraméterek közötti összefüggéseket (lineáris regresszió és korrelációs koefficiens) StatView programmal vizsgáltuk meg.
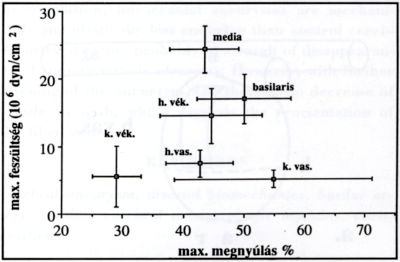
3. ábra.
Szakítási szilárdság a megnyúlás függvényében aneurizmacsíkok és kontroll artériák esetén. A vastag csíkok szakítási szilárdsága mindkét irányban szignifikánsan kisebb, mint a kontroll csíkoké. Hosszanti irányban a vékony csíkok szakítási szilárdsága nagyobb, mint a vastag csíkoké, körkörös irányban pedig a vékony csíkok sokkal alacsonyabb megnyúlás-érték mellett szakadnak el, mint a vastag csíkok.
(h. vék.: hosszanti vékony aneurizma csík,
h. vas.: hosszanti vastag aneurizma csík,
k. vék.: körkörös vékony aneurizma csík,
k. vas.: körkörös vastag aneurizma csík,
média: hosszanti kontroll csík az artéria cerebri médiából,
basilaris: körkörös kontroll csík az artéria basilarisból.)
Eredmények
A vastag csíkok szakítási szilárdsága mindkét irányban szignifikánsan kisebb, mint a kontroll csíkoké. Hosszanti irányban a vékony csíkok szakítási szilárdsága nagyobb, mint a vastag csíkoké (14,5 ± 4,1 x 106 dyn/cm2 vs. 7,5 ± 2,0 x 106 dyn/cm2, (p < 0,05). Körkörös irányban a vékony csíkok sokkal alacsonyabb megnyúlás érték mellett szakadnak el, mint a vastag csíkok (0,29 ± 0,04 vs. 0,55 ± 0,16, p < 0,05) (3. ábra).
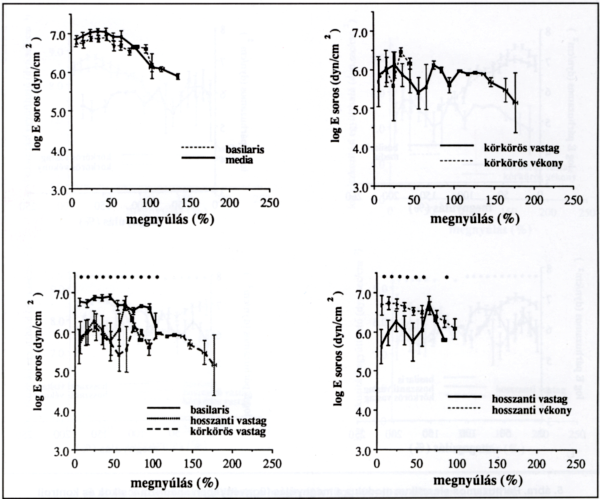
4. ábra.
Soros elasztikus modulus a megnyúlás függvényében aneurizmacsíkok és kontroll artériák esetén. A kontroll körkörös és hosszanti ércsík csoportja nem különbözött szignifikánsan. Mind hosszanti, mind körkörös irányban a vastag csíkok soros modulusa szignifikánsan kisebb a körkörös kontrollhoz viszonyítva. Hosszanti irányban a vékony csíkok szignifikánsan nagyobb soros modulust mutatnak, mint a vastag csíkok, körkörös irányban pedig a vékony és vastag csíkok elasztikus modulusa nem különbözik, azonban a vékony csíkok sokkal kisebb mértékben nyújthatók, mint a vastagok. A csillagok az egyfaktoros ANOVA teszttel kapott szignifikanciát (p < 0,05) jelölik.
A soros elaszticitás a megnyúlás függvényében nem különbözött szignifikánsan a kontroll körkörös és hosszanti ércsík csoportban (a. basilaris vs. a. cerebri média). Mind a hosszanti, mind a körkörös irányú vastag csíkok soros elasztikus modulusa szignifikánsan kisebb a körkörös kontrollhoz (a. basilaris) viszonyítva, 50-110% relatív nyúlásértékek mellett. Hosszanti irányban a vékony csíkok a 0-50% megnyúlás tartományban szignifikánsan nagyobb soros merevséget (elasztikus modulust) mutatnak, mint a vastag csíkok. Körkörös irányban a vékony és vastag csíkok elasztikus modulusa nem különbözik szignifikánsan, bár a vékony csíkok sokkal kisebb mértékben nyújthatóak, mint a vastagok (4. ábra).

5. ábra.
Párhuzamos elasztikus modulus a megnyúlás függvényében aneurizmacsíkokés kontroll artériák esetén. A kontroll csíkok nem különböznek egymástól, mindkét irányban a vastag csíkok modulusa kisebb a kontrollhoz viszonyítva. Körkörös irányban a vékony és a vastag csíkok modulusa nem különbözik szignifikánsan, hosszanti irányban pedig a vékony csíkok nagyobb párhuzamos elaszticitást mutatnak. A csillagok az egyfaktoros ANOVA teszttel kapott szignifikanciát (p < 0,05) jelölik.
Hasonló jelenségeket figyeltünk meg a párhuzamos elemek elasztikus modulusa tekintetében: a kontroll csíkok nem különböznek egymástól, mindkét irányban a vastag csíkok modulusa kisebb a kontrollhoz viszonyítva, körkörös irányban a vékony és vastag csíkok modulusa nem különbözik szignifikánsan, és hosszanti irányban a vékony csíkok nagyobb párhuzamos elaszticitást mutatnak (5. ábra).

6. ábra
Viszkozitási együttható a megnyúlás függvényében aneurizmacsíkok és kontroll artériák esetén. A kontroll csíkok nem különböznek szignifikánsan, mindkét irányban kisebb a vastag csíkok viszkozitási együtthatója a kontrollhoz viszonyítva, hosszanti irányban a vékony csíkok viszkozitási együtthatója nagyobb, körkörös irányban pedig a vékony és a vastag csíkok viszkozitási együtthatója nem különbözik. A csillagok az egyfaktoros ANOVA teszttel kapott szignifakanciát (p < 0,05) jelölik.
A viszkozitási együttható is hasonló eltéréseket mutat: a kontroll csíkok nem különböznek, mindkét irányban kisebb a vastag csíkok viszkozitási együtthatója a kontrollhoz viszonyítva, hosszanti irányban a vékony csíkok viszkozitási együtthatója nagyobb, valamint körkörös irányban a vékony és vastag csíkok viszkozitási együtthatója nem különbözik szignifikánsan (6. ábra).

7. ábra
(felülről lefelé: a, b, c, d).
a. Lineáris regresszió log párhuzamos elasztikus modulus (Ep) és log soros elasztikus modulus (Es) között 0,10-0,20 megnyúlás-értékeknél. Különböző típusú csíkok értékeinek összehasonlítása során.
b. Lineáris regresszió log viszkozitási együttható (η) és log soros elasztikus modulus (Es) között 0,10-0,20 megnyúlás-értékeknél. Különböző típusú csíkok értékeinek összehasonlítása során.
c. Lineáris regresszió log párhuzamos elasztikus modulus (Ep) és log soros elasztikus modulus (Es) között hosszanti vastag aneurizmacsíkokon.
Különböző megnyúlás-értékek összehasonlítása során.
d. Lineáris regresszió log viszkozitási együttható (η) és log soros elasztikus modulus (Es) között hosszanti vastag aneurizmacsíkokon.
Különböző megnyúlás-értékek összehasonlítása során.
Kiderült, hogy a soros és párhuzamos elasztikus modulus, valamint a viszkozitási együttható mindig azonos tendenciával változik, akár a megnyúlás függvényében, akár a különböző' csoportok között végzünk összehasonlítást (1-6. táblázat). Szövettani vizsgálataink szerint a vékony aneurizmacsíkok főleg fibroblasztokat, kisebb mértékben elasztikus rostfragmentumokat, általában kevés kötőszöveti sejtes elemet tartalmaznak. Az intimában hyalindegeneráció, a médiában fibrózis dominál, de mindkét rétegben párhuzamosan rendezett kollagén rostok láthatók (8. ábra, a, b). A vastag csíkok helyenként sejtdúsabbak, mint a vékonyak, azonban az intenzív hyalinizáció és mucoid degeneráció miatt a különböző falrétegek egységesnek és homogénnak látszanak. Az intima-media határon csak néhány elasztikus rost található (8/c ábra).
Berlini kék reakcióval nem látható megelőző intramurális vérzés nyoma. Szövettani szempontból jelentős különbség a normál, kontroll érfalhoz képest a simaizom-elemek teljes hiánya.

8. ábra.
Aneurizmacsíkok mikroszkópos képe. A csíkokban simaizom-elemek nem láthatók.
a. A vékony aneurizmacsík homogén és többnyire sejtes elemeket tartalmaz. Az intimában (I) hyalindegeneráció, a médiában (M) fibrózis látható (Hematoxylin-eosin festés).
b. A vékony csíkokban a sötétre festődött hyalin az intimában (I), az elasztikus elemek (E↑) médiában (M) találhatók. (Alcian-kék festés a glycosaminoglycanok kimutatására).
c. A vastag csíkok főleg hyalint és kollagénrostokat tartalmaznak (Resorcin-fuschin-van Gieson festés). Az intima (I) - média (M) határán néhány elasztikus fragmentum (E↑) figyelhető meg.
Diszkusszió
Az agyi aneurizmák falában a szakítási szilárdság mindkét irányban (hosszanti és körkörös) kisebb, mint a kontroll artériafalé. A soros és párhuzamos elaszticitás, valamint a viszkozitási együttható szintén csökken (4., 5., 6. ábra). Feltehető, hogy az aneurizma vastag falú képletként jön létre először, és a vékony rész később, a fal elvékonyodásával alakul ki (12, 13, 19). Eredményeink alapján megállapítható, hogy az újonnan kialakult aneurizmaszövet mechanikailag több szempontból kevésbé ellenálló, mint a szülő artéria.
A szövettani elváltozások háttere még tisztázatlan. Úgy tűnik, hogy az aneurizmaszövet több kollagént tartalmaz, mint a szülő artéria (20, 21), azonban az ilyen kollagén - mennyiségbeli eltérések nem magyarázzák az alapvető mechanikai paraméterekben megfigyelhető különbségeket.
A másik jelentős szövettani különbség, melyre az észlelt mechanikai eltéréseket megpróbálhatjuk visszavezetni, a simaizom-elemek eltűnése az aneurizmazsák falából (20, 21). Kadaver erekben a megmaradó simaizom-funkció minimális, ezért vizsgálatainkban a kontroll erek mechanikai paramétereiben a simaizom tónus nem játszik meghatározó szerepet. A tónus nélküli simaizom rugalmassága egy nagyságrenddel kisebb a passzív rostállományhoz képest (22), ezért esetünkben ez elhanyagolható. Feltételezhető, hogy a folyamatos falfeszüléssel járó állapotokban a simaizom-sejteknek egy állandó jellegű reorganizáló és rendező szerepe van a kollagén rostokra. Ez megmagyarázná azt, hogy az aneurizmaszövet mennyiségileg több, de mechanikailag gyengébb kollagén rostot tartalmaz, mint az egészséges artéria.

1. táblázat.
Log Es és log Ep közötti kapcsolat különböző megnyúlás-értékek esetén.
Különböző típusú csíkok adatait összevonva.
Jelmagyarázat az 1-6. táblázatokhoz:
Es: soros modulus (dyn/cm2),
Ep: párhuzamos modulus (dyn/cm2),
eta: viszkozitási együttható (dyn sec/cm2),
n: mérések száma,
m: lineáris regressziós görbe meredeksége,
b: y tengely metszéspontja a lineáris regressziós görbén,
r: korrelációs hányados,
p: a korrelációs hányados szignifikancia szintje.
Az agyi aneurizmák ruptúrájához vezető' folyamat a zsák falának elvékonyodásával jár együtt (3). E régi megfigyeléshez adódóan a fal anyagának mechanikai tulajdonságaiban jellegzetes elváltozásokat tapasztaltunk: hosszanti irányban egy kompenzatorikus növekedés volt a szakítási szilárdságban, a párhuzamos és a soros elasztikus modulusban és a viszkozitási együtthatóban. Körkörös irányban nem láthatók ehhez hasonló elváltozások (4., 5., 6. ábra). Ebben az irányban jellegzetes a fal elvékonyodásával párhuzamosan a maximális megnyúlás érték csökkenése (3. ábra). Valószínű, hogy az agyi aneurizmák ruptúrájának- ami általában az elvékonyodott falrészen, leginkább az apex körül történik (1. ábra) - a körkörös irányban meggyengült roststruktúra elégtelen mechanikai ellenállása az oka.
Eredményeink látszólag ellentmondanak Roach és rntsai. eredményeinek (3), akik alacsony megnyúlásnál csökkent elaszticitást találtak az aneurizma falában a szülő artériákhoz viszonyítva, azonban az ő modelljük, térbeli szimmetriát feltételezve, figyelmen kívül hagyta az aneurizmákban megfigyelhető falvastagságbeli eltéréseket, ami pedig jellegzetes tulajdonsága az aneurizmazsákoknak.
A szakítási szilárdság értéke Steigner és mtsai. szerint (6) is hasonló az általunk agyi aneurizmazsákokon kapott adatokhoz (20-30 x 106 dyn/cm2 szerintük, és 5-15 x 106 dyn/cm2 az általunk mért adat, 3. ábra). Egy későbbi munkájukban (6) a "szöveti megfolyásra" (yield) és a megfolyáskor észlelt megnyúlásra is hasonló értékeket kaptak az általunk mért maximális feszültség- és megnyúlás-értékekhez. Az agyalapi artériákat hosszanti irányba megnyújtva a megfolyás-érték náluk 10,6 ± 1,3 x 106 dyn/cm2 volt, ez megfelel az általunk az artéria cerebri média csíkokon hosszanti irányban mért adatnak, ami 23,5 ± 3,8 x 106 dyn/cm2. Az aneurizmaszövetet két részre osztották: "nyakra", és "fundusra", ahol a folyási feszültség értékét 12,1 ± 4,9 x 106 dyn/cm2 találták, ami nálunk 5,0 ± 2,6 x 106 dyn/cm volt. Az aneurizmaszövetben az általunk mért ma- ximális feszültség-érték tartomány 5-15 x 10 dyn/cm2, és ezen belül a hosszanti vékony csíkok szakítási szilárdsága a legnagyobb. Az általuk publikált megfolyáskor észlelt megnyúlás-értékek hosszanti irányban nyújtott agyalapi artériáknál 0,34 ± 0,10, az aneurizmazsák nyaki részénél 0,57 ± 0,39, és az aneurizmazsák fundusánál 0,07 ± 0,15, amely értékek nem különböznek jelentősen a 3. ábrán feltüntetett mérési adatoktól. Ezeken az adatokon túlmenően a mi méréseink igazolták, hogy jelentős különbségek észlelhetők az aneurizmazsák vastag és vékony falú részeinek mechanikai tulajdonságaiban, illetve attól függően, hogy a mechanikai paramétereket milyen irányban mérjük.
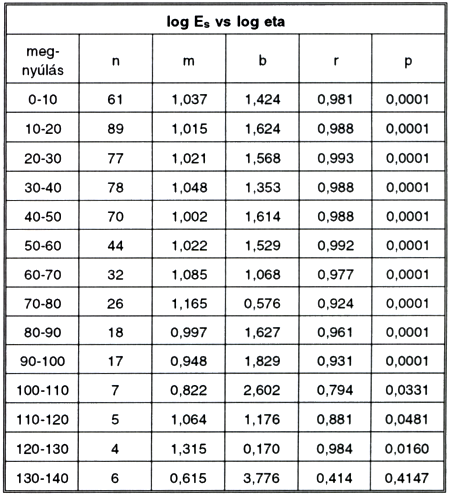
2. táblázat.
Log Es és log eta közötti kapcsolat különböző megnyúlás-értékek esetén. Különböző típusú csíkok adatait összevonva.
Egyik érdekes megfigyelésünk az, hogy az aneurizma- szövet és kontroll erek soros és párhuzamos elaszticitása, valamint viszkoelasztikus modulusa azonos tendenciával változik. Az aneurizmacsík típusától és a megnyúlás mértékétől függetlenül a soros és a párhuzamos modulusok logaritmusa lineáris regressziót mutat, ahol a meredekség megközelítőleg 1, és az y tengely metszéspontja az esetek többségében a 0,14-0,8 tartományban van. Hasonló regressziós összefüggést észleltünk a soros elaszticitás és a viszkozitási együttható között, ahol a meredekség szintén 1 közelében, az y tengely metszéspontja pedig 0,6-1,6 tartományban van (1-6. táblázat, 7. ábra). Ez azt jelenti, hogy a három alapvető mechanikai paraméter közötti kapcsolat a következő egyenlettel írható le:
Es = k1 x Ep = k2 x η,
ahol ki = 1,4-6,3, és k2 = 4-40, amennyiben Es, Ep és η CGS egységekben van megadva. Valószínű, hogy a fenti egyenlet az érkötőszövet mechanikai felépítésének egy eddig még nem ismert összefüggését írja le. Az egyik lehetőség az, hogy a soros és a párhuzamos elaszticitás ugyanazon kollagén rostpopuláció segítségével valósul meg, amelyekből egyes kollagén rostok szerepe a soros elaszticitás, a maradék részé a párhuzamos elaszticitás, és adott kollagén rostok felváltva töltik be a soros és párhuzamos elaszticitás szerepét. A viszkózus ellenállást valószínűleg a kollagén rostokhoz kötődő mukopoliszaharidok biztosítják sztochio- metrikus módon (23). A nyújtás során a mechanikai paraméterek oly módon változnak, hogy több kollagénrost, vagy elszakadásuk következtében kevesebb számú kollagénrost kerül bevonásra anélkül, hogy a közöttük fennálló mechanikai kapcsolat jellege megváltozna. Úgy tűnik, hogy a három alapvető mechanikai paraméter közötti kapcsolatot nem befolyásolja az aneurizmaszövet kialakulása. Ezért nem valószínű, hogy a mechanikai paraméterekben bekövetkező változásokat maguknak a mechanikai egységeknek a változása okozná (a kollagén rostok típusa), valószínűbb a sorosan és párhuzamosan csatolt egységek (kollagénrostok) számában, a szöveti szerkezetben bekövetkező kvantitatív változás. Az agyi aneurizmazsákok kialakulását az irodalomban többek az artériafalban genetikai alapon kialakuló, a III. típusú kollagénrostok minőségében és mennyiségében bekövetkező változással magyarázzák (8, 16, 17, 24, 25, 26, 27). Mások az ilyen jellegű feltételezéseket nem tartják megalapozottnak (28). A fentiek alapján a mi eredményeink sem támasztják alá ezeket a nézeteket. Az irodalomban fellelhető áramlási teóriák az aneurizmazsákok kialakulásának megindulásáért az endothelium felületén lokálisan megnövekvő nyíróerőt tartják felelősnek (18, 29). Ezenkívül a betegség kialakulásában öröklött (7, 8, 9) vagy szerzett (7, 10, 11), szisztémás (14, 15), vagy lokális (8, 12, 13) érfalgyengeség játszhat szerepet. Az aneurizma falában hemodinamikai erők hatására ébredő mechanikai feszültségek pedig tovább tágítják a zsákot (1, 2, 4, 6). A folyamatosan jelenlévő, növekvő mértékű tágító erők hatásával az új granulációs szövetképzó'dés nem tud lépést tartani, a fal elvékonyodik (4, 6). Vizsgálataink ezeknek az elképzeléseknek a továbbfejlesztéséhez, illetve tisztázásához szolgáltatnak adatokat.
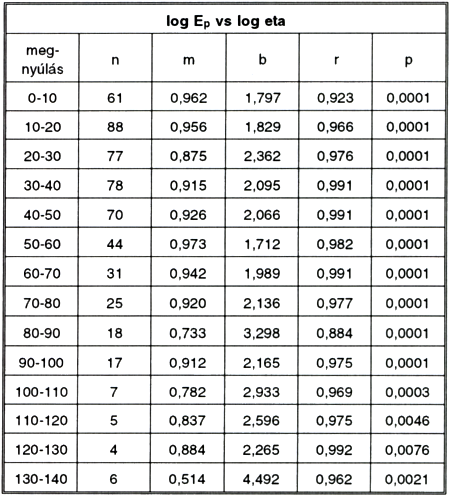
3. táblázat.
Log Ep és log eta közötti kapcsolat különböző megnyúlás-értékek esetén. Különbözőtípusú csíkok adatait összevonva.
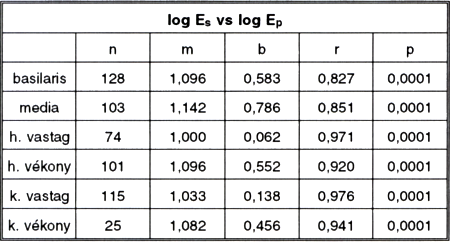
4. táblázat.
Logs és log Ep kapcsolata különböző típusú csíkok esetén. Különböző megnyúlás-értékek adatait összevonva.
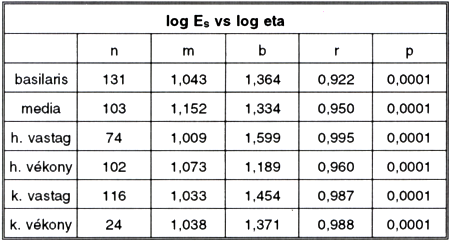
5. táblázat.
Log Es és log eta kapcsolata különböző típusú csíkok esetén. Különböző megnyúlás-értékek adatait összevonva.
Összefoglalva eredményeinket, megállapíthatjuk:
- Az elvékonyodástól mentes, vastagabb falú aneurizmarésznek mechanikai paraméterei kisebbek, összehasonlítva a kontroll agyi artériás szövettel (a szakítási szilárdság, valamint a számított soros, párhuzamos modulus és viszkozitási együttható is kisebb).
- 2. Az elvékonyodással párhuzamosan feltehetőleg a szövetek sajátos polarizációja megy végbe. Míg hosszanti irányban a szakítási szilárdságban (és az egyéb mechanikai paraméterekben) egy kompenzatorikus növekedés jön létre, addig körkörös irányban a szövetek maximális nyújthatósá- ga kisebb megnyúlási foknál áll be, ami az aneurizma ruptúráját eredményezheti.
- Azt tapasztaltuk, hogy a soros és a párhuzamos modulusok, valamint a viszkozitási együttható között szigorú lineáris összefüggés van. Kapcsolatuk kifejezhető egy egyszerű lineáris egyenlettel, melynek paraméterei csak enyhe eltéréseket mutatnak a különböző típusú csíkok esetében (artériás és aneurizmás), és a különböző megnyúlásérték esetén. Ez az egyenlet valószínűleg az érkötőszövet funkcionális szerveződésének egy eddig még fel nem tárt jellegzetességét írja le.
Vizsgálataink szerint feltételezhető tehát, hogy az artériafal viszkoelasztikus tulajdonságai az aneurizmazsák kialakulásával és az aneurizmazsák falának elvékonyodásával párhuzamosan jelentősen megváltoznak. Az agyi aneurizmazsák falának rugalmas viselkedése regionálisan és sztérikusan inhomogén. Ezeket a tényeket az aneurizma kialakulásával és ruptúrájával kapcsolatos további vizsgálatoknak figyelembe kell venniük.
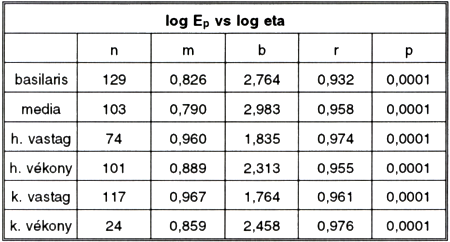
6. táblázat.
Log Ep és log eta kapcsolata különböző típusú csíkok esetén. Különböző megnyúlás-értékek adatait összevonva.
Köszönetnyilvánítás
A kísérleteket az ETT 291-93 pályázat támogatta.
A szerzők köszönetüket fejezik ki a Semmelweis Orvostudományi Egyetem Igazságügyi Orvostani Intézetének a kontroll kísérletek anyagának biztosításáért. Köszönjük továbbá Murányi Ildikónak, Maurer Ágnesnek, Hankó Mónikának, Fábián Juditnak, Kovács Hajnalkának, Szabó Juditnak és Szily Ildikónak a kísérletek kiértékelésében, valamint a kézirat előkészítésében való értékes közreműködését.
Irodalom
- Hademenos, G. .J., Massoud, T., Valentino. D. J., Duckwiler, G., Vinuela, F.: A nonlinear mathematical model for the develop- ment and rupture of intracranial saccular aneurysms. Neurol. Res., 16: 376-384 (1994).
- Hademenos, G. J.: Neuroangiographic assesment of aneurysm stability and impending rupture based on a non-linear biomat- hematical model. Neurol. Res., 17: 113-119 (1995).
- Scott, S., Ferguson. G. G., Rocich. M. R.: Comparison of the elastic properties of humán intracranial arteries and aneurysms. Can. J. Physiol. Pharmacol., 50:328-332. (1972).
- Steiger H. J.. Acislid. R.. Reulen. H. J.: Growth of aneurysms can be understood as passive yield to blood pressure. Acta Neuro- chir. (Wien), 100: 74-78. (1989).
- Nakatani, H.. Hashimoto, N., Kang. K, Yamazoe. N.. Kikuchi H.. Yamaguchi. S., Niimi, H.: Cerebral blood flow patterns at major vessel bifurcations and aneurysms in rats. J. Neurosurg. 74: 258-262 (1991).
- Steiger H. J.: Pathophysiology of development and rupture of cerebral aneurysms. Acta Neurochir. (Wien) (Suppl. 48.): 1-57 (1990).
- Dobrin. P. B.. Aidjar S.: Pathophysiology of arterial aneurysms. Arch. Mai. Coeur., 84(3): 567-62. (1991).
- Hegedűs K.: Somé observations on reticular fibers in the média of the major cerebral arteries. A comparative study of patients without vascular disease and those with ruptured berry aneurysms. Surg. Neurol., 22(3): 301-307. (1984).
- Popé, F. M.: Type III. collagen mutations and cerebral aneurysms. Stroke, 20(10): 1432-1433. (1989).
- Gao Y. Z.. van Alplien H. A.: Pathogenesis and histopathology of saccular aneurysms (review). Neurol Res 12(4): 249-255. (1990).
- Rossiti, S., Lofgren. J.: Vascular dimensions of the cerebral arteries follow the principle of minimum work. Stroke, 24(3): 371-377. (1993).
- Jain, K. K.: Mechanism of rupture of intracranial saccular ane-urysms. Surgery, 54: 347-350. (1963).
- Yong-Zhong, G., van Alphen H. A.: Pathogenesis and histopat-hology of saccular aneurysms: review of the literature. Neurol. Res., 12: 249-255. (1990).
- Tóth M.. Nádasy G. L. Nyáry I.. Kerényi T.. Monos E.: Agyi aneurizmás betegek intra- és extracranialis artériáinak biome- chanikai tulajdonságai. Érbetegségek 3:1-7. (1996).
- Tóth M.. Nádasy G. L.. Nyáiy /.. Kerényi T.. Monos E.: Bio- mechanical properties of intra- and extracranial arteries from cerebral aneurysmatic and control subjects. Neurosurg., (submitted)
- Ostergaard J. R.: Risk factors in intracranial saccular aneurysms. Aspects on the formation and rupture of aneurysms, and development of cerebral vasospasm. Acta Neurol. Scand., 80(2): 91-98. (1989).
- Oxlund, H.: Relationships between the biomechanical properties, composition and molecular structure of connective tissu- es. Connect Tissue Res 15(1-2): 65-72. (1986).
- Orosz M.. Molnárka G., Nádasy G. L. Tóth M., Monos E.: Viscoelastic behavior of vascular wall described by generali- zed quasilinear Maxwell models. (In preparation)
- Crompton M. R.: The pathogenesis of cerebral aneurysms. Bra- in. 89: 787-814. (1966).
- Stehbens W. E.: Ultrastructure of aneurysms. Arch. Neurrol. (Chicago) 32: 789-807. (1975).
- Suzuki. J., Ohara, H.: Clinicopathological study of cerebral aneurysms. I. Neurosurg., 48: 505-514. (1978).
- Fung. Y. C.: Biomechanics. Mechanical properties of living tissues. Springer Verlag, New York. (1981).
- Haut R. C.: The effects of orientation and location on the strength of dorsal rat skin in high and low speed tensile failure experiments. J. Biomech. Eng., 111(2): 136-140. (1989).
- Dobrin. P. B.. Baker. W. H.. Gley, W. C.: Elastolytic and collagenolytic studies of arteries. Implications for the properties of aneurysms. Arch. Surg. 119(4): 405-409. (1984).
- Kim, C., Cei-vos-Navano, J.. Kikuchi, H.. Hashimoto, N.. Huzama, F.: Dechanges in the internál elastic lamina relating to the development of saccular cerebral aneurysms in rats. Acta Neurochir. (Wien), 121(1-2): 76-81. (1993).
- Kim C., Cervos-Navarro J.. Patzold C.. Tokuriki Y. Takebe Y.. Horí K: In vivo study of flow pattern at humán carotid bifur- cation with regard to aneurysm development. Acta Neurochir. (Wien), 115(3-4): 112-117. (1992).
- Ostergaard, J. R.. Oxlund. H.: Collagen type III. deficiency in patients with rupture of intracranial saccular aneurysms. J. Neurosurg. 67(5): 690-696. (1987).
- Stehbens, W. E.: Etiology of intracranial berry aneurysms. J. Neurosurg. 70(6): 823-831. (1989).
- Hudetz A. G.. Monos E.: A viscoelastic model of mechanically induced and spontaneous contractions of vascular smooth muscle. Acta Physiol. Hung., 65(2): 109-123. (1985).
- Findley. W. N., Led, J. S.. Onaran, K.: Creep and relaxation of nonlinear viscoelastic materials with an introduction to linear viscoelasticity. Amsterdam, North-Holland Publ. Co. (1976).
- Monos E., Szűcs B.: Vascular biomechanical factors in regulation of arterial hemodinamics: computer models. Acta Physiol. Hung., 79: 3-22. (1992).
- Monos E.: Az érfal biomechanikája. Medicina, Bp. (1986).
Appendix
Előkísérleteink szerint mind a normális agyi artériák fala, mind az aneurizmacsíkok olyan mechanikai viselkedést tanúsítanak az idő függvényében, ami modellezhető egy viszkózus, valamint egy vele sorosan és párhuzamosan kapcsolt elasztikus modulussal. A csíkok hosszának szakaszos, lépcsőszerű nyújtása során stressz relaxációs görbéket regisztráltunk, amely a Standard Solid (Voigt-Kelvin) modell segítségével jól szimulálható (22, 29), és egy differenciálegyenlettel leírható (30).
A Standard Solid modell egy viszkózus (η), valamint egy sorosan (Es) és egy párhuzamosan (Ep) kapcsolt elasztikus elemből áll. A modell segítségével vizsgálható a kúszás és a fesziiltségrelaxáció jelensége. A stresszrelaxációs görbéket a csíkok hosszának lépésenként! gyors megnyújtása kapcsán regisztráltuk, így feltételeztük, hogy az egy nyújtás alatti relatív megnyúlás mértéke nem függött az időtől:
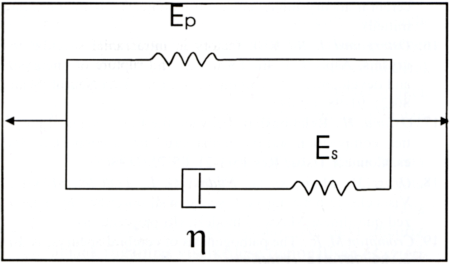
A-1. ábra.
Standard solid (Voight-Kelvin) modell, ahol Es: soros elasztikus modulus (dynes/cm2), Ep: párhuzamos elasztikus modulus (dynes/cm2), η: viszkozitási együttható (dynes x sec/cm2).

A parabola-regresszióval kapott a0, a1, és a2 paraméterek segítségével minden egyes megnyújtásra a kívánt viszkoelasztikus modulusokat meg lehet határozni. A számításhoz a MAPLEV és MATLAB programokat használtuk. A számított stressz relaxációs görbék jól illeszkedtek a kísérletek során regisztrált görbékre (2. ábra), az elasztikus modulus értékek pedig nagyságrendileg megegyeztek a korábbiakban különböző erek falára kapott eredményekkel (17,31,32).
Dr. Tóth Mária
Semmelweis OTE Klinikai Kísérleti Kutató
II. sz. Élettani Intézet
1082 Budapest, Üllői út 78/a.
Érbetegségek: 1997/2. 1-12. oldal


