Célkitűzés: a szerzők tesztelni kívánták, gyakorol-e a 17ßösztradiol és a progeszteron akut módosító hatást a kis artériák falának tónusára in vitro. Anyag és módszer: nem terhes, nullipara nőstény Sprague-Dawley patkányokból (testtömeg: 200-300 g) intraperitoneális Nembutal narkózisban (50 mg/tskg) artéria saphena szakaszokat izolállak (kimetszési hossz: 6,8-11,3 mm), majd azokat mindkét végén kanülálták. Az érpreparátumot Krebs-Ringer oldatot tartalmazó szervfürdőbe helyezték, amelyhez 15,8 µM koncentrációban noradrenalint adtak. Ez a noradrenalin koncentráció már maximális, stabil érösszeliúzódást váltott ki az előkísérletek során. A stabil érösszehúzódás beállta után az oldathoz ösztradiolt, vagy progreszteront adtak, a kumulatív koncentrációk: 1- 100 µM, illetve 0,86-86,4 µM voltak. Az ér-szegmentumok külső átmérőjének változásait mikroangiometria alkalmazásával mérték.
Eredmények: a noradrenalimial előkontrahált artériákon mind az ösztrogén (1 µM koncentráció felett), mind a progeszteron (8,6 µM koncentráció felett) alkalmazása szignifikáns, dózisfüggő relaxációt eredményezett.
Következtetés: a szexuálszteroidok akul alkalmazásuk során nyert eredményeink szerint szignifikánsan csökkentik a keringési ellenállás szempontjából fontos kis artériák tónusát. A teljes perifériás rezisztencia csökkentése valószínűleg hozzájárul ahhoz, hogy a fokozott szív-érrendszeri veszélyeztetettség korszakában, a meiiopauzábaii adagolt ösztrogén, vagy kombinált hormonkezelés általában mérsékelni lálszik az idült szív-érrendszeri megbetegedések kockázatát.
Érbetegségek: 1997/4. 7-11. oldal
KULCSSZAVAK
szexuálszteroidok, ér-relaxáció, perifériás rezisztencia
Bevezetés
Számos nyitva maradt probléma ellenére, több nagy populációt vizsgáló epidemiológiai tanulmány eredményei is igazolni látszanak, hogy a posztme-nopauzális ösztrogénpótlás védő hatást gyakorol mind a cerebro-, mind a kar- diovaszkuláris betegségek ellen (1, 2). E védelmet főként antiaterogén és vazodilatáns hatásának tulajdonították.
Az ösztrogén akut vagy krónikus alkalmazása serkenti a koszorúerek endotélfüggő tágulását mind állatkísérletekben, mind klinikai tanulmányok során (4, 5). Magas extracelluláris káliumszint, PGF2α, endotelin -1, vagy Bay K 8644 által prekontrahált koronária gyűrűkön az endotéltől független relaxációt is kivált (6, 7).
Kevesebb és jóval ellentmondásosabb irodalmi adat áll rendelkezésünkre a progeszteron érfali hatásait illetően (8, 9, 10), annak ellenére, hogy a progeszteront már kiterjedten használjuk a posztmenopauzális hormonpótló kezelés részeként. Egyes kísérletek arra utalnak, hogy a progeszteron az ösztrogén bizonyos előnyös vaszkuláris hatásait mérsékelni képes (11, 12). Ugyanakkor azonban koszorúér gyűrűkön a progeszteron közvetlen vazorelaxáns hatását írták le (13).
Az ösztrogén és a progeszteron vaszkuláris hatásait eddig csak nagyobb ereken vizsgálták. Nem ismerünk a perifériás rezisztencia meghatározásában alapvető szereppel bíró, ún. kis artériákra kifejtett hatásukat tárgyaló közleményt. Jelen tanulmányunk célja a női szexuálszteroidoknak a kis erek tónusára esetleg kifejtett közvetlen hatásának vizsgálata. Méréseink során az ösztradiol és a progeszteron esetleges közvetlen értónus-csökkentő hatását noradrenalinnal prekontrahált, mintegy 250 µM átmérőjű patkány saphena artériákon in vitro teszteltük.
Anyag és módszer
Ivarérett, nem terhes nőstény Sprague-Dawley patkányokat (testtömeg: 200-300 g) intraperitoneális Nembutal- lal altattunk (50 mg/ttkg). A saphena artériából 6,8-11,3 mm hosszú érszakaszt preparáltunk, azt mindkét végén kantiláltuk, majd normál Krebs-Ringer oldatot tartalmazó szervfürdőbe helyeztük. Az oldat összetétele: 144,9 mM Na+; 4,5 mM K+; 25, mM Ca2+; 1,2 mM Mg2+; 1,2 mM H2PO42- 22,5 mM HCO3-; 5,56 mM glukóz. A szervfürdőt folyamatosan áramoltattuk át 95% O2-t és 5% C02-t tartalmazó gázkeverékkel. Az oldat hőmérsékletét 37 °C-on tartottuk. Az érszakaszokat axiálisan eredeti in vivo hosszúkra feszítettük ki a mérés teljes időtartamára. Az intraluminális nyomást 50 Hgmm- ra állítottuk be, amelyet a preparátum nyomás-átmérő görbéinek elemzéséhez optimálisnak találtunk. Az ér külső átmérőjét mikroangiometria segítségével folyamatosan mértük. Az érszakaszról videomikroszkópos képet állítottunk elő, átlátszó aljzatú szervfürdő kádból, mikroszkópból, Philips CCD kamerából és Philips monitorból összeállított rendszerrel. Speciális számítógép horizontálisan elemezte a videojelet a monitoron, az érfal kontúrjait automatikusan jelezve. A jeleket digitalizálás után IBM PC-n rögzítettük, Labtech Notebook szoftvert alkalmazva.
Harminc perc kiegyenlítődési idő után az oldathoz noradrenalint (Arterenol, Hoechst) adtunk 15,8 µM koncentrációban (maximális dózis). 10 percen belül stabil kontrakció állt be. Az oldathoz 17 P-ösztradiolt (Richter) adtunk 1-100 µM-ig terjedő kumulatív dózisban. Minden koncentráció esetén 10 percet várakoztunk az esetleges hatás kialakulására. Egy másik kísérletsorozat során progeszteront (Richter) adtunk az oldathoz, az ösztradiolhoz hasonló módon, 0,86-86,4 µM-ig terjedő koncentrációban. Mind az ösztradiol, mind a progeszteron oldatot frissen készítettük, a kristályos hormonok 10 mg-ját 1 ml etanolban oldva. Az oldószer maximális koncentrációja a Krebs-Ringer oldatban 0,3% alatt volt, amely etanol koncentráció nem váltott ki semmiféle változást a preparátum összehúzódásában.
A relaxáns hatást a noradrenalin által kiváltott kontrakció százalékaként fejeztük ki. Az eredményeket átlag ± SEM-ként adjuk meg. A relaxáns hatást t-próba felhasználásával vizsgáltuk, a relaxáció hiányát zéró hipotézisnek tekintve.
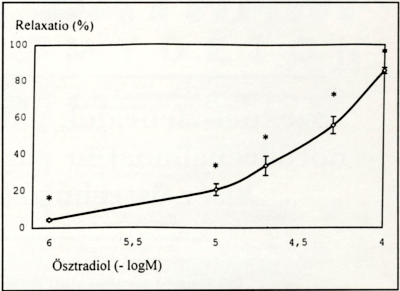
1. ábra.
Ösztradiol-17ß (1-10-20-50-100 µM) közvetlen hatása nem terhes nőstény patkányok noradrenalinnal előzetesen kontrakcióba hozott saphena kis verőerek tónusára. Az eredmények (átlag +/- SEM, n=8) az előkontrahált ér százalékban kifejezett relaxációját tüntetik fel az ösztradiol különböző koncentrációinak hatásában.
Eredmények
Az ösztradiol relaxáns hatása prekontrahált saphena-arteriákban:
A noradrenalin 15,8 µM koncentrációban a patkány artéria saphena szakaszok külső átmérőjét 623 ± 23 fxm-ről 367 ±+18 µm-re csökkentette. 1 µM ösztradiol a prekontrahált artériákon szignifikáns relaxációt eredményezett (4,3 ± 1,2%, p<05). Az ösztradiol 10, 20, 50 és 100 µM-ja a prekontrahált artériák szignifikáns, dózisfüggő relaxációját váltotta ki. A félmaximális hatást 31,6 µM koncentrációnál mértük (1. ábra).
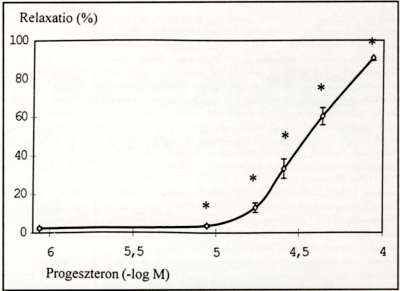
2. ábra.
Progeszteron (0,86-8,6-17,3-26-43,2-86,4µM) közvetlen hatása nem terhes nőstény patkányok noradrenalinnal előzetesen kontrakcióba hozott saphena kis verőerek tónusára. Az eredmények (átlag +/- SEM, n=8) az előkontrahált ér százalékban kifejezett relaxációját tüntetik fel az ösztradiol különböző koncentrációinak hatásában,
A progeszteron relaxáns hatása prekontrahált saphena-artériákban:
Noradrenalin 15,8 µM koncentrációban a patkány artéria saphena szakaszok külső átmérőjét 619 ± 14 µm-ről 364 ± 9 (im-re csökkentette. 8,6 µM progeszteron a prekontrahált artériákon szignifikáns relaxációt eredményezett (3,6 + 1,3 %, p<05). A progeszteron 17,3, 26, 43,2 és 86,4 µM-ja a prekontrahált artériák szignifikáns, dózisfüggő relaxációját váltotta ki. A fél-maximális hatást 29,3 µM koncentrációnál mértük (2. ábra).
Megbeszélés
Vizsgálatunkban igazoltuk, hogy noradrenalinnal prekontrahált patkány artéria saphena szakaszokon mind az ösztradiol, mind a progeszteron 1 µM koncentráció lelett akut, dózisfüggő relaxációt tud kiváltani. A kísérletben felhasznált saphena artériák ún. kis artériák, közel a rezisztencia erek tartományához.
A posztmenopauzális ösztrogén pótló terápiában részesülő nőkről kimutatták, hogy esetükben a kardio- és cerebrovaszkuláris megbetegedések kockázata mintegy 30-50%-kal csökken (1, 2). Az ösztrogén kezelés szív-érrend- szeri védőhatása főként antiaterogén és hemodinamikai hatásából adódhat. Mind az akut, mind a krónikus ösztro-génkezelés befolyásolja az erek tónusát és reaktivitását. A 17ß-ösztradiol akut, vagy krónikus adagolása birkákon szisztémás vazodilatációt vált ki, és csökkenti az angiotenzin Il-re adott presszor választ (14, 15, 16). Krónikus ösztradiol kezelés a koszorúerekben az acetilkolinra adott kóros érösszehúzódást értágulatra változtatja. Aorta és koronária gyűrűkön növeli az acetilkolinra és bradikininre adott endotélfüggő vazodilatációt (4, 17), és ugyanez a hatás volt igazolható in vivo is cynomolgus majmok ateroszklerotikus koszorúerein (18). Az ösztrogén akut adagolása megváltoztatja a koszorúerek kóros vazomotor válaszait, s fokozza az acetilkolin által kiváltható ér- tágulat mértékét posztmenopauzális korú nők koszorúerein, alkari és femorális verőerein (5, 19, 20). A fiziológiás feletti koncentrációban az ösztrogén akut, nem receptorfüggő, endotéltól független relaxációt vált ki prekontrahált koronária gyűrűkön (6, 7). Kétdimenziós és Doppler ultrahangos in vivo vizsgálatok a 17P-ösztradiolnak szintén akut, nem receptorfüggő, és endotéltól független értágító hatását írják le (21). Az ösztradiol vaszkuláris simaizomzatra gyakorolt azonnali relaxáns hatása mögött a simaizom sejtek feszültségfüggő Ca2+ csatornákon keresztül történő Ca2+ felvételének csökkenése áll (22, 23). Jóval kevesebb és ellentmondásosabb eredményeket tartalmazó tanulmányt ismerünk a progesztinek, vagy ösztrogénnel való kombinációjuk vaszkuláris hatásaira vonatkozólag. A méh artériás ágyában (12) és kutya koronáriákon (11) is leírták a progeszteron gátló hatását az ösztrogén kiváltotta értágulatra. A presszor válaszkészség tekintetében ellentmondók a progeszteron szerepéről rendelkezésre álló adatok (8, 9, 10). Izolált koronária gyűrűkön a progeszteron direkt vazorelaxáns hatását mutatták ki (13). Humán intracranialis ereken is beszámoltak a progeszteron kontrakciót csökkentő hatásáról (24).
Az ösztrogén, vagy a progeszteron közvetlen érhatásait vizsgáló tanulmányok mindegyike a nagyobb erekre fókuszált. Jelen tanulmányunk célja a női nemi hormonok kis (rezisztencia) artériákra gyakorolt esetleges közvetlen értágító hatásának vizsgálata volt. Fontosnak véltük a vizsgálatokat ilyen kis erekre is kiterjeszteni, mert a női szexuálszteroidok szív-érrendszeri kedvező hatásaiban a nagy erek állapotának befolyásolása mellett alapvető fontosságúnak feltételeztük a kis artériákra kifejtett kedvező', például potenciális éfali relaxációs hatásukat.
Vizsgálataink során kimutattuk, hogy mind az ösztradiolnak, mind a progeszteronnak - adott dózis szinteken - hasonlóan gyors, direkt vazorelaxáns hatása van a noradrenalinnal prekontrahált patkány artéria saphena szakaszokra, amint azt korábban PGF2?, endotelin-1, Bay 8644-gyel és magas extracelluláris káliumszint által prekontrahált koronária gyűrűkön is igazolták (6, 13). A progeszteron relaxáns hatásának igazolása prekontrahált koszorúereken (7), és most ehhez hasonlóan a kis artériákon, azt a következtetést engedi meg, hogy a progeszteron terápiás adagokban valószínűleg nem csökkenti az ösztrogén relaxáns hatását, sót még serkentheti is azt.
A rezisztencia artériák fontos szerepet játszanak az érellenállás meghatározásában, illetve a hypertonia patogenézisében. A magas vérnyomás a kardio- és cerebrovaszkuláris mortalitás egyik kiemelt rizikótényezője. A vizsgált artériák tónusának csökkenése csökkentheti a teljes érellenállást, ezáltal a vérnyomás esését, és jobb szöveti perfúziót eredményez. Bár az ösztrogén és a progeszteron értágító hatását in vitro rendszerünkben a fiziológiásnál jóval nagyobb koncentrációk szintjén tudtuk csak kimutatni, igen valószínű, hogy az optimális in vitro lokális feltételrendszerben alacsonyabb koncentrációk is már hatékonyak folyamatos érvényesülés esetén (25, 26).
A hosszútávú ösztradiol kezelés nagyvérköri értágulatot okoz (14), s csökkenti a vérnyomást mind hypertoniás, mind normotoniás nőknél (27). A női nemi hormonok kísérletünkben kimutatható közvetlen értágító hatása - a krónikus ösztrogén kezelés endothelialis NO szintézist elősegítő (28) és az endothelin szinten csökkentő (29) hatása mellett - a kardio/cerebrovaszkuláris védelem fontos mechanizmusát jelentheti, természetesen nem megfeledkezve a hormonszubsztitúció inkább hosszú távú antiaterogén hatásáról.
Összefoglalva megállapíthatjuk, hogy vizsgálatainkban az ösztradiol és a progeszteron az élettaninál magasabb koncentrációkban akut relaxáns hatást képes kiváltani a noradrenalin előkezeléssel kontrakcióba hozott izolált kisartéria szakaszokon. Ez a hatás is valószínűleg szerepet játszik abban, hogy a nők körülbelül az ötödik évtizedig relatív védettséget élveznek a magasvérnyomás betegség gyakorisága, súlyossága, vagy épen koszorúér-szövődmény fellépte szempontjából a férfiakkal szemben. A vazorelaxáns hatás hormonpótló kezelés eredményeként fontos lehet a menopauzába jutott nők szív-érrendszeri kórfolyamatainak és célszervi károsodásainak fékezésében, de az egyes keringési kórfolyamatokban a konkrét jelentőségének megismerése még további állatkísérletes és klinikai vizsgálatokat igényel.
Köszönetnyilvánítás
A szakszerű technikai segítségért Oravetz Ildikó és Maurer Ágnes aszszisztenseinknek tartozunk köszönettel. A tanulmány elvégzését az OTKA TO 17789/95 és az ETT 291 93/94 kutatástámogatások, valamint dr. Kakucs Réka Ph. D. hallgató ösztöndíja segítette elő.
Irodalom
- Slampfer, M. J" Colditz, G. A.: Estrogen replacement therapy and coronary heart disease: a quantitative as- sessment of the epidemiologic evi- dence. Prev. Med., 1992; 20:47.
- Grady, D., Rubin, S. M., Petliti, D. B. et al.: Hormoné therapy to prevent disease and prolong life in postmenopausal women. Ann. Intern. Med., 1992; 117:1016
- Gerhard, M., Ganz, P.: How do we explain the clinical benefits of estro- gen? Circulation, 1995; 92:5.
- Keaney, J. F. Jr., Shwaery, G.T., Xu, A. et al: 17ß-estradiol preserves endothelial vasodilator function and limits low-density lipoprotein oxidation in hypercholesterolemic swine. Circulation, 1994; 89:2251.
- Reis, S. E" Gloth, S.T., Blumenthal, R. S. et al.: Ethinyl estradiol acutely at- tenuates abnormal coronary vasomotor responses to acetylcholine in post- menopausal women. Circulation, 1994; 89:52.
- Jiang, C., Sarrel, P. M., Lindsay, D. C. et al.: Endothelium independent relaxation of rabbit coronary artery by 17(3-estradiol in vitro. Br. J. Pharma- col., 1991; 104:1033.
- Jiang, C., Sarrel, P. M., Poole-Wilson, P. A. et al.: Acute effect of 17ß-estradiol on rabbit coronary artery contractile responses to endothelin-1. Am. J. Physiol., 1992; 263: H271.
- Nakamura, T., Matsui, K., Ito, T. et al.: Effects of pregnancy and hormoné treatments on pressor response to angiotensin II in conscious rats. Am. J. Obstet. Gynecol., 1988; 159:989
- McLaughlin, M. K., Quinn, ]., Farnham, J. G.: Vascular reactivity in the hind limb of the pregnant ewe. Am. J. Obstet. Gynecol., 1985; 152:593.
- Tamai, T., Matsuura, S., Tatsumi, N. et al.: Role of sex hormones in relatíve refractoriness to angiotensin II during pregnancy. Am J. Obset. Gynecol., 1984; 149:177.
- Miller, V. M" Vanhoutte, P. M.: Progesterone and modulation of endothelium-dependent responses in canine coronary arteries. Am. J. Physiol., 1991; 261:R1022.
- Resnik, R" Brink, G. W" Plumer, M. H.: The effect of progesterone on estrogen-induced uterine blood flow. Am. J. Obstet. Gynecol., 1977; 128:251.
- Jiang, C., Sarrel, P. M., Lindsay, D. C. et al: Progesterone induces endothelium-independent relaxation of rabbit coronary artery in vitro. Eur. J. Pharmacol., 1992; 211:163.
- Magness, R. E., Parker, C. R. Jr., Rosenfeld, C. R.: Systemic and uterine responses to chronic infusion of estradiol-17ß. Am. J. Physiol., 1993; 265:E690.
- Magness, R. E., Rosenfeld, C. R.: Local and systemic estradiol-17 béta; effects on uterine and systemic vaso- dilation Am. J. Physiol. 1989; 256:E536
- Rosenfeld, C. R., Jackson, G.M.: Estrogen-induced refractoriness to the pressor effect of infused angiotensin II. Am. J. Obset. Gynecol. 1984; 184:429.
- Williams, S. P., Shackelford, D. P., latns, S. G. et al.: Endothelium dependent relaxation in estrogentreated spontaneusly hypertensive rats. Eur. J. Pharmacol. 1988; 145:205.
- Williams-, J. K, Adams, M. R.: Klopfenstein HS. Estrogen modulates responses of atherosclerotic coronary arteries. Circulation 1990; 81:1680.
- Gilligan, D. M" Badar, D. M" Panza, J. A. et al: Acute vascular effects of estrogen in postmenopausal women. Circulation 1994; 90:786.
- Riedel, M., Miigge, A.: Direct effects of estrogens on the vascular tone: characterization and clinical impor- tance. Z. Kardiol. 1994; 83:768.
- Sudhir, K., Chou, T. M., Mullen, W. M. et al: Mechanisms of estrogeninduced vasodilation: in vivo studies in canine coronary conductance and resistance arteries. J. Am. Coll. Car- diol. 1995; 26:807.
- Han, S., Karaki, K., Ouchi,Y. et al.: 17(3-estradiol inhibits Ca2+ release induced by thromboxane A2 in porcine coronary artery. Circulation 1995; 91:2619.
- Zhang, F., Ram, J. L., Standley, P. R. et al.: 17 beta-estradiol attenuates voltage-dependent Ca2+ currents in A7r5 vascular smooth muscle cell line. Am. J. Physiol. 1994; 266:C975.
- Leathard, H. L., Eccles, N. K.: Does migraine result from a decrease in transmembrane potassium conductance? In: Advances in Headache Research ed.: F. Clifford Rose (John libby and Co. Ltd., London) p. 35.
- Opie, L. H, Singh, B. N.: Calcium channel antagonists (slow channel blockers). In.: Drugs for the hearth, ed.: L. H. Opie (Orlando, Fia: Grune and Stratton Inc.) p. 34.
- Edwards, G., Weston, A. H.: Potassium channel openers and vascular smooth muscle relaxation. Pharmacol. Ther. 1990; 48:237.
- Luotola, H.: Blood pressure and hemodynamics in postmenopausal women during estradiol-17ß substitution. Ann. Clin. Res. 1983; 15:9.
- Weiner, C. P., Lizasoain, I., Baylis, S. A. et al,: Induction of calcium-dependent nitric oxidé synthases by sex hormones. Proc. Natl. Acad. Sci. USA 1994; 91:5212.
- Polderman, K. H., Stehouver, C. D. A., van Kamp, G. J. et al.: Influence of sex hormones on plasma endothe- lin levels. Ann. Intern. Med. 1993; 118:429.
Dr. Székács Béla
SOTE II. sz. Belgyógyászati Klinika,
1088 Budapest, Szentkirályi u. 46.
Érbetegségek: 1997/4. 7-11. oldal


