Szerzők: DR. GADÓ KLÁRA1,2, MARKOVICS DORINA2, VIRÁG ANDREA2, DR. VAJDA ZOLTÁN3, DR. DOMJÁN GYULA1,3
1Semmelweis Egyetem, Egészségtudományi Kar, Egészségtudományi Klinikai Tanszék
2Általános Orvostudományi Kar, Geriátriai Klinika és Ápolástudományi Központ, Budapest
3Semmelweis Egyetem, Általános Orvostudományi Kar, Laboratóriumi Medicina Intézet, Budapest
A tromboembóliás esemény gyakori a közepes és súlyos COVID-19 betegségben. Az elmúlt időszakban több olyan esetről is beszámoltak, mely során megfelelő alvadásgátló kezelésben részesülő betegek is tromboembóliás szövődményt szenvedtek el az infekció során. Ugyancsak ismertté vált, hogy klinikailag tünetszegény COVID-esetekben is gyakran kialakul radiológiailag is igazolható trombotikus elváltozás a tüdőben. Nagy jelentőséget tulajdonítunk a betegek kezelése során a megfelelő alvadásgátlásnak, illetve azon paraméterek meghatározásának, amelyek segítségünkre lehetnek az alvadás aktivitásának megítélésében.
Érbetegségek: 2021/2. - 27-31. oldal
KULCSSZAVAK
COVID-19, thrombosis, antikoaguláns kezelés, tüdőembólia
Bevezetés
A tromboembóliás esemény gyakori súlyos COVID-19 megbetegedésben. A mortalitással szorosan összefügg a kórházi felvételkor regisztrált véralvadási zavar, mely az emelkedett D-dimer és fibrinogénszinttel, megnyúlt protrombinidővel, csökkent plazminogénszinttel és alacsony trombocitaszámmal jellemezhető. Nagyon fontos, hogy a trombózis-kockázatot felmérjük a kórházba történő felvételkor, mert ennek alapján dönthetünk a trombo profilaxis, illetve a kezelés mértékéről. A korai diagnózis alapvető, és ebben a gondos differenciál diagnosztikának nagy jelentősége van. Nem győzzük hangsúlyozni, hogy az antitrombotikus kezelésnek a betegség teljes tartama során, valamint a tromboprofilaxis és az antitrombotikus kezelés folytatása a hazabocsátást követően is mérlegelendő.
A kínai Hupej tartományban, Vuhan városában 2019 őszén egy korábban nem ismert vírus által okozott betegség jelent meg. A vírus a SARS-CoV-2 (severe acute respiratory syndrome coronavirus-2) elnevezést kapta, és feltehetően állatról terjedve vált emberi megbetegedés okozójává (zoonosis).
A SARS-CoV-2 által okozott megbetegedés, a COVID-19 (coronavirus disease-19) néhány hónap alatt az egész világon elterjedt, mostanáig (2021. február 22.) több, mint 111 millió megbetegedést és 2,5 millió halálesetet okozott (1). A betegség az esetek jelentős részében enyhe lefolyású, de kb. 5%-ban súlyos megbetegedés alakul ki. Súlyos betegség rizikó tényezői között említhető az idős kor, az obezitás, valamint a krónikus kardiális és pulmonális megbetegedések, és a cukorbetegség is. Meg kell említeni azonban, hogy fiatalokon is váratlanul igen súlyos, akár halálos kórforma is kialakulhat. A mutáns vírusok által okozott megbetegedésekkel kapcsolatos tapasztalatok várhatóan tovább árnyalják majd a képet. A COVID-19-et kiváltó vírus nagy affinitást mutat a tüdőszövethez, tüdőgyulladást okoz. A vírus által előidézett immunológiai reakció, a citokinvihar (cytokine storm) súlyos szervkárosodásokhoz vezet. A patológiai ismeretek bírtokában a súlyos betegek intenzív osztályos ellátása eredményesebbé vált.
A COVID-19 kapcsán a thromboemboliás történések gyakoribb előfordulását észlelték még olyan esetekben is, amikor a páciens tromboprofilaxisban részesült (2). Azok között a COVID-betegek között, akiknél trombózis alakult ki, lényegesen nagyobb volt a halálozás (3). Az esetek jelentős részében a trombózis post mortem diagnózis, de a boncolások alacsony száma miatt, az előfordulás valódi mértékét nem ismerhetjük (4).
Mind artériás, mind vénás thrombosis gyakrabban fordul elő COVID-19-ben (2). A véralvadási rendszer összetett módon változik meg. A koagulációs folyamatokban bekövetkezett változások alapvetően függenek össze a citokinviharral és az általa okozott mikrovaszkuláris károsodással.
A VÉRALVADÁS VÁLTOZÁSAI COVID-19-BEN
A D-dimer meghatározásával, a diagnosztikában és a terápiában betöltött szerepével kapcsolatosan számos közlemény olvasható. Az emelkedett D-dimer klinikai jelentőségének értékelése összetett feladat. Nemcsak az abszolút értéket kell figyelembe vennünk, hanem a változás dinamikáját is. A magasabb D-dimer értékek a halálozás szempontjából egyértelműen nagyobb kockázatot jelentenek. Kórházban kezelt súlyos betegek esetében a COVID-19-beteg 46,4%-ánál találtak kórosan emelkedett D-dimer-szintet. A D-dimer-szint szignifikánsan magasabb volt a súlyos betegeknél, az enyhe megbetegedésben szenvedőkhöz képest (5). A súlyos állapotban lévő COVID-19-betegek halálozása gyakoribb volt, ha a kórházi felvételkor emelkedett D-dimer értéket mértek (6).
Bar a D-dimer nem specifikus marker, negativ prediktiv erteke igen nagynak bizonyult: az 1,0 µg/ml alatti kiindulasi D-dimer erteknek venas thromboembolia vonatkozasaban 90%, mig a tud.emboliat tekintve 98% (7).
Ma már számos bizonyítékunk van arra, hogy a kórházi felvételkor észlelt jelentősen emelkedett D-dimer szint (a normál érték 3-4-szerese), a megnyúlt protrombinidő, a thrombocytopenia és az emelkedett fibrinogénszint a súlyos betegség prediktorai (8). Az alvadási paraméterek kóros volta egyértelműen a betegség kedvezőtlen kimenetelét jelzi.
A D-dimer emelkedés magyarázata lehet, hogy az infekció által kiváltott gyulladásos folyamat endothelaktivációt eredményez, ami jelentős trombintermelődéshez és korai fibrinolízishez vezet (9). További magyarázatként szolgálhat az alvadási rendszer eltéréseire a hypoxaemia okozta fokozott vérviszkozitás, valamint a hypoxia indukálta transzkripciós faktorok termelődése. COVID-19 esetében egy további, speciális tényező a tüdőben lokálisan kialakuló mikrotrombusok megjelenése, melyek hiszto - patológiai igazolása alapján fogalmazódott meg a fokális pulmonális trombózis fogalma (focal pulmonary thrombosis phenomenon) (10).
A fokozott alvadékonyság hátterében a trombin termelésen túl az antifoszfolipid antitestek, az immunthrombocytopeniához kapcsolódó trombózis és a SARS-CoV-2 által indukált trombocita-hiperreaktivitás is szerepet játszhatnak (11,12,13).
A gyulladás és a trombózis kapcsolatának egyik nagyon fontos tényezője a COVID-19 kapcsán kialakuló endotéldiszfunkció. A szisztémás alvadékonyságfokozódás, a thromboemboliás szövődmények mellett a mikrocirkuláció területén helyileg képződő alvadékok, a trombotikus microangiopathia is jellemzőek a COVID-19-coagulo - pathiára. Az „endotheliopathiának” a szintén gyakori cerebrovaszkuláris keringési zavar és szívinfarktus kialakulásában is szerepe van (14).
Covid-19 és a disszeminált intravaszkuláris koaguláció
Tang és mtsai 183 beteg adatát dolgozták fel, mely szerint a betegségben elhunytak 71,4%-a esetében a disszeminált intravaszkuláris koaguláció (DIC) diagnózisa megállapítható volt (3). Ez arra utal, hogy a DIC a betegség késői stádiumára jellemző. Ez nem meglepő, hiszen ismert tény, hogy a sepsis DIC-et okoz, így azoknál a COVID-19- betegeknél, akiknél sepsis alakul ki, DIC jelenlétét is gyakrabban észlelhetjük. A patomechanizmus megismerése segítséget nyújtott az intenzív terápiás kezelés eredményeinek javulásában.
Az American Society of Hematology (ASH) megállapítása szerint a COVID- 19-hez társuló DIC némiképp eltér a klasszikus DIC-től, amennyiben a thrombocytopenia kisebb mértékű, és nem látunk microangiopathiát sem (15).
Fontos a DIC korai felismerése. A sepsis indukálta coagulopathia fogalmának bevezetése nagy előrelépést jelentett abban a tekintetben, hogy a sepsisben kialakuló alvadási zavar súlyosságát minél pontosabban meg lehessen határozni. Ebben a betegségben az egyes szervek funkciózavara, a protrombinidő, valamint a trombocitaszám alapján képzett pontrendszer használatával pontosítható a DIC kritériumrendszere (16).
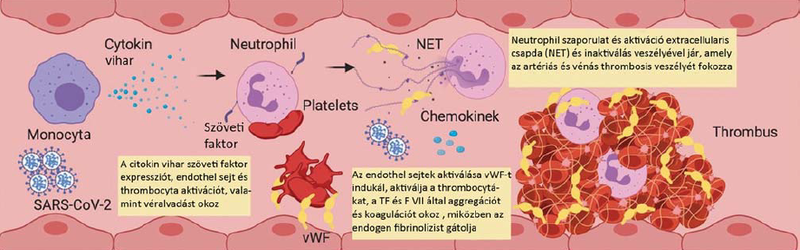
1. ábra.
Trombózishoz vezető intravacularis folyamat.
Covid-19 és a fibrinolízis
COVID-19-betegeknél az alvadási rendszer aktivációján, illetve az ennek kapcsán kialakuló felhasználódásos coagulopathián túl, a fibrinolízis fokozódása, a hiperfibrinolízis is meg figyelhető.
A fokozott mértékű fibrinolízis és a súlyos lefolyású COVID-19 közötti összefüggést magyarázhatja az, hogy azokban a kórképekben, amelyek a COVID-19 súlyos lefolyásának kockázatát növelik (hypertonia, diabetes, koszorúér-betegség, krónikus obstruktív tüdőbetegség, krónikus vesebetegség), a plazminogénszint emelkedett. A plazminogén a fibrinolízis egyik kulcsfontosságú enzimje, aktiválódását követően a fibrin kisebb fragmentumokra hasad, létrejönnek a fibrindegradációs termékek (FDP), köztük a D-dimer is.
A plazmin ugyanakkor fokozza a SARS-CoV-2 virulenciáját és patogenitását azáltal, hogy a vírus S-proteinjét (spike protein, tüskefehérje) hasítja, így az S-protein könnyebben tud kapcsolódni a humán gazdasejt ACE2 receptorához, ezzel megkönnyíti a vírus bekerülését a sejtbe (17). Ennek alapján a plazmin nemcsak a betegség súlyosságát jelző biomarker, hanem egyben új terápiás célpont is lehet. A hiperfibrinolízis megakadályozása céljából számos proteázinhibitorral folytatnak klinikai vizsgálatot (18).
A trombózis rizikófaktorai covid-19-ben
A súlyos, intenzív-terápiás ellátást igénylő betegek ismert trombózis-kockázatot növelő tényezőin túl (életkor, immobilitás, légzési elégtelenség, mechanikus lélegeztetés, centrális vénás katéter) számos egyéb, a COVID-19-hez kapcsolódó kockázati faktor járulhat hozzá a trombózis kialakulásához, így a súlyos hypoxaemia, a gyulladás és az endotél-diszfunkció (19).
A betegség klinikai megjelenése
A COVID-19 lefolyása a tünetmentes fertőzéstől az igen súlyos betegségen át a halálos kimenetelig terjed. Súlyosság szerint három kategória különíthető el (I) enyhe betegség: tüdőgyulladás nélkül, rendsze rint felsőlégúti infekció tünetei, 81%; (II) súlyos betegség: nehézlégzés, gyorsan progrediáló pulmonális infiltrátum, csökkent oxigén - szaturáció, 14%; (III) kritikus állapotú beteg: légzési elégtelenség, szeptikus sokk, sokszervi elégtelenség, 5% tényezőa (20). A betegséggel kapcsolatban közölt adatok értékelésekor figyelembe kell vennünk azt a tényt, hogy a fertőzöttek túlnyomó többségének enyhe betegsége miatt, orvosi vizsgálatra vagy kórházi felvételre nem kerül sor, ezért az ő adataik nem szerepelnek azokban a közleményekben, amelyekből a COVID-19-cel kapcsolatos információkat szerezzük (20).
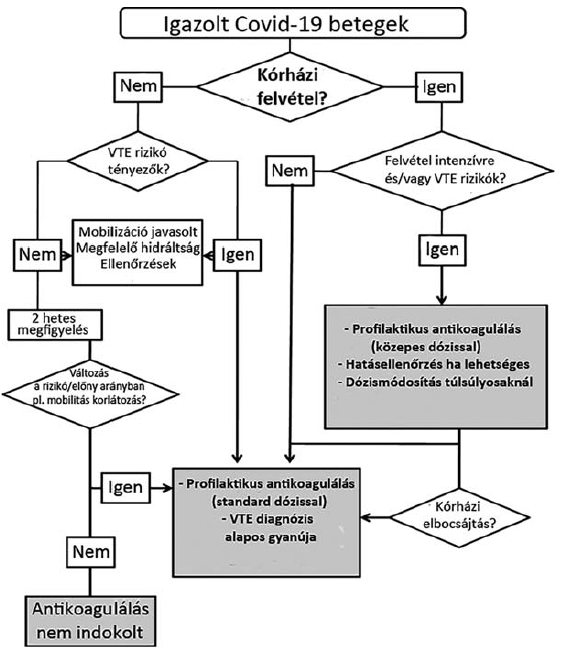
2. ábra.
Thromboembolia megelőzés algoritmusa.
A TROMBOTIKUS SZÖVŐDMÉNYEK MEGELŐZÉSE, KEZELÉSE
Laboratóriumi vizsgálatok
A COVID-19-ben szenvedő, kórházi ellátást igénylő - beteg felvételekor az alvadási paraméterek laboratóriumi vizsgálata szükséges. Így meg kell határozni a D-dimer szintet, a protrombinidőt, az aktivált parciális tromboplasztinidőt (aPTI), a fibrinogénszintet és a trombocitaszámot. Ezeknek a paramétereknek az időbeli változása, elsősorban a D-dimer emelkedése (a koaguláció aktivációját jelzi), valamint a fibrinogénszint és a trombocitaszám csökkenése (a DIC-t jelzi) nagyon fontos indikátora a folyamat súlyosbodásának. A gyulladásos paraméterek (C-reaktív protein, leukocitaszám, súlyos esetben proinflammatorikus citokinek) vizsgálata szintén szükséges (6,10). Az intenzív osztályon kezelt betegek alvadási paramétereit szorosan monitorozni kell.
Trombózis-kockázat meghatározás
A COVID-19 kapcsán a súlyos betegségben szenvedőknél jelentős arányban alakulnak ki trombózissal járó szövődmények. A koagulopátiával együtt járó megbetegedések esetében a halálozás is lényegesen nagyobb. A trombózis kockázatának megállapítása, a várható súlyos betegség minél korábbi előrejelzése rendkívül lényeges. Fontos tehát a nagy trombózis-kockázatú betegek azonosítása.
A kórházi felvételkor az alvadási vizsgálatok mellett (ezek adatait is felhasználva) el kell végeznünk a trombóziskockázat felmérését. Erre a célra több kockázat becslő modell (RAM) is rendelkezésünkre áll (Padua, Caprini, Geneva, IMPROVE) (21). A jelenlegi ajánlások szerint a kórházba kerülő, nagy trombózis-kockázatú betegeket tromboprofilaxisban kell részesíteni. Sajnos, a mindennapi gyakorlat sokban eltér az ajánlásoktól (22,23).
COVID-19-betegeknél a szokásos rizikótényezők mellett egyéb faktorok jelenlétét is számba kell venni. A hypoxaemia, a gyulladás jelenléte mellett az alvadási rendszer aktiválódását is fel kell mérnünk. A D-dimer nagyon hasznos paraméter ebből a szempontból. Míg az 1,0 µg/ml alatti D-dimer szint negatív prediktív értéke igen nagy (a trombózis kockázata alacsony), addig a 3,0 µg/ml feletti érték jelentős trombózis-kockázatot jelent, és ezért jóval erélyesebb tromboprofilaxis alkalmazása szükséges. Az International Society on Thrombosis and Haemostasis (ISTH) javaslata alapján valamennyi, kórházi felvételre kerülő COVID-19-beteg gyógyszeres tromboprofilaxisban részesítendő(24).
A tromboprofilaxis módja
Kis molekulatömegű heparin (LMWH) a legmegfelelőbb a trombózis megelőzés céljára. Egyszerű, biztonságos, a dózis meghatározása nem igényel laboratóriumi monitorozást. További előnye, hogy gyulladásgátló hatással is rendelkezik, és védőhatást gyakorol az endotelre (25). Nem frakcionált heparin (UFH) alkalmazása veseelégtelenség esetén jön szóba.
Javasolt dózis LMWH adása esetében
Bár nincs egységes ajánlás a javasolható dózisokat illetően, a legtöbben a szokásosnál nagyobb dózisú tromboprofilaxist részesítik előnyben (pl. enoxaparin, 0,5 mg/ttkg, naponta kétszer). Sokan a terápiás dózis felét ajánlják, naponta kétszer adott injekcióban. Obez betegeknek ennél is nagyobb dózist javasolnak. A nagyon súlyos, intenzív osztályon kezelt betegek esetében a terápiás dózis alkalmazására is sor kerülhet.
Mivel a kórházból történő hazabocsátást követően a trombózis-kockázat még több hónapig emelkedett, érdemes a tromboprofilaxist az elbocsátást követően is folytatni. Ilyenkor direkt orális antikoaguláns (DOAC) adása is elfogadható, mindig az egyéni tényezők gondos mérlegelése és a vérzés kockázatának figyelembevétele alapján (26). Tekintettel arra, hogy jelentős kóroki szerepük van az antifoszfolipid antitesteknek, jelenlétük esetén előtérbe kerülhet a K vitamin antagonisták alkalmazása.
Bár jelenleg nem áll rendelkezésünkre megfelelően elvégzett randomizált, kellőszámú beteg bevonásával végzett klinikai vizsgálat, így egységes ajánlásra sem hivatkozhatunk, mégis, magunk a svájci hematológus társaság (Sweitzerische Gesellschaft für Hematologie) ajánlásából emelnénk ki néhány gondolatot, melyet követendőnek tartunk (27):
- Minden, kórházban kezelt COVID- 19-beteget a kockázati pontszámának megfelelő mértékű gyógyszeres tromboprofilaxisban kell részesíteni, amennyiben ez nem ellenjavallt.
- A GFR 30 ml/perc/1,73 m2 feletti értéke esetén LMWH adására van szükség. A jelentős túlsúllyal rendelkező betegek esetében (100 kg fölött) emelt dózis alkalmazandó.
- A 30 ml/perc/1,73 m2 alatti GFR-értékű betegeknek nem frakcionált heparint (UFH) kell adni naponta 2-3-szor szubkután, vagy intravénás formában. A túlsúlyos betegek esetében (100 kg fölött) nagyobb dózis adása megfontolandó.
- A protrombin idő, D-dimer, fibrinogén, trombocitaszám, laktát-dehidrogenáz (LDH), kreatinin, glutamátoxálecetsav- transzamináz (GOT) meghatározása na ponta, de legalább hetente két-három alkalommal ismétlendő.
- Azoknál az intenzív osztályon kezelt betegeknél, akik súlyos gyulladás, máj- és veseelégtelenség jeleit mutatják, légzési elégtelenségük van, jelentősen emelkedett a D-dimer-szintjük, közepes vagy terápiás dózisú LMWH-kezelés adása megfontolandó, a vérzés kockázatának függvényében.
- Heparin indukálta thrombocytopenia (HIT) fennállására kell gondolni, ha a trombocitaszám ingadozó, vagy ha heparinrezisztencia jeleit észleljük.
- Extrakorporális membránoxigenizáció (ECMO) kezelésben részesülő betegeknél az anti-Xa aktivitást terápiás tartományba emelő dózisban nem frakcionált heparin alkalmazandó.
Irodalom
- https://covid19.who.int/?gclid=EAIaIQobChMIq96mw 4ro6QIVk4eyCh12twzFEAAYASAAEgIpGvD_BwE
- Klok F, Kruip M, van der Meer N, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 2020;191:148–150
- Tang N; Li D, Wang X, et al. Abnormal coagulation pa - rameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 2020;18:844–847
- Salerno M, Sessa F, Piscopo A, et al. No Autopsies on COVID-19 Deaths: A Missed Opportunity and the Lockdown of Science. J Clin Med 2020;9:E1472
- Guan WJ, Ni ZY, Hu Y, et al. China Medical Treatment Expert Group for Covid-19. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020;382:1708–1720
- Nagy Zs, Vásárhelyi B, Vajda Z. Koronavírus; életkortényezők; véralvadás; mortalitás. Orv Hetil 2020. 161. 41.1739-1743
- Artifoni M, Danic G, Gautier G, et al. Systematic assessment of venous thromboembolism in COVID-19 pa tients receiving thromboprophylaxis: incidence and role of D-dimer as predictive factors. J Thromb Thrombolysis 2020;50:211–216
- Terpos E, Ntanasis-Stathopoulos I, Elalamy I, et al. Hematological findings and complications of COVID - 19. Am J Hematol 2020;95:834–847
- Jákó J. A D-dimer laboratóriumi eredményeinek és klinikai értékelésének elemzése. Orv. Hetil. 2017.158.50: 1971–1976.
- Marongiu F, Grandone E, Barcellona D. Pulmonary thrombosis in 2019-nCoV pneumonia? J Thromb Haemost 2020;18:1511–1513
- Zhou X, Li Y, Yang Q. Antiplatelet Therapy Following Percutaneous Coronary Intervention in Patients Compli - cated by COVID-19: Implications from Clinical Features to Pathological Findings. Circulation 2020;141:1736–1738
- Zhang Y, Xiao M, Zhang S, et al. Coagulopathy and Antiphospholipid Antibodies in Patients with Covid-19. N Engl J Med 2020;382:e38
- Zulfiqar AA, Lorenzo-Villalba N, Hassler P, et al. Immune Thrombocytopenic Purpura in a Patient with Covid-19. N Engl J Med 2020;382:e43
- Varga Z, Flammer AJ, Steiger P, et al. Endothe lial cell infection and endotheliitis in COVID-19. Lancet 2020;395:1417–1418
- American Society of Hematology. COVID-19 and coagulopathy. https://www.hematology.org/covid-19/ covid-19-and-coagulopathy [letöltve 2020. április 20-án]
- Iba T, Levy J, Warkentin T, et al. Diagnosis and man agement of sepsis-induced coagulopathy and disseminated intravascular coagulation. J Thromb Haemost 2019;17:1989–1994
- Wang K, Chen W, Zhou Y-S, et al. SARS-CoV-2 invades host cells via a novel route: CD147-spike protein. BioRxiv 2020, DOI: 10.1101/2020.03.14.988345.
- Harrison C. Coronavirus puts drug repurposing on the fast track. Nat Biotechnol 2020;38:379–381
- Marchandot B, Sattler L, Jesel L, et al. COVID-19 Related Coagulopathy: A Distinct Entity? J Clin Med 2020;9:E1651
- Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID- 19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Preven tion. JAMA 2020;323:1239–1242
- Stuck AK, Spirk D, Schaudt J, et al. Risk assessment models for venous thromboembolism in acutely ill medical patients. A systematic review. Thromb Haemost 2017;117:801–808
- Schünemann HJ, Cushman M, Burnett AE, et al. American Society of Hematology 2018 guidelines for manage ment of venous thromboembolism: prophylaxis for hospitalized and non-hospitalized medical patients. Blood Adv 2018;2:3198–3225
- Gadó K, Kicsi D, Markovics D, Domján Gy. A thromboprophylaxis jelentősége nem sebészeti fekvőbeteg-osztályokon. Orv Hetil 2019;160: 654–661
- Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost 2020;18:1023–1026
- Thachil J. The versatile heparin in COVID-19. J Thromb Haemost 2020;18:1020–1022
- Khan I H, et al. The need to manage the risk of thromboembolism in COVID-19 patients. J Vasc Surg 2020, DOI: 10.1016/j.jvs.2020.05.015.
- Casini A, Alberio L, Angelillo-Scherrer A, et al. Thromboprophylaxis and laboratory monitoring for in-hospital patients with COVID-19 – a Swiss consensus statement by the Working Party Hemostasis. Swiss Med Wkly 2020;150:w20247. DOI: 10.4414/smw.2020.20247.
Prof. Dr. Gadó Klára,
Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2022/2. - 27-31. oldal


