A szerzők, összefoglaló közleményükben a COVID-19 fertőzés és a cardiovascularis rendszer kapcsolatát tekintik át. A COVID-19 endothel károsító hatását, valamint a létrehozott thrombophil állapot patho - mechanizmusát ismertetik. Egy Észak-olasz klinikai központ tapasztalatai alapján elemzik az akut végtag ischaemia (ALI), valamint az akut coronaria syndroma (ACS) és a COVID-19 fertőzés asszociációjának ellátási nehézségeit. Végül kitérnek az ACE-inhibitorok és az angiotenzin receptor blokkolók alkalmazásával kapcsolatos problémákra, COVID-19-cel szövődött hypertoniás esetekben.
Érbetegségek: 2021/1. - 5-8. oldal
KULCSSZAVAK
COVID-19, cardiovascularis rendszer, endothel, coronaria
Bevezetés
Az első súlyos akut légzőszervi szindrómával járó tüdőgyulladásos esetet, melyet a SARS-CoV2 vírus okozott, 2019 december végén Wuhanban (Hubei Tartomány, Kína) jegyezték fel (1). Ezt követően, 2020 márciusáig a vírus az egész világon elterjedt, melynek hatására egy magas megbetegedési és viszonylag magas halálozási kockázattal járó világjárvány alakult ki. A járvány nemcsak az országok egészségügyi rendszereit terhelte túl, de súlyos csapást mért a világ számos országának pénzügyi és gazdasági helyzetére is. A 2020-as évet az exponenciálisan növekvő esetszámok jellemezték, 2021-ben pedig elindultak a megelőző oltások.
A koronavírus egy pozitív, egyszálú RNS vírus, a Béta Coronavírusok nemzetségének tagja. A vírus felbukkanása óta intenzíven kutatják genomját és fehérjéit (2). A sejtek inváziója során a vírus az ún. "S" tüskefehérjével hozzákötődik a sejtmembránban elhelyezkedő angiotenzin-konvertáló enzim 2 (ACE2) receptorhoz, melynek segítségével a sejtbe jut (3). Az általa okozott akut légúti distressz szindróma pathomechanizmusát a citokinvihar jellemzi, melynek során számos proinflammatorikus citokin és kemokin szabadul fel, elsősorban a TNFa, IL-1b és IL-6, ezáltal többszervi elégtelenséget idéz elő (4) (1. ábra) (1. Táblázat).

1. ábra.
A COVID-19 fertőzés pathomechanizmusa.

1. táblázat.
Az eltúlzott immunválasz következményei.
COVID-19 és az endothel károsodás
Számos SARS-CoV-2 fertőzés miatti többszervi elégtelenségben elhunyt beteg szövettani vizsgálata feltárta, hogy az endothel sejtek a SARS-CoV-2 fertőzésnek közvetlen célpontjai (5-8). Elsősorban lymphocytás endotheliitist és az apoptotikus testek magas koncentrációját találták a tüdő, szív, vese és máj ereiben (8), valamint a vékonybél submucosalis ereiben (8), mely igazolást nyújthat az eltérő klinikai manifesztációk és a COVID-19 okozta endothel gyulladás összefüggésére. Varga és mtsai leírták a coronavírus fertőzéshez társuló endothel sejt aktivációt és az akut endothel gyulladás kialakulását (6), mely a létfontosságú szervekben micro- és macrovascularis thromboemboliákhoz vezethet (7).
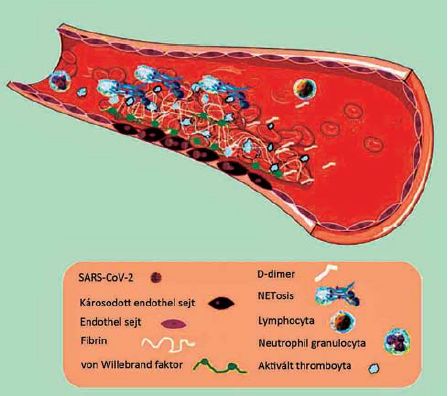
2. ábra.
Az intravascularis folyamat.

2. táblázat.
Laboratóriumi leletek.
Thrombophil állapot COVID-19 fertőzésben
Számos koronavírus fertőzésben szenvedő betegben pathológiás paraméterek (emelkedett D-dimer, csökkent vérlemezkeszám, és jelzetten megnyúlt prothrombin idő) alakulhatnak ki, mely válogatott esetekben olyan súlyossá válhat, hogy tromboembólia kifejlődéséhez vezet (9,10). Beszámoltak az említett paramétereken kívül a von Willebrand és a VIII-as faktor szintjének emelkedéséről is (10) (2. ábra) (2. Táblázat).
Egy, a wuhani kórházba felvett 343 koronavírus beteget bevonó retrospektív vizsgálatban leírták, hogy az emelkedett (2 mg/l feletti) D-dimer szint összefügg a betegség fatális kimenetelével, és a COVID fertőzés életveszélyes komplikációkkal járó formájának jó prediktív faktora lehet (11). Egy másik, 191 beteget vizsgáló retrospektív tanulmány szerint, ha a kórházi felvételkor a D-dimer szint meghaladja az 1 mg/l-t, akkor tizennyolcszoros a COVID fertőzés fatális kimenetének rizikója (12).
A klinikai tapasztalatok azt mutatják, hogy a COVID fertőzésben emelkedett a thromboemboliás események előfordulása és az elhalálozottak 74%-ában DIC alakult ki (10,13,14). A vénás oldalon, a kritikus állapotú fertőzötteknél leggyakrabban a mélyvénás thrombosis és masszív pulmonalis embolia fordul elő (15). A COVID szövődményeként kialakult artériás thromboemboliás események száma szintén növekedett: gyakoribbá vált az akut myocardialis infarktus, az akut végtag ischaemia és a stroke is.
COVID-19 és a cardiovascularis rendszer
Az első klinikai tanulmányok rámutattak arra, hogy a fertőzésre való fogékonyság és annak kimenetele nagymértékben függ a fennálló szív-érrendszeri betegségtől (CVD) (16,17). Az előzetes statisztikákból jól látható, hogy a COVID-19 fertőzésben szenvedők között igen gyakran fordulnak elő (előzőleg diagnosztizált vagy kezelt) krónikus betegségként szív-érrendszeri kórképek, melyek együttes fennállása jelentősen emeli a betegségben elhunytak arányát (18). Ugyanakkor maga a COVID-19 is elősegíti számos szív-érrendszeri betegség kifejlődését, mint a myocarditis, arrhythmia, akut coronaria syndroma és a vénás throm - boembolia (19,20). Gyermekkori válogatott esetekben a COVID-19 fertőzés után fellépő kóros immunválasz sokszervi gyulladást okozhat, melynek tünetei nagyon hasonlóak a Kawasaki szindrómához, melyre jellemző a kardiális diszfunkció és a koronáriák rendellenessége (21). Ez a kétirányú kapcsolat jól jellemzi a COVID-19 és a CVD viszonyát, de a háttérben álló patomechanizmusok minden részlete még ma sem ismert.
Egy észak-olasz klinika a cardiovascularis ellátás során tapasztalt megfigyeléseit 2021-ben publikálta. Meglepő módon, COVID-19 fertőzéssel összefüggésben az irodalmi adatok alapján várható gyakori vénás érintettséggel szemben, igen magas kardiális és perifériás artériákat érintő thrombotikus manifesztációkat észleltek. COVID-19 fertőzéssel összefüggő thromboemboliás eseteinek több, mint 30%-a artériás érintettségű volt, akut coronaria syndroma (ACS), vagy akut alsó végtagi ischaemia (ALI) manifesztációkban. A lehetséges okokat elemezve felmerült az akut végtag ischaemiás betegcsoport magasabb életkora, összevetve a pulmonalis embolia és az akut coronaria syndroma csoporttal. A másik lehetséges ok véleményünk szerint a thrombus összetételében volt tetten érhető, az akut végtag ischaemiás intervenciós csoportban inflammatorikus sejtekkel infiltrált, magas denzitású thrombusok kerültek eltávolításra. Meglepő módon a percutan coronaria intervenciók és az alsóvégtagi sebészi revaszkularizációk technikai jellegű komplikációi lényegesen magasabbak voltak COVID fertőzéssel összefüggésben a pandémia idején, összevetve a kórház korábbi monitorozott adataival. Úgy találták, hogy az akut végtagi ischaemiás csoportban a szokásosnál agresszívebb heparin terápiás protokoll vezetett a rethrombosisok gyakoriságának csökkenéséhez. Ezen tényekkel a COVID fertőzéshez társuló akut hiperkoagulabilitási állapotra hívják fel a figyelmet, a vírus indukálta agresszív endothel károsodás modelljét alátámasztva (21).
A COVID-19 és az akut stroke kapcsolatát Bereczki és mtsai foglalták össze a közelmúltban (22). Adataik szerint a COVID-19-es betegek 3-5%-ában alakulhat ki akut stroke. Ezek alapján az akut stroke nem tűnik ugyan gyakori szövődménynek, de összességében az akut cerebrovascularis megbetegedések tizenhétszer gyakoribbak az intenzív osztályos kezelést igénylő COVID-19 betegeknél, mint az általános ellátásban részesülők között (Wuhanban végzett tanulmány). Egyre több adat utal arra, hogy COVID-19 fertőzés esetén az akut stroke súlyosabb lefolyású. Az akut ischaemiás stroke patogenezise összetett, az inflammált thrombotikus folyamat, az agyi erek vírus inváziója, a cardiogén embolizáció és az atherosclerotikus plakk ruptúra a főbb pathológiai elemek, melyek elsősorban idős betegeket érintenek (22). Ezen adatok az antikoaguláló kezelés fontosságára hívják fel a figyelmet.
A koronavírus tüskefehérje és az ACE-2 receptor kötődés pathológiai szerepe fontos gyógyszertani kérdést vet fel, az ACE-inhibitorok (ACEI) és az angiotenzin receptor blokkolók (ARB) koronavírus fertőzésben történő alkalmazásával kapcsolatban. Az ACEI és ARB gyógyszerek emelik a szív-érrendszerben az ACE2 expresszióját (23-25), mely az ACE2 receptorok felszaporodása révén egyfelől elősegítheti a koronavírusok szöveti invázióját, tehát felmerül a kérdés, hogy érdemes-e ilyenkor elhagyni. A másik oldalon azonban, ezen gyógyszerek által megemelt ACE2 enzim jól ismerten a sok negatív hatással bíró angiotenzin II-t angiotenzin (1-7)-é alakítja, mely erős vazodilatáló, tenziócsökkentő, kedvező reverz remodellációs, antithrombotikus és ARDS-t kivédő hatása miatt, a szív-érrendszeri kórképekben és az akut tüdőkárosodásban is erős protektív hatással bír (26-28). Több tanulmány és a világ vezető Kardiológiai Társaságai (HFSA/ACC/AHA és ESC Hypertonia) megegyeznek abban, hogy nem javasolják az előzetesen ARB/ACEI gyógyszerekkel kezelt betegek esetében a nagy koronavírus infekciórizikó/infekció bekövetkezése esetén sem, az említett gyógyszerek lecserélését, vagy elhagyásukat, ugyanakkor a COVID-19 fertőzöttekben az ACEI/ARB kezelés rutinszerű elindítására még nem áll rendelkezésre elegendő bizonyíték, bár kisebb esetszámon a mortalitás csökkenéséről számoltak be (26-28).
Irodalom
- Zhou P, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 2020;579:270–273.
- Lu R, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 2020;395:565–574.
- Hoffmann M, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 2020;181:271– 280.
- Tay MZ, Poh CM, Renia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat. Rev. Immunol. 2020;20:363–374.
- Wichmann D, et al. Autopsy findings and venous thromboembolism in patients with COVID-19. Ann. Intern. Med. 2020 doi: 10.7326/M20-2003.
- Varga Z, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet 2020;395:1417– 1418.
- Becker RC. COVID-19 update: Covid-19-associated coagulopathy. J Thromb Thrombolysis 2020;50:54–67.
- Teuwen L-A, Geldhof V, Pasut A, Carmeliet P. COVID- 19: the vasculature unleashed. Nat Rev Immunol. 2020;20:389–391.
- Moutchia J, Pokharel P, Kerri A, McGaw K, Uchai S, Nji M, Goodman M. Clinical laboratory parameters associated with severe or critical novel coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis. PLoS One. 2020 Oct 1;15(10):e0239802. doi: 10.1371/journal.pone.0239802. eCollection 2020.PMID: 33002041.
- Panigada M, et al. Hypercoagulability of COVID-19 patients in intensive care unit. A report of thromboelastography findings and other parameters of hemostasis. J. Thromb. Haemost. 2020;18:1738–1742.
- Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, Zhang Z. J Thromb Haemost. 2020 Jun;18(6):1324-1329. doi: 10.1111/jth.14859.
- Zhou F, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395:1054–1062.
- Tang N., et al., Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. Journal of Thrombosis and Haemostasis 2020. 18(4): p. 844–847. pmid:32073213
- Ranucci M, et al. The procoagulant pattern of patients with COVID-19 acute respiratory distress syndrome. J. Thromb. Haemost. 2020;18:1747–1751.
- Danzi GB, Loffi M, Galeazzi G, Gherbesi E.. Acute pulmonary embolism and COVID-19 pneumonia: a random association? Eur Heart J 2020;doi: 10.1093/eurheartj/ehaa254.
- Clerkin KJ, et al. COVID-19 and cardiovascular disease. Circulation 2020;141:1648–1655.
- Madjid M, Safavi-Naeini P, Solomon SD, Vardeny O. Potential effects of coronaviruses on the cardiovascular system: a review. JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.1286.
- Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72314 cases from the Chinese Center for Disease Control and Prevention. JAMA. 2020 doi: 10.1001/jama.2020. 2648.
- Shi S, et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020 doi: 10.1001/ jamacardio.2020.0950.
- Guo T, et al. Cardiovascular implications of fatal outcomes of patients with coronavirus disease 2019 (COVID-19) JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.1017.
Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet 2020;395:1607–1608. - Bellosta R, Pegorer MA, Bettari L, Luzzani L, Attisani L, Fossati A, Consoli L, Maffeo D, Cuccia C, Terragnoli P, Bush RL, Piffaretti G. Major cardiovascular events in patients with Coronavirus Disease 2019: Experience of a cardiovascular department of Northern Italy. Thromb Res. 2021 Jan;197:202-204. doi: 10.1016/ j.thromres.2020.10.038. Epub 2020 Nov 6. PMID: 33260043; PMCID: PMC7647441.
- Böjti P.P., Bereczki D. A COVID-19 és az akut stroke kapcsolata; Metabolizmus, 2020, 18. évf. 5. szám.
- Ferrario CM, Jessup J, Chappell MC, Averill DB, Brosnihan KB, Tallant EA, Diz DI, Gallagher PE. Effect of angiotensin]converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin]converting enzyme 2. Circulation 2005;111:2605.2610.
- Karram T, Abbasi A, Keidar S, Golomb E, Hochberg I, Winaver J, Hoffman A, Abassi Z. Effects of spironolactone and eprosartan on cardiac remodeling and angiotensin]converting enzyme isoforms in rats with experimental heart failure. Am J Physiol Heart Circ Physiol. 2005;289:H1351.H1358.
- Ishiyama Y, Gallagher PE, Averill DB, Tallant EA, Brosnihan KB, Ferrario CM. Upregulation of angiotensin]converting enzyme 2 after myocardial infarction by blockade of angiotensin II receptors. Hypertension. 2004;43:970.976.
- Rico-Mesa JS, White A, Anderson AS. Outcomes in Patients with COVID-19 infection taking ACEI/ARB. Curr Cardiol Rep. 2020 Apr 14;22(5):31. doi: 10.1007/s11886-020-01291-4.
- Guo J, Huan Z, Lin L, Lv Jiagao. Coronavirus Disease 2019 (COVID-19) and Cardiovascular Disease: A Viewpoint on the Potential Influence of Angiotensin- Converting Enzyme Inhibitors/Angiotensin Receptor Blockers on Onset and Severity of Severe Acute Respiratory Syndrome Coronavirus 2 Infection. J Am Heart Assoc. 2020 Apr 7;9(7):e016219. doi: 10.1161/JAHA.120.016219.
- Zhang X, Yu J, Pan LY, Jiang HY. CEI/ARB use and risk of infection or severity or mortality of COVID-19: A systematic review and meta-analysis. Pharmacol Res. 2020 Aug;158:104927. doi: 10.1016/ j.phrs. 2020. 104927.
Levelezési cím: dr.soltesz.pal kukac gmail.com
Érbetegségek: 2021/1. - 5-8. oldal


