Az alsó végtagi krónikus vénás elégtelenség jelentős népegészségügyi probléma. Patogenetikailag a megemelkedett, járáskor sem csökkenő vénás nyomás vezet a kórállapot kialakulásához és fokozatos súlyosbodásához. Az egyik követelmény a kapillárisokon kiszűrődő fibrin lerakódása, amely nehezíti a további tápanyagcserét. A másik egy gyulladásos folyamat fellépése, amely miatt a leukocyták átlépnek a hajszálerek falán, melyet követően a széteső fehérvérsejtekből szabadgyökök kerülnek a szövetekbe, ezek károsítják környezetünket, elsősorban a sejteket. A krónikus vénás elégtelenség klinikai folyamata végül ulcus cruris kialakulásához vezet. Ennek kezelésében kiemelt szerepe van a magas vénás nyomás csökkentését célzó kompressziós kezelésnek, a vénás rendszer pathológiai elváltozásait javító, leggyakrabban ablatív véna műtéteknek, az eudothel funkciót segítő gyógyszeres kezelésnek és a vénás keringést javító fizikoterápiának.
Érbetegségek: 2004/4. 123-133. oldal
KULCSSZAVAK
krónikus vénás elégtelenség, ulcus cruris, patogenezis, terápia
Bevezetés
A világszerte komoly népegészségügyi problémaként megjelenő krónikus vénás elégtelenség patogenezise és klinikai képe szoros összefüggésben van a többi, vénás rendszert érintő betegséggel, amelyek egymás kialakulását elősegítik, és végül circulus vitiosust indítva ulcus crurisba torkollnak. A betegségláncolat elindítója az állandósult magas vénás nyomás, amely krónikus gyulladás és egyéb patogenetikai tényezők segítségével a mikrocirkulációt nagy mértékben károsítja, így az érintett terület szöveti destrukciójához vezet. Az állapotmegítélésre és stádiumbesorolásra alkalmas eszköz, a CEAP klasszifikáció már 1995-től rendelkezésre áll (1). Segítségével egységes diagnosztikus és terápiás eljárások alakíthatók ki. A bonyolult patogenetikai háttérnek megfelelően, komplex szemléletet kell tükröznie a betegség kezelésének is. Ennek szellemében a vénák ablatív és rekonstruktív műtéteit, valamint a kompressziós kezelést érdemes kiegészíteni a sejtszintű folyamatokra direkt ható endothel-szupportív terápiával.
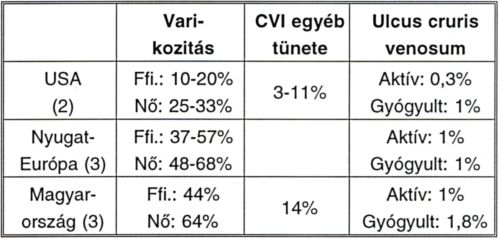
I. táblázat.
A krónikus vénás elégtelenség epidemiológiája.
A probléma nagysága
A CVI előfordulása jelentős földrajzi, kulturális és nembeli különbségeket mutat. Általánosságban elmondható, hogy részben az álló és ülő helyzetben végzett munka, részben a fizikai inaktivitás következtében a nyugati társadalmakban igen magas, 60%-ot elérő az alsó végtagi véna betegségek prevalenciája (I. táblázat).
Kialakulásában szerepet játszik, vagyis rizikófaktorként tarthatjuk számon a családban előforduló varikozitást, a terhességet, az életkor előrehaladását, az álló és ülő munkakört, a fizikai inaktivitást, vagy éppen a nehéz fizikai munkát, valamint a női nemet. Feltételezhető a diabetes mellitus, a hiperlipidémiák, a hipertonia, a dohányzás és fogamzásgátlók szedésének patogenetikai szerepe. Magyarországon 800.000 felnőttnél lenne indikált visszérműtét elvégzése, és ezáltal 200.000 ulcus cruris venosumban szenvedő ember betegségének jó része megelőzhető volna (3)! Fekély kifejlődése esetén a prognózis kifejezetten rossz: csak 50%-uk gyógyul négy hónap alatt, 20% két év után, 8% pedig még 5 év után is perzisztál, a kiújulás valószínűsége pedig évente 6-15%.
A rendelkezésre álló összefoglaló közlemények adatai alapján úgy gondoljuk, hogy az összesített prevalencia valószínűleg alábecsült, a különböző stádiumok a közlemények adatai alapján nem hasonlíthatók össze, valamint a terápiás döntések és eljárások is különbözőképpen zajlanak le. Ezek miatt megerősítve érezzük mindazok véleményét, akik a napi klinikusi gyakorlatban is sürgetik a CEAP klasszifikáció használatát, hiszen enélkül csak pontatlan és igen hézagos információnk vannak ezen egészségügyi-szociális-gazdasági probléma valós nagyságáról.
Az alsó végtagi vénás rendszer felépítése, keringésélettana
Az alsó végtag vénás keringésében számos speciális elemet találunk, amelyek fontos szerepet töltenek be a kóros folyamatok kialakulásában. A nagy hidrosztatikai nyomás miatt kiemelkedő jelentőséggel bírnak a vénák billentyűi, amelyek a vér áramlását kizárólag a jobb pitvar felé engedik. Az alsó végtag felszínén, különböző rétegekben vénás nexusok találhatók, amelyek a nagy nyomásingadozás közben is megfelelő elfolyási pályákat biztosítanak. E plexusok felszíni nagy vénákba torkollnak. A felszíni vénák nincsenek izmok közé ágyazva, ezért keringésük nagy mértékben függ a hidrosztatikai nyomástól, azaz a testtartástól és az egész alsó végtagi keringés épségétől. A mélyvénák ezzel szemben a láb izomzatának erős kötőszövetes burkában futnak, így a hidrosztatikai nyomáson kívül az izmok összehúzódása is hat a bennük folyó vér áramlására. A felszíni vénákat perforánsok kötik össze a mélyvénákkal. Szintén nagy jelentőséggel bír a láb nyirokkeringése, amely az intersticiális térbe kijutott folyadékot és leukocytákat - részben az izompumpa segítségével - visszajuttatja a vérkeringésbe. (A vénabetegségek összefüggéseit az 1. ábra mutatja.)
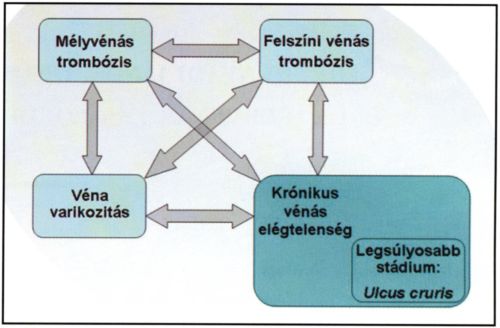
1. ábra.
A vénabetegségek összefüggései. A vénák betegségei patogenezisükben összefüggenek, egymás kialakítására hajlamosítanak.
A krónikus vénás elégtelenség szempontjából lényeges kiemelni, hogy a vénák nem tekinthetők egyszerű tágulékony csöveknek. A vénafal izomzata jelentős szabályozás alatt áll (neuro-humorális faktorok és az érfal tenzió által), így nem meglepő, hogy a falvastagság 2,5-3-szoros értékek között ingadozhat egyazon véna területen (5), ami pedig az érlumen átmérőjét hasonló ínértékben befolyásolja (4). A megfelelő vénafal-izomműködéshez - minthogy energiaigényes, aktív folyamatról van szó - erőteljes saját érhálózatra van szükség. Kevéssé közismert, hogy a vénák vasa vasoruma jóval sűrűbb és szerteágazóbb, mint az artériáké (6). A vénák media rétegébe a kis vénás nyomás miatt sokkal mélyebbre hatolnak az arteriolák, kapillárisok és venulák, mint a hasonló falvastagságú artériákban (6). Könnyen belátható, hogy a mikrocirkulációs zavarok a vasa vasorumon keresztül a nagy vénák (és artériák) funkcióját közvetlenül is károsíthatják.
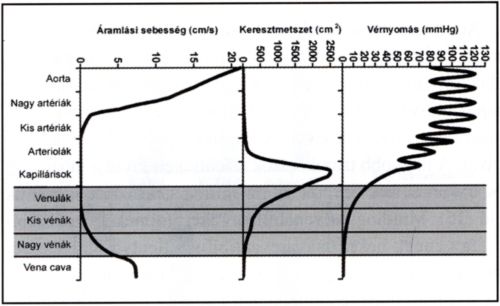
2. ábra.
A vérnyomás, az összkeresztmetszet és az áramlási sebesség összefüggései a nagyvérkörben.
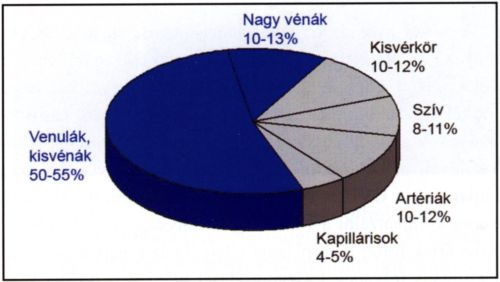
3. ábra.
Volumenmegoszlás az erekben. Adott időpillanatban a vénás oldalon van a vértérfogat 60-70%-a.
A vérnyomás az artéria-kapilláris-véna sorban folyamatosan csökken, hiszen csak így jöhet létre folyamatos véráramlás. Az erek összkeresztmetszete a kapillárisoknál a legnagyobb, ezért a vér áramlási sebessége itt éri el a minimumát (2. ábra). A kapillárisok azonban rövid erek, amelyek nagy része aktuálisan zárva van, ezért a vér legnagyobb mennyisége a venulákban és kisvénákban található meg (4), (3. ábra). A venulákban lévő kis nyomás, lassú áramlási sebesség és az endothel sejtek alkotta óriási felszín magyarázza, hogy ezek az érszakaszok a leukocyták szövetek közétörténő kivándorlásának a legfontosabb -jó keringés esetén szinte kizárólagos! - helyszínei, így a gyulladásos folyamatok elindulásának is kritikus pontjai.
A szív pumpafunkciója elegendő ahhoz, hogy a vért az artériás oldalon bárhova eljutassa, azonban a kis artériákon, arteriolákon és kapillárisokon olyan mértékű nyomásesés következik be, hogy a vénás oldalon, a legdistalisabban elhelyezkedő területeken (láb) a hidrosztatikai nyomás megakadályozza a jobb pitvarba történő visszaáramlást. Ennek megoldására több segítőmechanizmus is kifejlődött, amelyeket azért érdemes felidézni, mert bármelyik sérülése a láb vénáiban fokozott nyomást, lassult áramlást és megnövekedett pangó vérmennyiséget idézhet elő. Az egyik mechanizmus a belégzéskor keletkező negatív mellűri nyomás, amely szívóerőt hoz létre a perifériáról a centrális rendszer felé. A másik a láb izompumpája, amely ritmikusan nagy nyomást generál a mélyvénákban. Ez utóbbi több mint 60 Hgmm-es nyomásesést is jelenthet az izmok elernyedési periódusaiban (2). Egyik fent leírt mechanizmus sem lenne elegendő, ha nem akadályozná meg a jobb pitvar felé mozgó vér visszaáramlását a vénákban elhelyezkedő számos billentyű (4.)
Patogenezis
Az alsó végtagi krónikus vénás elégtelenség (Chronic Venous Insufficiency, CVI) az emelkedett vénás nyomás által elindított folyamat, amely a vénák strukturális és funkcionális elváltozását eredményezi. A CVI patogenezisének kezdetét a vénafal és a vénabillentyűk elsődleges hibája, illetve a megelőző felszíni vagy mélyvénás trombózis következtében kialakult másodlagos hibája jelenti (2). A vénás nyomásfokozódás egy kaszkádszerű folyamatot indít be, amely beavatkozás nélkül egyre súlyosbodó stádiumokon keresztül végső soron ulcus cruris venosumhoz vezet.
A vénás n-yomásviszonyok megváltozása elsődleges oki tényező a CVI kialakulásában. A vénafal és vénabillentyűk veleszületett vagy szerzett hibája a vénás nyomást nagy mértékben fokozza a végtag distalisabb részében. Elsősorban a sok állással járó munka a billentyűk túlzott igénybevételével, az állandóan nagy hidrosztatikai nyomás miatt hajlamosít a CVI-re. A nagyobb vénás nyomást egy ideig képes kompenzálni a vénák tágulékonysága, azonban bizonyos érték fölött a vérplazma elhagyja az érpályát és az intersticiális folyadék felszaporodását indukálja: ödéma képződik. A krónikusan magas nyomás, gyulladásos faktorokkal együtt, kinyitja az arteriovenózus shuntöket (7), a kapillárisokat kitágítja és megnyújtja, ezáltal megnövelve az átáramlott vér mennyiségét (8). A shuntök miatt megnövekedett perfúzió ugyanakkor nem jelent jobb oxigén- és tápanyag-ellátottságot, sőt ellenkezóleg, ezeken a területeken hipoxia és tápanyaghiány mérhető (9). A jelenség hátterében az áll, hogy a kapilláris vénás szárán kialakult nagy nyomás miatt nincs a hajszálér áramláshoz szükséges nyomáskülönbség, valamint a későbbiekben ismertetendő egyéb folyamatokkal együtt ez átalakítja az endothel sejtek kapcsolatrendszerét, így az endothel sejtek között a plazma minden komponense képes kijutni. Itt fontos megjegyezni, hogy gyulladás nélkül a magas transzmurális nyomás önmagában nem okoz permeabilitás növekedést, hanem még jobban erősíti az endothel-endothel sejtkapcsolatokat (10). A kapillárisokból kijutott folyadék jelentősen megnöveli a diffúziós távolságot. A magas nyomás a nyirokkeringést is károsítja, ezért a kapillárisokból kiszűrődött anyagok nem kerülnek vissza megfelelően a vérbe. A plazmakomponensek közül a legfontosabb a fibrinogén, amely a kapillárisok körül fibrin hüvellyé alakulva jelentősen rontja az oxigén- és tápanyag-diffúziót ( 11 ). Ezt a folyamatot súlyosbítja, hogy a fibrinolízis gátolt az ödémás területeken, mert lokálisan emelkedett a plazminogén-inhibitor-1 (PAI-1) koncentrációja (12). Ugyanakkor a kapillárisokba került nagy mennyiségű leukocyta (ebben a fázisban főként neutrofil granulocyta) a diszfunkciós kapillárisokba bekerülve és az endothel sejtekhez tapadva okklúziót okoz, valamint szabadgyököket termel (13).
Az emelkedett vénás nyomás ugyan a legfontosabb patogenetikai tényező és a folyamat elindítója, azonban sok egyéb faktor is befolyásolja a CVI kimenetelét. Fontos kiemelni, hogy az alábbiakban leírt tényezők jelentősen hatnak egymásra is, tehát nem tekinthetők független rizikófaktoroknak.
Ismert, hogy terhesség alatt is számottevően megnő a CVI kockázata, azonban az nem tisztázott, hogy a vénás elfolyás akadályozottsága mellett a hormonális hatások milyen módon vesznek részt a patogenezisben.
Adott genetikai háttér és bizonyos életstílus más faktorokkal együttműködve mikro-, illetve makrotrombusok kialakulásához vezethetnek. A kisebb trombusok az endothel sejtek aktivációját idézik elő (l4), amely együtt járhat a permeabilitás növekedésével és krónikus gyulladás kialakulásával. A nagyobb trombózisok a fentieken kívül a tápanyag és oxigénellátás zavarát és az intima nekrózisát idézhetik elő (15). Minthogy a vénabillentyűket intimakettőzet alkotja, így ennek nekrózisa irreverzibilis billentyű elégtelenséget okoz. A trombus, lecsökkentve vagy megszüntetve a véna átjárható lumenét, emelkedett nyomást hoz létre az adott vénától a kapillárisokig.
A krónikus gyulladás - amelyet fertőzésekre való fokozott fogékonyság, immunregulációs zavarok, tumorok és örökletes tényezők együtt vagy külön-külön is kiválthatnak - szintén kulcsfontosságú a CVI patogenezisében. A gyulladás együtt jár a kapillárisok és a venulák fokozott permeabilitásával, ami még normális vénás nyomás mellett is ödémát hoz létre. A gyulladás helyén leukocyták lépnek ki az érrendszerból (16). A kijutott leukocyták újabb gyulladásmediátorokat, valamint a sejteket közvetlenül is károsítani képes szabadgyököket termelnek.
A szabadgyökök oxidálják az extracelluláris mátrix komponenseit, a sejtek fehérjéit és nagyobb koncentrációban a DNS-t is. A szabadgyökök kisebb koncentrációban tovább stimulálják a makrofágok, fibroplasztok és endothel sejtek gyulladásos mediátor termelését, önerősítő kört hozva létre. Szabadgyököket nemcsak a lokálisan jelenlévő leukocyták termelnek, számos más betegség, illetve életstílus kapcsán is emelkedhet szintjük. Diabetes mellitusban és hiperlipidémiákban nagy mennyiségű oxidált cukor-, illetve zsírmolekula található a keringésben, ami önmagában is gyulladást válthat ki, másrészt utalhat a megnőtt oxidatív stresszre. A dohányzás szintén magas szabadgyök szintet hoz létre, így érthető, hogy a diabetes mellitusszal és lipidanyagcsere zavarokkal együtt miért jelent kockázati tényezőt a krónikus vénás elégtelenség kialakulásában (17).
Az ödéma kialakulása tehát nem csak a nyomásviszonyoktól függ, hanem az összes eret - így a vénákat is - borító endothel sejtek aktuális állapotától is. A fent leírt patogenetikai tényezők (szabadgyökök, gyulladásos folyamatok és trombózis) eredője az endothel sejtek működészavara, amely során a sejtkapcsolatok szerkezete megváltozik. A diszfunkciós endothel sejtek olyan adhéziós molekulákat és citokineket termelnek, amelyek a leukocyták és a trombocyták megtapadását, illetve a leukocyták extravazációját segítik elő a venulákon, majd a folyamat eredményeként a kapillárisokon is (4. ábra), (18). Csökken a tight junction (zonula occludens) kapcsolatok mennyisége, sejtek és makromolekulák is könnyen átjuthatnak az ereken (5. ábra). Az endothel sejtek növekedési faktor termelése, a véralvadást és az izomtónust szabályozó képessége is megváltozik (19, 20,21).
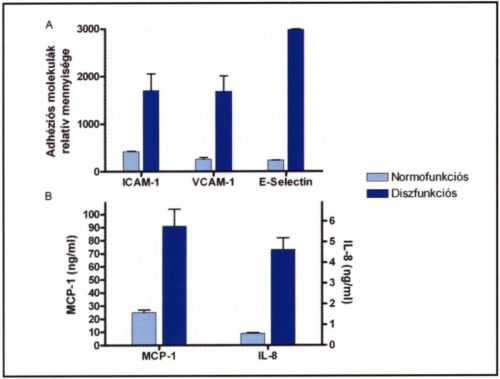
4. ábra.
Normofunkciós és diszfunkciós endothel sejtek tulajdonságai. A./ Az endothel sejtek 3 legfontosabb, leukocytákat megkötő adhéziós molekulája alig expresszálódik jól működő endothel sejteken, míg a funkció károsodás (gyulladás) erőteljes expressziónövekedést okoz (sejtes ELISA). B./ Hasonló jelenség figyelhető meg a makrofágokra/monocytákra ható MCP-1 és a limfocytákra ható IL-8 esetében (szendvics ELISA).
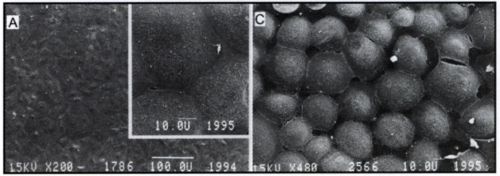
5. ábra.
Hipoxia hatása az endothel sejtek permeabilitására. A./ Normoxiás endothel sejtek között szoros sejtkapcsolat (tight junction) figyelhető meg (pásztázó elektronmikroszkóp, kis- és nagy nagyítású kép). B./ A normoxiás sejtek hálózatát kirajzoló PECAM-1 adhéziós molekula jól mutatja a szoros illeszkedést (fluoreszcens mikroszkóp). C./ Hipoxia hatására az endothel sejtek közötti kapcsolat meglazul, mikrométeres nagyságrendű rések alakulnak ki (pásztázó elektronmikroszkóp).
A CVI-t a klinikai kép alapján több egymást követő, részben átfedő stádiumra lehet felosztani, amelyekben másmás patológiai folyamatok dominálnak. A hiperpigmentációs stádiumban a plazmakomponenseken kívül vörösvértestek is kijutnak a kapillárisokból, majd lebomolva hemosziderin képződéshez vezetnek (22), ami tovább fokozza a szövetek elhalását. A stasis dermatitis ekcémás panaszait és tüneteit a lokálisan felhalmozódó hízósejtek és granulocyták által termelt mediátorok (főként hisztamin és bradikinin) okozzák, hozzájárulva a permeabilitás növekedéséhez. A lipodermatoszklerózis stádiumban a bőr és a kötőszövetek szklerózisa miatt a nyirokkeringés súlyosan károsodott, a tágult kapillárisok már a leukocytákat (főleg T sejteket és makrofágokat) is átengedik (23), a képet a gyulladás és az azt követő atrófia uralja. Az atrophie blanche stádiumban a kitágult kapillárisok megjelennek a bőrfelszínen, közöttük atrófiás területek és mikrofekélyek találhatók. Végül az atrófiás hipoxiás-reperfúziós, gyulladásos területeken a legkisebb sérülés sem tud begyógyulni, sőt egyre kiterjedtebb sebfelület, ulcus cruris alakul ki (6. ábra).
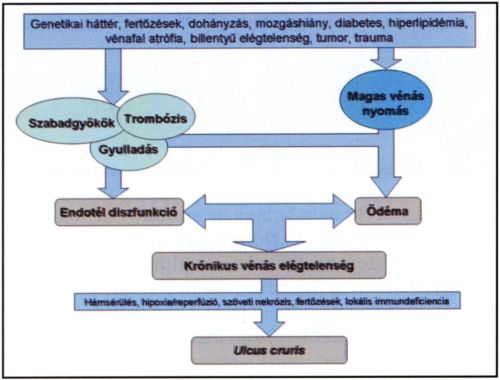
6. ábra.
A krónikus vénás elégtelenség és az ulcus cruris kialakulásának folyamata.
A rövid ideig fennálló hipoxia beindítja a fibroblasztok, endothel és epitél sejtek proliferációját, azonban a CVI legsúlyosabb stádiumában már nem képes neovaszkularizációval kompenzálódni az oxigénhiány. Az állandósult hipoxia és tápanyaghiány gátolja a sebgyógyulást (24). Hiába lépnek ki leukocyták az ödémás szövetbe, oxigén hiányában zavart szenved múködésük, ami egy nem jól szabályozott, nem specifikus immnunreakcióhoz vezet, így a nekrotizált területeken a fertőzést sem tudják kontrollálni (24). A mikrocirkuláció súlyos károsodása megakadályozza, hogy a fent leírt folyamatok normalizálódjanak; ez érthetővé teszi, hogy az ulcus cruris miért egy önfenntartó, progrediáló betegség, amely gondos orvosi beavatkozás nélkül nem képes meggyógyulni.
A sikeres gyógyítás érdekében ezért elméletileg az összes fent említett ponton érdemes beavatkozni, azaz kompressziós módszerrel csökkenteni a vénás pangást, az ödémát, mozgással fokozni az izompumpa működést, gyógyszeresen csökkenteni a szabadgyökök mennyiségét és a gyulladást, helyrehozni az endothel sejtek működését, baktérium ellenes szerekkel megállítani a fertőzést, végül javítani a véráramlást és támogatni a sebgyógyulást sebészeti módszerekkel, illetve bőr-transzplantációval. A gyógyszeres beavatkozásra mind a gyulladáscsökkentés (25, 26), mind az endothel funkció javítása terén (27, 28) történtek reménykeltő vizsgálatok. Minthogy a CVI patogenezisének komplex szemlélete csak az utóbbi időben kezdett elfogadottá válni, ezért szükség van nagy mintaszámú komplex klinikai vizsgálatokra, melyekkel az előbbi lehetőségek optimális kombinációját be lehetne állítani.
Végül nem szabad elfeledkezni arról, hogy az ulcus cruris megelőzése - mint minden betegség esetében - egyszerűbb, hatékonyabb és olcsóbb, mint a kialakult állapot kezelése.
Klinikai megjelenési formák
Tünetek
A patomechanizmus alapján érthető, hogy a beteg panaszai fokozódnak minden olyan helyzetben, amikor az alsó végtagi vénákban a hidrosztatikai nyomás növekszik (például függőleges testhelyzet, fizikai inaktivitás). A betegségcsoport egyik legáltalánosabb és talán legkorábban jelentkező tünete az alsó végtagok elnehezülése, amely terhelésre vagy magasabb hőmérsékleti hatásra jelentkezik. Az érintett végtag ödémája szintén fizikai inaktivitás, illetve álló testhelyzet hatására fokozódó tünet, amely elsősorban a nyári hónapokban okoz panaszt. A jobb kamra elégtelenség tünetével egyezően, általában hosszabb fekvés után az ödéma csökken. Klinikailag jelentős poszttrombotikus szindróma nélkül is, a betegség kialakulása során mindvégig zajlik a vörösvérsejtek extravazációja és lebomlása. Ennek következményeként hemosziderin képződik, amely barnás pigmentációként jelenik meg. Okként vagy okozatként, de a varikozitás valamely súlyossági fokban - ritka kivételektől eltekintve - szinte mindig megtalálható. A legnagyobb hidrosztatikai nyomásnak kitett hely a belső talpél finom vénás hálózata, ezért rendszerint itt van az első makroszkópos érelváltozás, a corona phlebectatica paraplantaris, előbbutóbb a kapilláris területek (pókvéna, spider véna), venulák (retikuláris vénák) vagy a törzsvéna oldalágak (varikozitás) jellegzetes patomorfológiája figyelhető meg álló betegen. Előrehaladottabb stádiumban a betegek jelentős része panaszol kínzó viszketést, amelyet az alsó lábszár, illetve a belboka területén látható ekcéma (stasis) dermatitis okoz krónikus gyulladás (hízósejt, granulocyta) fenntartása által. A betegség lényegéből adódó fokozódó szöveti hipoxia és mikrovaszkuláris szklerózis a dermis és az epidermis rossz tápanyagellátottságát okozza. Ezért helyenként elefántcsontszínű szklerotikus plakkok láthatók, amelyekben kis piros pontokként ismerhető fel a dilatált abnormális mikrovaszkulatúra (atrophie blanche). A lábszár alsó harmadában jelenik meg a lipodermatoszklerózis, amelynek nem is túl ritka formája az, amikor egy proximalis és egy distalis ödémás, gyulladt, indurált és pigmentált szegmens között, vékonyabb körfogatú szklerotikus régió zongoralábra vagy pezsgősüvegre emlékeztető alakot kölcsönöz a beteg végtagnak. A betegség végállapotaként, rendszerint banális sérülés hatására az atrophie blanche vagy a lipodermatoszklerózis területén nem gyógyuló superficialis, esetenként mélyre terjedő fekély, az ulcus cruris alakul ki (7. ábra).
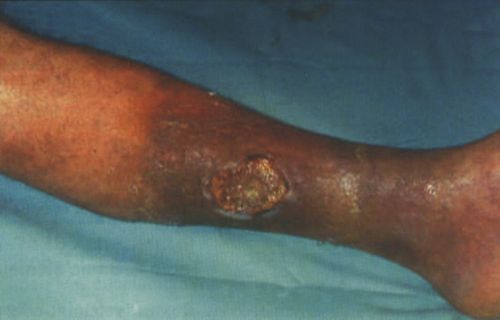
7. ábra.
Lipodermatoszklerózis talaján kialakult ulcus cruris venosum.
Az ulcus cruris következményei
Életminőségi vizsgálatok szerint a CVI-ben, de különösen az ulcus crurisban szenvedő betegek közel 80%-a csökkent mobilitásról panaszkodik, és ezen csoport majd 60%-a félelemről, haragról, depresszióról és szociális izolációról számol be. A mobilitás csökkenésének oka részben a fájdalom, részben az alsó végtag ledált keringésének következtében károsodott funkció. Cellulitis, nedvedzés és nagyfokú érzékenység fertőzést jelez. Általában Gram pozitív (Staphylococcus és Streptococcus), időnként Gram negatív baktériumok (Pseudomonas), gyakran gombák (dermatophyton) szerepelnek fertőző ágensként. A fekély szinte mindig kolonizált, ez is oka a nehéz és lassú gyógyulásnak. Amennyiben a fekély három hónap múltán is terápiarezisztens, malignus folyamat vizsgálatára szövettani mintavétel megfontolandó. Az ulcerált szövet ugyan ritkán megy át malignus transzformáción - ilyenkor exofitikus burjánzás hívja fel a figyelmet erre az átalakulásra. Az ulcus crurisnak gyakori kísérőjelensége a sebszélt körbevevő dermatitis, ez eritémás, hámló, pörkösödő és erősen viszkető régiót jelent, amely a fekély területének további növekedését segíti elő.
Diagnosztika
A kivizsgálás menete
Csoportba sorolt diagnosztikus eljárások az egyes CEAP "C" stádiumokhoz (ld. alább) rendelhetőek, logikus és követhető kivizsgálási algoritmust alakítva ki (2):
- szint: anamnézis, fizikális vizsgálat, artériás keringés vizsgálata és kézi Doppler vizsgálat.
- szint: noninvazív kivizsgálás: duplex scan, pletizmográfia.
- szint: invazív kivizsgálás: felszálló, leszálló flebográfia, varikográfia, nyomásmérések.
Általános laboratóriumi kivizsgálás
Rutinszerűen javasolt (31) az első vizsgálat során teljes és mikroszkópos kvalitcitív vérkép. Meglepő módon gyakran a felülfertőződött fekélyek ellenére sem látható leukocytózis vagy balra tolt vérkép, így ez irányban is inkább a klinikum a döntő. Vérzékenység szűrésére INR és aktivált parciális tromboplasztin idő (aPTI) mérése, valamint a thrombocytaszám meghatározása elégséges első körben. Ezeket a vizsgálatokat fiatal - 50 év alatti - páciens esetén szükséges lehet kiegészíteni hiperkoagulabilitás (Protein C és S, antitrombin III., V. faktor-Leiden) tesztekkel is. Javasolt rutin kémiai vizsgálatok (Na, K, Cl, C02, karbamid nitrogén, kreatinin, glukóz), glikolizált hemoglobin (HbAlc), nutritív markerek (prealbumin, albumin) és májfunkciós enzimek (GOT, GPT, gainina-GT, alkalikus fosztafáz) elvégzése. A differenciáldiagnosztikai részben (ld. alább) ismertetett betegségek identifikálására további speciális vizsgálatokra lehet szükség.
Makrocirkuláció vizsgálata
A fizikális vizsgálatok fontosak, de műszeres kiegészítésre szorulnak (3). Sokat segít a félrediagnosztizálás elkerülésében a vénás reflux folyamatos hullámú ultrahang vizsgálata a sapheuuo femoralis, sapheno-poplitealis reflux, illetve a perforans helyek lokalizációjának kimutatása. Ennél pontosabb, gazdagabb információtartalmú és reprodukálhatóbb eljárás a vénás duplex scan, amely egyúttal a mélyvénás rendszer állapotáról is tudósít. Első vizitkor feltétlenül fontos kizárni az artériás érbetegség fennállását. Szintén Doppler ultraszonográfiával határozható meg a boka-kar index (ankle-brachial index = ABI), amely 0,9 alatti hányados esetén szignifikáns verőér obstrukciót jelez. A felszálló flebográfica korábban a szakterület gold standardjának számított az ér átjárhatóságának kimutatására, az anatómiai viszonyok tisztázására, illetve a primer és a szekunder visszérbetegség elkülönítésére. Mivel nem ad kvantitatív funkcionális leírást a betegség súlyosságáról vagy a kollaterális hálózat állapotáról, ezért csak azon ritka esetekben indikált, ha a duplex scan nem elérhető vagy a lelet nem egyértelmű. A leszálló flebográfiát reflux lokalizációjára, mértékének megítélésére fejlesztették ki, mélyvénás rekonstrukció, illetve varikozitás reoperációja esetén ma is használatos, alkalmazása szintén csak elvétve indokolt. Varikográfia recidív varikozitások anatómiai kapcsolatainak, illetve vénás malformációk ábrázolására szolgál, akár intraoperatív diagnosztikus eljárásként. A perifériás vénás nyomás, pontosabban a mozgáskor létrejövő nyomásváltozás mérése, a mélyvénák átjárhatóságának és a mély, valamint felületes reflux mértékének kvantitatív megítélését, a felületes reflux helyek bemérését szolgálja. A vena femoralis nyomásmérés az iliocavalis obstrukció súlyosságának mérésére szolgál. A femorális és a centrális nyomás közötti >5 Hgmm-es nyomáskülönbség szignifikáns elzáródásra és a spontán kollaterizáció hiányára utal, ezért sebészi rekonstrukcióra érdemes.
Mikrocirkuláció vizsgálata
A következőkben csak az ajánlásokban megfogalmazott és a klinikai gyakorlatban hasznosnak ítélt eljárásokról esik szó (2, 3), a betegség patomechanizmusának lényegét célzó, jelenleg a kutatás oldalán maradó, kifinomultabb vagy éppen túlhaladottnak ítélt vizsgálatokra nem térünk ki.
A perfúzió, az áramló vér sebességének és az átáramlott vér térfogatának mérése lézer Doppler fluxometriával lehetséges, amely a '90-es évek óta a CVI egyik legáltalánosabban használt noninvazív vizsgáló eljárásává vált. Az elmozduló vörösvérsejtek által generált frekvencia Doppler eltolódásából számolt, egységnyi területen átmenő áramlás (fluxus) jól korrelál más vizsgáló eljárások eredményeivel, annak ellenére, hogy a bőr perfúziója sok tényező függvénye. Fizikai adottságai miatt a szubpapilláris (non-nutritív) régióról ad információt, és jellemző elváltozásként a szklerotikus bőrterületen erőteljesen emelkedett fluxust, valamint a fiziológiás poszturális vazokonstrikciós reflex (normál mikrocirkuláció esetén a bőr keringésének csökkenése következik be a láb függőleges helyzetében) eltűnését tanúsítja. A végtag térfogatváltozása a vénás reflux, a vénás obstrukció, illetve a gyér izompumpa funkció következménye, amelyek pletizmográfiáíval mennyiségileg is értékelhetők (legelfogadottabb a levegő-pletizmográfia).
Transzdermális 02 és C02 koncentráció direkt mérésével (szilárd fázisú elektród) a szöveti oxigénellátottság és metabolikus státusz ítélhető mneg. A kapillárisok számának redukciója előtt bekövetkező morfológiai elváltozások szignifikáns 02 tenzió csökkenéssel járnak, a későbbiekben a kapillárisok számának csökkenése egyenesen arányos az oxigéntenzió változással. Lehetőség van a lokális plazma szabadgyyök szint mérésére is az oxidatív környezet becslése céljából.
A seb vizsgálata
Vénás fekély térd alatt - a talpat kivéve - bárhol előfordulhat, pontosabban a boka tájon a leggyakoribb, a lábszáron distalisan szokott megjelenni, továbbá a lábháton találkozhatunk vele, proximalisan csak a nagyobb fekélyek nyúlványai jelentkeznek. Szükséges a sebek minden objektív tulajdonságának rögzítése (31), tehát a kiterjedés mértékének, illetve a cellulitis vagy váladékozás meglétének megállapítása. A terápia hatásosságának követése céljából hasznos betegvizitenként a seb átlátszó fóliás körülrajzolása vagy újabban (digitális) fényképezése és a képek morfometrikus objektivizálása.
Terápiarezisztens vagy tumor gyanús sebek esetén szükségessé válik a szövettani feldolgozás. Az érintett bőrterület vastagságának mérése (a betegség progrediálásával a szklerózis miatt fokozatosan csökken) és echogenitásának meghatározása 2D-ultrahang segítségével történhet. Fontos és a leggyakrabban alulértékelt probléma a fekély okozta fájdalom, amelynek kezelését haladéktalanul meg kell kezdeni. Mai tudásunk szerint megfelelő analgetikum választásával a krónikus gyulladást fenntartó folyamat is befolyásolható (ld. a gyulladásgátlás című részt).
Stádiumbeosztás - CEAP
Annak ellenére, hogy sokak számára idegen, vagy éppen túlzottan aprólékosnak tűnik, gondos átolvasás után észrevehető, hogy gyakorlatilag a szokásos korrekt állapotfelmérés során amúgy is észlelteket foglalja egységes formába. Segítségével közös nyelvezet alakítható ki, meghatározhatók az indikációk, valamint megkönnyíti a beavatkozások összehasonlítását és az egyes betegre vonatkozó hatásosság kimutatását, akár praxison belül is (32). A II. táblázatban felvázoltakon kívül klinikai és rokkantsági pontszám egészíti ki és teszi teljessé a stádiumbesorolást.

II. táblázat.
A CEAP-klasszifikáció alapelemei.
Differenciáldiagnózis
Ödéma: jobb kamra elégtelenség, hipoprotcinémia, vesebetegség, lymphoedema, pretibialis mixoedema, mélyvéna trombózis, vena iliaca kompresszió (29).
Pigmentáció: egyéb purpura, minociklin pigmentáció.
Varikózus vénák: Parkes-Weber szindróma (kongenitális arteriovenózus fisztulák), Klippel-Trenaunay-Weber szindróma (30).
Stasis dermatitis: numuláris ekcéma, atópiás dermatitis, allergiás kontakt dermatitis.
Fekély: vaszkulitisz, fertőzés (gomba, vírus vagy baktérium), trauma, pyoderma gangrenosum, fascitis, artériás keringési elégtelenség, hipertónia (Martorell-fekély), neuropátia, diabetes mellitus, haematológiai betegségek, malignus elváltozás (laphám karcinóma, atípusos bazalióma, ritkán malignus fibrózus hisztiocitóma).
Terápia - megelőzés és kezelés
Vaszkuláris rekonstrukció
A CVI hátterében rendszerint anatómiailag jól körülhatárolható visszér-rendszeri eltérés található. Az esetek jelentős részében ez sebészi úton megelőzhető vagy javítható, gyakran egyszerű visszérműtéttel teljesen megoldható. Az ulcustól proximalisan elhelyezkedő, úgynevezett rámutató véna izolált lekötése vagy szklerotizáló kezelése általában csak átmeneti javulást hoz, amely csak a fekély begyógyításában lehet eredményes, a gyógyultan tartásban már sajnos csak ritkán. A jó, hosszabb távú megoldás a kiterjedt, radikális varicectomia, ezért célszerű általában azt az alapelvet követnünk, hogy a fennálló saphena törzs varikozitást megoperáljuk.
Mélyvéna keringési probléma esetén az elváltozás patológiájától, az anatómiai helyzettől és a klinikai stádiumtól függően belgyógyászati kezelés vagy műtét, illetve ezek kombinációi jönnek szóba. A megfelelő indikációk alkalmazásával törekedni kell a végtag vénás drenázsának fenntartására, a mélyvéna okklúzió, illetve a billentyűk kiesése által okozott retlux lehetséges megoldására. Jóllehet tudjuk, a véna billentyűk pótlására vonatkozó több évtizedes kísérletek még mindig kezdeti stádiumban vannak (3, 43).
Fizioterápia, életmód
Elsősorban az izompumpa fokozott használata javasolt, mert rendszeres fizikai aktivitással, napi többszöri 15-30 perces lábemeléssel és lábfej mozgatással csökkenthetők a panaszok és az ödéma mennyisége. Álló munka esetén a láb izomzatának rendszeres tornáztatása (boka flexióval végzett torna), erre a célra kifejlesztett értornák gyakorlása szükséges, segédeszközzel vagy anélkül. Ajánlható még pihenéskor az alsó végtagok felemelése legalább a szív szintjére, és az ebben a helyzetben történő alvás is. Ezen kívül a rendszeresen végzett hideg vizes lábzuhany, rugalmas harisnya viselése, a túlzott terhelés és hőhatás kerülése jótékony hatásúak. A lábikra mozdulatlansága miatt magas sarkú cipő használata CVI-ben ellenjavallt. A CVI szempontjából legkedvezőbbek lennének a vízben végzett sportok, de a betegek erre vagy alkalmatlanok, vagy nem végzik. Mivel az oxidatív környezet jelentős patogenetikai faktor, a dohányzás mielőbbi elhagyása, a diabetes és a lipid anyagcsere rendezése, valamint a többi társbetegség adekvát kezelése is fontos feladat.
Társbetegségek kezelése
Ulcus cruris kialakulására hajlamosító társbetegségek közül a legfontosabbak: cukorbetegség, szívelégtelenség, magas vérnyomás, anyagcserezavarok, agyvérzés, bénulásos, hosszú lábadozással járó baleset, haematológiai kórképek, daganatos és immunbetegségek. Ezek kezelése feltétlenül szükséges. A CVI családi halmozódása is gyakran fordul elő. Ilyenkor különösen fontos az egészséges életmód és a prevenció betartása.
Kompressziós kezelés
Az alkalmazott kompresszió elengedhetetlenül fontos része a megelőzésnek és a kezelésnek is, hiszen a krónikus vénás elégtelenség kiindulási okát, a megemelkedett vénás nyomást hatékonyan csökkenti. A tágult, felszínes visszereket összenyomva, az izompumpa működését elősegítve csökkenti a pangást, a vért a mélyvénák felé irányítja. Ezen kívül javítja a véna billentyűk záróképességét, vagyis mérséklődik a reflux, és ezért is csökken a vénás nyomás úgy nyugalomban, mint járás alatt. A vénák átmérőjének csökkentésével növekszik az áramlási sebesség, ezért csökken a trombózis kialakulásának valószínűsége. A hidrosztatikai nyomás csökkenése miatt a filtrálódó ödéma is kevesebb és a limfatikus drenázs javul. A patogenezisben részletezettek értelmében a gyulladás csökkenését, és így a fájdalom mérséklődését is eredményezi a rugalmas kompresszió. Ezen túlmenően, mechanikailag is védi az érzékeny, gyulladt bőrt. A kevert etiológiájú ulcusos betegek kompressziós terápiája előtt fontos felmérni az artériás keringési zavar szerepét és mértékét. Diabetes esetén az artériás inszufficienciához neuropátia is társul, ilyenkor is óvatosnak kell lennünk a kompressziós kezelés alkalmazásával (3).
Endothel funkció javítása
A patogenezisben részletezett folyamatok eredői mind az endothel "szerv" abnormális működését (diszfunkcióját) eredményezik, ezért még az idevezető okok megszüntetése előtt el kell kezdeni az endothel-szupportív terápiát. Széles körben, de a benne rejlő lehetőségeket teljesen ki nem aknázva használjuk a flavonoid csoportba tartozó szereket. Kísérletes és klinikai adatok bizonyítják a transzkapilláris folyadékkiáramlás csökkentő (ödéma csökkentő), leukocyta adhézió gátló (a folyamatot agraváló gyulladást mérséklő), a fibrinolitikus aktivitás fokozó (fibrin-hüvely kialakulást lassító) és szabadgyök fogó hatást (33). Kiterjedt irodalom és milliárdokat felemésztő klinikai vizsgálatok tárgyai a statinoknak a magasnyomású (artériás) rendszerben endothel diszfunkciót okozó elváltozásokra gyakorolt jótékony hatása, amely messze több, mint az eredetileg felismert koleszterinszint-csökkentés. Annak ellenére, hogy az endothelium valóban funkcionálisan és morfológiailag is diverz, az érrendszer szabályozásában betöltött szerepe és alapvető reakciói többnyire azonosak. Ennek okán megfontolandónak tartjuk a cserét, vagyis statin kezelés indítását a vénás rendszer betegségeiben, mint ahogy flavonoid terápia alkalmazását is az artériás oldalon. Reméljük, hogy kielégítve jelen korunk követelményeit, megfelelő evidenciával záruló klinikai vizsgálatok is legitimizálják ezt a sejtélettani alapokon nyugvó hipotézist.
Gyulladásgátlás - szabadgyök elimináció - oxidatív stressz csökkentése
Szabadgyök fogók használatával (például C-vitamin) és az oxidáló környezet kialakulását facilitáló tényezők (például dohányzás, hiperlipidémiák, hipertonia) csökkentésével redukálni lehet a szabadgyökök káros hatásait. A Pentoxyfilline gyulladáscsökkentő és szabadgyök fogó tulajdonságai miatt klinikai vizsgálatban is csökkentette a betegségláncolat progresszióját (26). Stasis dermatitis esetén a granulocita és hízósejt által mediált kínzó viszketés sikerrel kezelhető, hosszú hatású, a szövetbe jól penetráló antihisztamin alkalmazásával. CVI esetén többek között a lokálisan többszörösre emelkedő ciklooxigenáz-2 (COX-2) felelős a krónikus gyulladás fenntartásáért prosztanoid mediálta szövetsérülés, apoptózis indukció és szabadgyök termelése által. A makrofágokon kívül az endothel sejtekben, a fibroblasztokban és a keratinocitákban is jelentősen indukálódik a COX-2. Ezzel ellentétben, a COX-1 protektív hatásúnak tűnik, mivel hatására prosztaciklin (PGI2) termelődik, amely induktora a neovaszkularizációnak és antitrombotikus hatású (32). Ennek ismeretében regfontolandó olyan fájdalomcsillapító használata, amelynek szelektív COX-2 gátló hatása van (35).
Fekélykezelés
A fekély és környékének lokális kezelése nemcsak az adekvát sebellátás miatt fontos, hanem ez teszi lehetővé a beteg időnkénti kontrollját és a beteg számára ide nem tartozónak tűnő alapbetegség megfelelő kézben tartását is.
Élettelen szövet eltávolításával elimináljuk a táptalaj egy részét, így csökkenthető a fertőzés és a fehérje anyagok eltávolítására irányuló biológiai terhelés, ezáltal mérsékelhető a gyulladás és a fájdalom. Így megindulhatnak azok a folyamatok, amelyek eredményeként stimulálódik a seb epitelizációja és kontrakciója. Tehát élettelen szövetjelenléte esetén indikált a debridement elvégzése.
A sebkezelő eljárások közül előnyben részesítjük a nedves környezetet adó kötszereket, ezek elősegítik az autolitikus folyamatokat, a granulációs szövet növekedését. Hámosítást elősegítő fedőkötések használatára jelenleg is vizsgálatok folynak.
Általában a sebfelület dezinfekcióját végezzük, de kivételesen, súlyos fertőzés esetén mély szöveti leoltás után megkezdhető az antibiotikus kezelés a talált organizmusoknak megfelelően. Amennyiben cukorbetegség szerepel kísérőbetegségként, dermatophyton infekció valószínű, ezért megfontolandó az antimikotikus terápia is.
Hosszú ideje fennálló, kiterjedt fekély sebészeti gyógyítása autológ, teljes vastagságú bőrgraft felhasználásával gyorsan, jó sebgyógyulást eredményezhet (65% egy év alatt), bár hátránya, hogy a donor terület fájdalmas, sokszor rossz gyógyhajlamú, helyén maradandó heg alakulhat ki. Esetenként félvastagságú graft használata is lehetséges.
Erős elméleti alapokról indulva jelenleg is több növekedési faktorral (például trombocyta eredetű növekedési faktor, granulocyta/makrofág stimuláló faktor) folyik vizsgálat. A másik ígéretes irány hámsejt transzplantációval pótolja a fekélyes területet. A hámsejt szuszpenzióval (34) és a tenyésztett saját hámsejtekkel végzett auto-transzplantációval (37), valamint gyárilag előállított allogén bőr transzplantációval elért jó terápiás eredmények (38, 39, 40) ellenére további adatokra van szükség ezen eljárások gazdaságosságának igazolására (41, 42). Feltételezhető, hogy a közeljövőben az ulcusos betegeknél a sebgyógyulást saját tenyésztett sejtekkel végzett auto-transzplantációval fogják elősegíteni. Erre az ad lehetőséget, hogy technikailag megoldott a hámsejtek tenyésztése és szállítása. A fagyasztva tárolás lehetővé teszi a beavatkozás számtalan megismétlését is (43).
Zárszó
A fekély megjelenése a CVI ellátás kudarca, mind népegészségügyi szemlélet szerint, mind az egyén egészsége és életminősége szempontjából. Amennyiben elérjük, hogy a krónikus vénás betegségláncolat kialakulását megelőzzük, vagy ha már elkezdődött, mihamarabb adekvát, erőteljes kezelésnek vessük alá, akkor kevesebb beteg jut el a végállapotig, egyre kevesebb ulcus crurisos esettel találkozunk praxisunkban. Ennek érdekében szükségesnek látjuk az ismert patogenetikai alapokat szem előtt tartó, egyszerű, követhető diagnosztikus és terápiás protokoll mielőbbi összeállítását.
Irodalom
- Hetényi A.: Az alsó végtag krónikus vénás elégtelenségének klasszifikációja és a súlyosság mértékének megállapítása. Érbetegségek, 1996., 3(1): 21-24.
- Nicolaides, A. N.: Investigation of chronic venous insufficiency: A consensus statement (France, March 5-9., 1997). Circulation, 2000. nov. 14., 102(20): E126-163. rewiev.
- Bihari l.: Visszérbetegség és kezelése. Á + B Kiadó, Budapest, 2004.
- Monos E.: A vénás rendszer élettana. 3. kiadás. Semmelweis Egyetem, Képzéskutató, Oktatástechnológiai és Dokumentációs Központ, Budapest, 2004.
- Kachlik, D., Lametschwandtner, A., Rejmontova, J., Stingl, J., Vanek, /.: Vasa vasorum of the human great saphenous vein. Surg. Radiol. Anat., 2003. febr. 24(6): 377-381.
- Dashwood, M. R., Anand, R., Loesch, A., Souza, D. S.: Hypothesis: a potential role tor the vasa vasorum in the maintenance of vein graft patency. Angiology, 2004. júl.-aug., 55(4): 385395.
- Bihari L, Nagy Z., Szilvási l.: Arteriovenosus shuntök ulcus crurisban. Érbetegségek, 2000., 7: 15-19.
- Shami, S. K., Chittenden, S. J., Scurr, J. H., Smith, P. D. C.: Skin blood-flow in chronic venous insulTiciency. Phlebology, 1993., 8: 72-76.
- Junger, M., Steins, A., Hahn, M., Hafner, H. M.: Microcirculatory dysfunction in chronic venous insufficiency (CVI). Microcirculation, 2000., 7(6 Pt 2): S3-12. Review.
- DeMaio, L., Tarbell, J. M., Scaduto, R. C. Jr., Gardner, T. W., Antonetti, D. A.: A transmural pressure gradient induces mechanical and biological adaptive responses in endothelial cells. Am. J. Physiol. Heart Circ. Physiol. 2004., 286(2): H731-741.
- Browse, N. L., Burnand, K. G.: The cause of venous ulceration. Lancet, 1982., 2: 243-245.
- Ibbotson, S. H., Layton, A. M., Davies, J. A., Goodfield, M. J.: The effect of aspirin on haemostatic activity in the treatment of chronic venous leg ulceration. Br. J. Dermatol., 1995. március, 132(3): 422-426.
- Coleridge-Smidth, P. D., Thomas, P., Scurr, J. H., Dormandy, J. A.: Causes of venous ulceration: a new hypothesis. Br. Med. J., 1988., 29G: 1726-27.
- Esmon, C. T.: Crosstalk between intlammation and thrombosis. Maturitas., 2004. április 15., 47(4): 305-3 14. Review.
- Hort, W.: Inner layer infarction of the coronary artery wall due to coronary thrombosis. Virchows. Arch., 2002. nov., 441(5): 490-493.
- Thomas, P. R. S., Nash, G. B., Dormandy, J. A.: White cell accumulation in the dependent legs of patients with venous hypertension: a possible mechanism for trophic changes in the skin. BMJ, 1988, 29G: 1693-1695.
- Maytin, M., Leopold, J., Loscalzo, J.: Oxidant stress in the vasculature. Curr. Atheroscer. Rep., 1999. szept. 1(2): 156-164. Review.
- Saharay, M., Shields, D. A., Georgiannos, S. N., Porser, J. B., Scurr, J. H., Colericlge-Smith, P. D.: Endothelial activation in patients with chronic venous disease. Eur. J. Vasc. Endovasc. Surg., 1998. ápr., 15(4): 342-349.
- Esmon, C. T.: Coagulation and inflammation. J. Endotoxin. Res., 2003., 9(3): 192-198.
- Anderson, T. J.: Nitric oxide, atherosclerosis and the clinical relevance of endothelial dysfunction. Heart Fail Rev., 2003. jan., 8(1): 71-86.
- Waltenberger, J.: Modulation of growth factor action: implications tor the treatment of cardiovascular diseases. Circulation, 1997. dec., 96(11): 4083-4094.
- Leu, A. J., Leu, H. J., Franzeck, U. K., Bollinger, A.: Microvascular changes in chronic venous insufficiency - a review. Cardiovasc. Surg., 1995. jún., 3(3): 237-245.
- Wilkinson, R. S., Bunker, C., Edwards, J. C., Scurr, J. H., Smith, P. D.: Leukocytes: their role in the etiopathogenesis of skin damage in venous disease. J. Vasc. Surg., 1993. ápr., 17(4): GG9-675.
- Tandara, A. A., Mustoe, T. A.: Oxygen in wound healing - more than a nutrient. World J. Surg., 2004. márc., 28(3): 294-300.
- Layton, A. M., Ibbotson, S. H., Davies, J. A., Goodfield, M. J.: Randomised trial of oral aspirin for chronic venous leg ulcers. Lancet, 1994. júl., 344(8916): 164-165.
- De Sanctis, M. T., Belcaro, G., Cesarone, M. R., Ippolito, E., Nicolaides, A. N., Incandela, L., Geroulakos, G.: Treatment of venous ulcers with pentoxifylline: a 12-month, double-blind, placebo controlled trial. Microcirculation and healing. Angiology, 2002. jan-febr., 53. Suppl. 1: S49-51.
- Petruzzellis, V., Troccili, T., Candiani, C., Guarisco, A., Lospalutti, M., Belcaro, G., Dugall, M.: Oxerutins (Venoruton): efficacy in chronic venous insufficiency - a double-blind, randomized, controlled study. Angiology, 2002. máj.-jún., 53(3): 257-263.
- Jantet, G.: Chronic venous insufficiency: worldwide results of the RELIEF study. Reflux assEssment and quaLity of llfe improvEment with micronized Flavonoids. Angiology, 2002. máj-jún., 53(3): 245-256.
- Fitzpatric, T. B., Johnson, R. A., Wolf K., Polano, M. K., Suurrnond, D.: Color Atlas Synopsis of clinical dermatology. McGraw-Hill, 1997.
- Tasnádi G.: Érfejlődési rendellenességek, érbetegségek gyermekkorban. In: Vascularis medicina, szerk. Meskó Éva, Therapia Kiadó, Budapest, 2004., 228-235.
- Brem, H., Kirsner, R. S., Falanga, V.: Protocoll for the succesfull treatment of venous ulcers. Am. J. Surg., 2004., 188 Suppl. 1., 1-8.
- Porter, J. M., Moneta, G. L.: Reporting standards in venous disease: an update. International Consensus Committee on Chronic Venous Disease. J. Vasc. Surg., 1995. ápr., 21(4): 635-645.
- Roland, I. H., Bougelet, C., Ninane, N., Arnould, T., Michiels, C., Remacle, J.: Effect of hydroxyethylrutisodes on hypoxialinduced neurophil adherence to umbilical vein endothelium. Cardiovasc. Drugs Ther., 1998. szept., 12(4): 375-38 1.
- Abd-El-Aleem, S. A., Ferguson, M. W., Appleton, l., Bhowmick, A., McCollum, C. N., Ireland, G. W.: Expression of cyclooxygenase isoforms in normal human skin and chronic venous ulcers. J. Pathol., 2001. dec., 195(5): 616-623.
- Willoughby, D. A., Tomlinson, A.: Inducible enzymes in inflammatory responses. Intlammation Research, Willoughby, D. A., Tomlinson, A. (eds.). Birkhauser, Basel, 1999., 1-30.
- Bergquist, S., Frantz, R.: Pressure ulcers in community-based older adults receiving home heath care. Prevalence, incidence and associated risk factors. Adv. Wound Care, 1999., 12: 33951.
- Tennvall, G. R., Apelquist, J., Eneroth, M.: Costs of deep foot infections in patients with diabetes mellitus. Pharmacoeconomics, 2000., 18: 225-38.
- Cough, A., Clapperton M., Rolando, N. et al.: Randomised piacebocontrolled trial of granulocyte-colony stimulating factor in diabetic foot infection. Lancet, 1997., 350: 855-859.
- EPUAP. Guidelines on the Prevention and Treatment of Pressure Ulcers. Oxford: European Pressure Ulcer Advisory Panel, 1998.
- Phillips, T. J.: Chronic cutaneous ulcers: etiology and epidemiology. J. Invest. Dermatol., 1994. 102(suppl.): 38-41.
- II. Szakmai konszenzus konferencia az UPUAP irányelvei alapján. Lillafüred, 2003. április 3-4. Sebkezelés, Sebgyógyulás, 2003., 6: 4-12.
- Acsádv Gy., Nemes A.: Az érsebészet tankönyve. Medicina, Budapest, 2001.
- Hunyadi J., Bihari I., Nagy I., Török Zs., Hamar P.: Krónikus sebek kezelése a gyógyulás különböző fázisaiban. Érbetegségek, 11: 57-65 (2004).
- Nees, S., Weiss, D., Thallmair, M., Lamm, P., Juchem G.: Neue Aspekte zur Pathogenese und Therapie chronischer peripherer Venenleiden. Fortschitt und Fortbildung in der Medizin, Band 24. (2000/2001.)
Dr. Hunyadi János
DEOEC Bőr- és Nemikórtani Klinika
4012 Debrecen, Nagyerdei krt. 98.
Érbetegségek: 2004/4. 123-133. oldal