Az antiszeptikumok választásához rendelkezésre álló magas szintű evidenciák sajnálatos módon rendkívül csekély számban állnak rendelkezésre. Jelenleg leginkább preklinikai és klinikai vizsgálatokra lehet támaszkodni, melyek együttes értelmezése nehézkes, hiszen gyakran számos tekintetben igen heterogén forrásnak bizonyulnak. A rendelkezésre álló szakirodalmi adatok áttekintése után elmondható, hogy a kritikusan kolonizált és fertőzött krónikus sebek, valamint égések esetén a PHMB a választandó antiszeptikum. A harapott, lőtt, vagy szúrt sebek esetén a PVP-I az arany standard, míg a PHMB és a hipoklorit is superior a PVP-I-vel szemben a szennyezett akut és krónikus sebek fertőtlenítésekkor. Az MDRO-kolonizált vagy fertőzött sebek dekolonizálásához előnyös az OCT/PE kombinációja és a PHMB. A peritoneális öblítéshez, valamint a központi idegrendszeri expozíció kockázata esetén a hipoklorit a megfelelő antiszeptikum. Terápiás princípium, hogy az alkalmazástól számított 2 hét utáni minden sikertelen antiszeptikus kezelést felül kell vizsgálni és további diagnosztikus lépéseket kell tenni, mint például a helyi véráramlás elemzése, így elkerülhetővé tehető a felesleges expozíció.
Érbetegségek: 2019/1. - 11-19. oldal
Bevezetés
A tudomány jelenlegi álláspontja szerint az antiszeptikumok a helyi sebkezelés alternatívái, a modern sebgyógyításnak elengedhetetlen részét képezik. Ez az állítás abszolút megkérdőjelezhető volt, csupán csak az 1980-as években indult el az az ipari kutatás és fejlesztés, amely felismerte, hogy az antiszeptikumok egyszerre több támadásponton fejtik ki hatásukat, így a rezisztencia kialakulásának esélye alacsonyabb. Ennek okán a sebek lokális kezelésére számos új, antiszeptikus terméket fejlesztettek ki (6). Sürgető és kényszerítő nyomás nehezedett a fejlesztőkre, hiszen a helytelen, valamint a túlzott antibiotikum alkalmazás következményeként a multirezisztens kórokozók pandémiás elterjedése mellett megjelent a Clostridium difficile is.
Az antiszeptikumok szerepe számos változáson ment keresztül a krónikus, illetve a nehezen gyógyuló sebek kezelésében. Ezek olyan szerek, amelyek az élő szövetekben vagy azok felületén pusztítják el ill. gátolják a mikroorganizmusok növekedését (1). A definíció John Pringle katonaorvos nevéhez fűződik, aki az 1750-es években, a húsromlását ásványi anyagokkal próbálta megállítani (2). A 19. század elejétől a sebfertőtlenítés a sebkezelés részét képezte, viszont a penicillin felfedezését követően a klinikusok a sebfertőzések megelőzésére és kezelésére az antiszeptikumok helyett az antibiotikumokra támaszkodtak. Továbbá a sebgyógyulást késleltető hatásról (3) és a citotoxicitásukról megjelent publikációk (4) használatukat korlátozta.
Az antibiotikumok túlzott használatával, az antiszeptikumok mellőzése egyenes arányban volt. A nem megfelelő antibiotikum használat következményeként megjelentek a multirezisztens törzsek. Alexander Fleming 1945-ös interjújában az orvosok figyelmét felhívta, a penicillint indokolatlan esetben ne alkalmazzák: "A penicillinnel játszó, meggondolatlan kolléga erkölcsileg felelős annak az embernek a haláláért, aki végül belehal a penicillin-rezisztens baktérium törzs által okozott fertőzésbe" (5).
1. Táblázat.
A sebek batkérium tartalmának négy kategóriája
Sebfertőtlenítésre használt szerek
A jelenleg forgalomban lévő fertőtlenítőszerek többsége nem gyógyszernek, hanem orvostechnikai eszköznek minősül, ezért a megfelelő antiszeptikum kiválasztásakor nehéz dolguk van a klinikusoknak, hiszen magas evidenciaszintet minősítő randomizált klinikai vizsgálatok nem állnak rendelkezésükre. E vegyületeknek a helyes alkalmazása függ a kémiai és fizikai tulajdonságaiktól, valamint a gyártó által meghatározott klinikai indikációtól. Fontos az antiszeptikum megfelelő koncentrációban történő használata, figyelembe kell venni a vér vagy exsudátum jelenlétét ill. azt is, hogy mikor kell a kezelést elkezdeni és mikor kell abbahagyni.
Az antiszeptikumok alkalmazásának indikációi (7)
- Akut sebek fertőzésének megelőzése, pl. trauma, harapás vagy lőtt sebek esetén
- Sebészeti sebfertőzések megelőzése (műtéti beavatkozások utáni sebinfekció megelőzése, SSI)
- Multirezisztens kórokozókkal kolonizált sebek dekolonizációja
- A klinikailag manifesztált sebfertőzések kezelése, beleértve az úgynevezett kritikus kolonizációt (9)
- Krónikus sebek kezelése, a debridement előkészítése vagy sebtisztítás a járóbeteg ellátásban
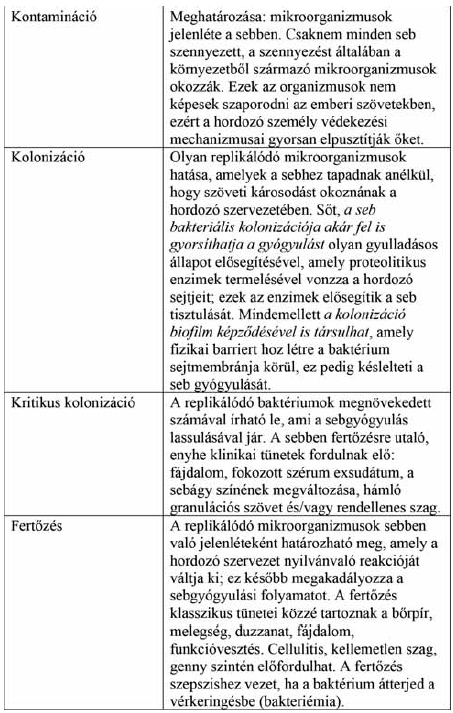
A bakteriumok jelenlete a sebekben negy kategoriaba sorolhata: kontaminacio, kolonizacio, kritikus kolonizacio es a fert.zes (1. Táblázat, 1. ábra). A mikroorganizmusok viszonylagos szamatol es patogenitasatol fu.gg (a hordozo valaszaval es olyan tenyez.kkel kombinalva, mint peldaul a beteg gyenge egeszsegi allapota), hogy a seb lassu gyogyulasa varhato, vagy fert.zesre utalo jelek fordulnak elő.(10).
1. ábra.
Nehéz a pontos diagnózis felállítása pusztán a mikroorganizmusok jelenlétének meghatározása által. Különösen igaz ez a kolonizáció esetében, ahol a baktériumok jelenléte akár fel is gyorsíthatja a sebgyógyulást (ld. fent). Ennek elősegítésére vezették be a WAR-Score-t, hogy segítségével könnyebben azonosítható legyen a fertőzés kockázata (11).
A sebfertőzések kialakulásában szerepet játszó tényezők:
- endogén tényezők (a páciens immunképessége)
- exogén tényezők (a mikroorganizmusok mennyisége és patogenitása)
- antimikróbás szerek érzékenysége
A WAR-Score, mint egy klinikai útmutató ezeket a tényezőket veszi figyelembe három rizikó csoport meghatározásával (12):
- osztály (egy pont/rizikó): anyagcsere-betegségek (pl. diabetes), immunszuprimált állapot, immunszupresszív szerek alkalmazása (glükokortikoidok, ciklosporin, met - hotrexát, stb.), személyes higiénia hiánya, hosszú kórházi tartózkodás, életkor, a seb mérete és a kialakulástól eltelt idő
- osztály (két pont/rizikó): súlyos immun-rendellenességek (AIDS), fertőzött traumás sebek
- osztály (három pont/rizikó): nagy kiterjedésű égési sérülések, idegen anyag jelenléte vagy erősen szennyezett sebek.
Abban az esetben, ha a WAR-Score > 3, akkor helyileg alkalmazott antiszeptikumok használata javasolt.
Az ideális sebfertőtlenítő
Az ideális antiszeptikumok kritériumai hatásosság szempontjából: széles spektrumú aktivitás, biofilmbe, nekrotikus szövetbe, varba megfelelően penetráljon. Mikrobicid hatás jellemezze, ne rendelkezzen rezisztencia-képző potenciállal, főként antibiotikumokkal szembeni keresztrezisztenciával. A gyulladásgátláson kívül, gyógyulást elősegítő hatással bírjon. Tolerálhatósága a sebben, ideális esetben megegyezik a Ringer-oldat vagy a fiziológiás sóoldat tolerálhatóságával. Alacsony szenzibilizációs potenciál jellemezze, és ne okozzon anafilaxiás reakciót. Nem rendelkezhet hosszú távú káros hatásokkal (pl. mutagenitás, karcinogenitás vagy teratogenitás). Szelektív hatással bírjon a patogénekkel szemben.
A modern sebkezelésben alkalmazandó antiszeptikumok
Az antiszeptikumok alábbi összeállítása a Kramer és mtsai által kiadott 2018-as konszenzust követi, ahol a modern sebfertőtlenítők tulajdonságainak összehasonlítása a PubMeden megtalálható korszerű seb antiszeptikumokkal kapcsolatos klinikai vizsgálatok összegyűjtése és elemzése alapján keletkezett (7, 16).
1. Octenidine (OCT/PE)
Hatásosság
Az oktenidin-dihidroklorid egy kvaterner ammónium vegyület, amely két kationos központjának köszönhetően erős felületaktív tulajdonsággal rendelkezik. Reakcióba lép a mikrobák sejtfalával, illetve a membrán összetevőivel, így sejtfunkció károsodást idéz elő. A 100 g-os oldat 0,1 g oktenidin- dihidrokloridot és 2,0 g fenoxietanolt tartalmaz. A fenoxietanol antimikróbás hatásának mechanizmusa többek között a sejtmembrán nátriummal szembeni fokozott átjárhatóságán alapul. Az antimikróbás hatás a baktérium- és gombaölő hatásra, valamint a lipofil és hepatitis B vírusok elleni hatásra terjed ki. Ebben a vonatkozásban a fenoxietanol és az oktenidin-dihidroklorid hatásspektruma kiegészítik egymást. Az OCT/PE oldat és gél formájában is kapható, jól tolerálható (18). Hatékony enyhe égési sérülés (napégés) esetén is (36). Az OCT/PE felületi feszültsége 30,6 mN /m, amely kevesebb, mint a fele a Ringer oldat felületi feszültségének (71,7 mN /m), ennek köszönhetően könnyen penetrál a kisebb fissurákba is (19).
Az oldat alkalmas a seb tisztítására és támogatja a biofilm megszüntetését, ötperces expozíciós idő elegendő a Staphylococcus aureus biofilmek szinte teljes eltávolítására (19). Harbs és mtsai a hét napon át növesztett Pseudomonas aeruginosa biofilmet, OCT/PE-vel történő 60 perces érintkezési idővel, a kiindulási méret 33,3%-ára csökkentettek (20). A Pseudomonas és annak biofilmjei nagyobb ellenálló képességüek, ezért a Pseudomonas biofilm sikeres kezeléséhez ismételt kezelésekre van szükség (21).
A MDRO-val (Multi-Drug Resistant Organisms) kolonizálódott traumás sérülést követő műtéti amputációs és a szilánkos törések okozta sebek kezelésére OCT/PE sebfertőtlenítést és kombinációban negatív nyomású sebterápiát (NPWT) alkalmaztak ? azt tapasztalták, hogy a gyógyuláshoz nem volt szükség antibiotikum terápiára (22-23). Természetesen csak azután, hogy a szisztémás fertőzést szerológiai és mikrobiológiai vizsgálatokkal kizárták.
Krasowski és Wajda egy lengyel sebészeti járóbeteg klinikán új kezelési algoritmust vezettek be a krónikus lábszár és talpi fekély sebkezelésében - lecserélték az eddigi kezelések során használt szereket: hidrogén-peroxidot, lokális antibiotikumot, klórhexidint, ezüst-szulfadiazint és etakridint. Sebfertőtlenítésre csak OCT/PE hatóanyagú készítményt használtak - egy-egy évet hasonlítottak össze költség szempontjából - az új algoritmus bevezetésével majdnem 2/3-os árcsökkenés tapasztaltak (24). Egy másik vizsgálat során gyulladásos akne kezelésére alkalmazták az OCT/PEt, naponta 2-3-szor, 6 héten keresztül. A konklúzió: az enyhe és középsúlyos akne vulgaris esetében az OCT/PE magas effektivitású és költséghatékony kezelés, használatával csökkenthető a lokális antibiotikum használat, és ezzel a rezisztencia is (25). További előnye, hogy a várandós nőknél végzett, korlátozott számú (legalább 12 hetes terhesség adatai) vizsgálat nem igazolt az OCT/PE alkalmazásával összefüggő malformációkat vagy fötális/neonatális toxicitást. Az állatkísérletek nem igazoltak reproduktív toxicitást, ezért alkalmazása szükség esetén megfontolható terhesség alatt is (17).
Ellenjavallatok
Számos esetben jelentettek a helytelen alkalmazás következményeként nem kívánatos eseményeket. Szúrt-, harapásos seb vagy tályog esetén az oldatot fecskendővel a sebcsatornába és a mély szövetbe juttatták, melynek eredménye későbbi szövetkárosodással járó ödémás duzzanat, amely néhány esetben sebészeti revíziót is igényelt (26). Gyártói ajánlás szerint, a lehetséges szövetsérülés elkerülése érdekében a készítményt nem szabad injektálni vagy a szöveteken nagy nyomással alkalmazni. Biztosítani kell a sebüregben képződő váladék megfelelő elvezetését (pl. rugalmas dréncső segítségével).
Nem alkalmazható a hasüreg (pl. intraoperatív), a húgyhólyag vagy a dobhártya öblítésére (17). Nem használható allergia esetében és hyalin porc vagy központi idegrendszeri beavatkozásoknál is ellenjavallt (27).
Ajánlás szerinti alkalmazás (7)
Az OCT / PE oldat akut, szennyezett és traumatikus sebekhez ajánlott, penetráló tulajdonsága miatt beleértve az MRSA-kolonizált sebeket is. Krónikus sebek esetén a gél készítmény előnyösebb.
Sebfertőtlenítéshez használt, Magyarországon forgalomban lévő termékek
- Octenilin sebmosó oldat
- Octenisan MD nasalis gél
- Octenisept külsőleges oldat
- Octenisept sebgél
2. Polihexanid/ polyhexamethylene biguanide (PHMB)
Hatássoság
A PHMB-t 1979-ben Good kombinálta polietilénglikollal, azért, hogy a nedvesebb környezet miatt, hatékonyabb legyen a sebgyógyításban (28). Willenegger 1994-ben publikálta először meggyőző eredményeit a kombinációval a ?Helyi antiszeptikumok a műtétben - ébredés és előrehaladás? címmel (29). A PHMB gyakorlatilag detoxikált CHD (klórhexidin)-nek tekinthető, mivel a PHMB monomerek molekuláris szerkezete nagyon hasonlít a CHD molekulák szerkezetére, kivéve CHD 4-klór-anilint tartalmazó terminális NH-csoportját, amely potenciális humán karcinogén (30). Ez a hasonlóság magyarázza a hasonló antiszeptikus hatásosságot, valamint a CHD-nek a PHMB-hez képest rosszabb tolerálhatóságát (31). Egy vizsgálat szerint a kontaminált traumás sebek egyszeri 3 percig tartó irrigációja hatásos az SSI (sebészeti fertőzés) kivédésére (32). A polihexanid egyik legfontosabb jellemzője, amely miatt kiemelkedik az összes seb antiszeptikum közül, az az, hogy a Ringer oldathoz képest jelentősen elősegíti a sebgyógyulást, természetesen a gyártó által meghatározott koncentrációban (33-35). Hidrogélként és kombinációban felületaktív undecylenamidopropyl-Betainnal is beszerezhető (10) és nagyon jól tolerálható (37-38). Öblítő oldata hatékony a kritikus kolonizáció és a fertőzött krónikus sebek kezelésében, beleértve az égés sebeket is (39-45). Hatékony antiszeptikum az MRSA és VRE (vankomycin rezisztens Enterococcus) ellen (46-48). Superior a sebgyógyulás tekintetében ezüst és PVP-I-vel történő összehasonlítás során (49). Intracellularis hatékonysága miatt, megfelelő választás lehet az Acanthamoeba keratitis kezelésében (50).
Ellenjavallatok
A jelenlegi ismeretek szerint a PHMB nem használható peritoneális öblítéshez, hyalin porc antiszepszisére és a központi idegrendszer bármely részét magában foglaló alkalmazásokban (51). Nem alkalmazható PHMB és CHD allergia esetén sem, valamint ellenjavallt a terhesség első négy hónapjában, és a várandósság későbbi időszakában, vagyis csak a kockázat-haszon szigorú mérlegelése mellett adható.
Az ajánlás szerinti alkalmazás (7)
"A" szintű evidenciaként értékelhető a PHMB, mint terápiás lehetőség akut traumás sebek, krónikus fekélyek és kifejezetten a fájdalomcsillapító hatása miatt a másodfokú égési sérülések kezelésére. ?B? szintű evidenciaként alkalmazható és költséghatékony megoldás a PHMB a sebfertőzések kezelésére, valamint hatékony, közepesen súlyos, váladékozó sebek gyógyulásának elősegítésére (84). Eredményesen dekolonizálja az MRSA-t és VRE-t a krónikus sebekben (85). Az orrüregben az MRSA dekolonizációjához általában 7 nap szükséges (89). A krónikus sebeket viszont 14 napig mupirocinnel kell kezelni (90-91). A PHMB főként a sebgyógyulásra kifejtett előnyös hatása miatt elsődleges választás a fertőzött krónikus sebek és égési sérülések (gél) esetén.
Sebfertőtlenítéshez használt Magyarországon forgalomban lévő termékek
- Prontosan gél
- Prontosan gél X
- Prontosan seböblítő oldat
- Prontoderm
3. Jodofórok, PVP-I (povidon-jód, polividon-jód), C-I (cadexomer-jód)
Hatásosság
A jodofórok, a jód és a makromolekulák komplexei. A vízben oldódó komplex lehetővé teszi a kis koncentrációjú, szabad jód lassú felszabadulását, amikor a készítmény érintkezik a bőrrel, mucosus membránnal vagy a sebváladékkal. A szabad jód gyors csíraölő hatású, míg a polymerhez kötött jód rezervoárként működik. Az alacsony koncentrációjú jód szabályozott felszabadulása segít minimálisra csökkenteni a szabad elemi jód negatív mellékhatásait.
A PVP-I, a molekuláris jód és a polivinil-pirrolidon felületaktív anyag vízben oldódó kombinációja (52). A hidrogél alapú liposzómás PVP-I készítmények (PVP-I-L) fejlesztése javította a seb tolerálhatóságát (54-55).
A cadexomer-jód (C-I), egy jód és poliszacharid komplex, amelyek antiszeptikus töltőanyagként, különösen üreges sebek kezelésére használhatók (53).
A jód gyorsan hat a respiratórikus lánc enzimszintjén, ahol elektrofilként gátolja az elektrontranszportot így csökkentve az aerob mikroorganizmusok oxigén ellátását. A jód reakcióba lép a mikroorganizmusok enzimjeit, illetve strukturális fehérjéit alkotó aminosavak oxidálható-SH és ?OH csoportjaival, ezáltal inaktiválódnak.
Számtalan klinikai vizsgálat támasztja alá a jodofórok hatékonyságát a sebgyógyulásban (56), mégis, ha a jódkomplexek mindennapi használatáról van szó, a szakirodalom álláspontja nem egységes. Ennek oka a jód toxicitása, szisztémás hatása és az elnyújtott sebgyógyulás. Néhány metaanalízis elemezte az egymásnak ellentmondó bizonyítékokat, és megállapította, hogy az állatmodellekre alapozott vizsgálatok hajlamosak a jód citotoxicitásának alátámasztására, míg a humán vizsgálatok arra utalnak, hogy a PVP-I segítheti a sebgyógyulást azzal, hogy csökkenti a bakteriális terhelést és a fertőzési rátát (57-58). Fumal és mtsai vizsgálata szerint a PVP-1 nemcsak, hogy szignifikánsan javította a krónikus vénás elégtelenség következtében kialakuló fekély gyógyulási arányát, hanem még az in vivo citotoxicitása is elmaradt (59). A C-I esetében a vizsgálatok eredménye szerint a poliszacharid-komplex jelentősen csökkentette a fertőzéshez kapcsolódó tüneteket (exudátum mennyiségét, az erythema nagyságát, az ödémát és fájdalmat) nyomási fekélyek (60) és vénás fekélyek (61) esetében. Egy vizsgálat szerint, amely az antiszeptikumok biokompatibilitását hasonlította össze, a PVP-I csak a 4. helyen végzett, megelőzte az OCT, PHMB és a CHD is (62). Összehasonlító vizsgálat szerint a PVP-I kevésbé komfortos a betegek szerint, mint az orvosi méz, és kevésbé hatékonyan csökkenti a seb méretét, mint az ezüstkötések (63), viszont a PVP-I esetében összehasonlítva az ezüstkötésekkel és a C-I-vel, a betegek a kötéscserék során kevesebb fájdalomra panaszkodtak (64).
Különleges figyelmeztetések az alkalmazással kapcsolatban (65)
Hosszan tartó alkalmazása bőrirritációt, ritkán súlyos bőrreakciókat okozhat. Pajzsmirigybetegségekben szenvedőknél - pl. golyva, pajzsmirigy göbök, vagy más nem akut pajzsmirigybetegségek - a nagymennyiségű jódbevitel hyperthyreosist indukálhat. Ezeknél a betegeknél csak a lehető legrövidebb ideig és a legkisebb kiterjedésben használható. Nagy bőrfelületek hosszútávú kezelése során - mint például nagykiterjedésű égési sérülések vagy sebek esetében - jelentős mennyiségű jód szívódik fel, amely az arra érzékenyeken hyperthyreosist okozhat. Kiterjedt bőrterületnek a testfelszín 10 százalékánál nagyobb, hosszú távú kezelésnek a 14 napot meghaladó időtartam értendő. Nem szabad alkalmazni radiojód szcintigráfia előtt és után vagy a pajzsmirigy carcinoma radiojód kezelésekor. Újszülöttek és kisgyermekek esetében a nagy mennyiségű jód használata kerülendő, mert esetükben a hypothyreosis kialakulásának esélye megnövekszik, mivel ebben a korban a bőr permeabilitása és a jóddal kapcsolatos szenzitivitás is fokozott. Újszülött és kisgyermekkorban a povidon-jód csak a lehető legkisebb adagban alkalmazandó. Rendszeres használata krónikus veseelégtelenségben szenvedőknél óvatosságot igényel. Lítium-terápiában részesülőknek eseti használaton túl, nem ajánlott a PVP-I alkalmazása.
Gyógyszerkölcsönhatások és egyéb interakciók
A PVP-jód komplex pH 2.0 és 7.0 között hatékony. A komplex reakcióba lép fehérjékkel, valamint más telítetlen szerves vegyületekkel, ami hatékonyságának csökkenését eredményezi. A PVP-I és a sebkezelésben használatos enzimatikus szerek együttes alkalmazása mindkét szer hatékonyságának csökkenését eredményezi. Azok a szerek, amelyek higanyt, ezüstöt, hidrogén-peroxidot vagy taurolidint tartalmaznak, interakcióba léphetnek a PVP-jód komplexszel, ezért egyidejű alkalmazásuk kerülendő. A povidon-jód tartalmú termékek az oktenidin tartalmú antiszeptikumokkal együtt vagy közvetlenül egymás után alkalmazva átmeneti sötét elszínezo?dést okozhatnak az érintett területeken.
Ellenjavallatok
A jodofórok alkalmazása ellenjavallt hyperthyreosisban, vagy más acut pajzsmirigybetegségben. Tartós PVP-jódterápiát követo?en, az objektív eredmény érdekében, csak megfelelo? átmeneti ido? után (1-2 hét) ajánlott a pajzsmirigy szcintigráfia. Nem alkalmazható dermatitis herpetiformis, Duhring esetén.
Az ajánlás szerinti alkalmazás (7)
Vermeulen és mtsai szisztémás analízis során a jód készítmények előnyeit és hátrányait vizsgálták, 27 randomizált klinikai vizsgálatot elemeztek és arra a következtetésre jutottak, hogy a PVP-I nem a megfelelő választás a krónikus sebek fertőtlenítésére (86). Ez az állítás azonban nem igaz a liposzómális PVP-I-L készítményekre, melyek az epithelizációt segítik (88). A PVP-I még mindig az elsődleges választás, különösen etanollal kombinálva a harapás okozta sebek, az akut szúrt, vágott és lőtt sebek fertőtlenítésére, mivel kiváló penetráló tulajdonságának köszönhetően képes behatolni a mélyebb rétegek közé (88). Ezt a tulajdonságát kihasználva a hidrofil komplexe megfelelő választás lehet a súlyosan roncsolt, traumás szövetek fertőtlenítésére, mint például a gépkocsi szerencsétlenség vagy robbanás következtében kialakult sérülések.
Sebfertőtlenítéshez használt Magyarországon forgalomban lévő termékek
- Betadine kenőcs
- Braunovidon kenőcs
- Braunol
- Betadine oldat
- Solutio iodi alcoholica Ph.Hg. VII (Alkoholos jód-oldat)
- Iodosorb, Iodoflex (cadexomer-jód)
4. Ezüst ionok
Hatásosság
Az ezüstöt felszabadító vegyületeket az ősi idők óta használják a sebkezeléshez (7). Az ezüstionok a bakteriális dezoxi-ribonukleinsavhoz kötődnek, így anélkül gátolják a baktériumsejtek növekedését és szaporodását, hogy károsítanák a bőr és a bőr alatti szövetek sejtjeit (66). Hatásmechanizmusának köszönhetően az ezüst ionokkal szembeni rezisztencia minimális. Az utóbbi 15 évben végzett, 39 ezüst sebterápiával foglalkozó klinikai vizsgálat, melyből 31 randomizált, kontrollált volt, közelmúltbeli metaanalízise (67) szerint, 28 tanulmány pozitív eredményeket közölt az ezüst alkalmazásáról. Ezen eredmények között a szerzők kiemelik a gyorsított sebgyógyulást és a baktériumok számának csökkenését, mint pozitív hatást az életminőség javítására és a fájdalomcsillapításra.
Szakértői ajánlás szerint az ezüst a kritikusan kolonizált vagy fertőzött sebek kezelésére használatos, valamint igazolt multirezisztens kórokozók esetében maximum 14 napig ajánlott (7). Ezen időszak után az ezüst-ion terápia hasznosságának kritikus újraértékelésére van szükség. A kiterjedt, hosszú távú és profilaktikus alkalmazása azonban nem ajánlott (67).
5. Nátrium-hipoklorit/hipoklórsav (NaOCl/HOCl)
Hatásosság
A NaOCl / HOCl kombináció sikeres stabilizálása ökológiailag releváns fejlesztést eredményezett, a nátriumkloridot egy félig áteresztő membránon keresztül áramoltatják, majd elektrolízissel oxiklórvegyületet állítanak elő (68). Az aktivált oldatot elektrolizált víznek is nevezik (69). Alkalmazását az FDA 2005 május 9.-én a következő indikációban engedélyezte: diabeteses lábfekély, vénás keringési elégtelenség következtében kialakuló fekély, nyomási fekély, első- és másodfokú égés, valamint műtét utáni sebkezelés (77). Esettanulmányok beszámoltak az MRSA fertőzések dekolonizációjáról a bőrön és a koponyaalapon (70-71), valamint krónikus diabeteses fekélyek MRSA, P. aeruginosa és E. coli dekolonizációjáról (72). Esetismertetések szerint a NaOCl/HOCl kombináció adjuváns szerként eredményesnek bizonyult, osteitis (73) és osteomyelitis (74) esetén. A posztoperatív szövődményeket, beleértve az SSI-t (surgical site infection), szignifikánsan csökkentette az elektrolizált víz az intolerancia jelei nélküli peritonitisben szenvedő betegeknél (75). Alkalmazásával kapcsolatban ugyanaz elmondható, mint az összes antiszeptikumra, kevés a megbízható randomizált, kontrollált klinikai vizsgálat, amely alátámasztaná hatásosságukat és megbízhatóságukat a sebkezelésben (77).
Ellenjavallat
Szívsebészeti műtéteknél a mediastinum átöblítésére használt NaOCl/HOCl kombináció okolható (hemodinamikai zavarok nélkül) az EKG-n bekövetkező perioperatív változásokért, beleértve az ST-elevációt is (76).
Az ajánlás szerinti alkalmazás (7)
Az NaOCl vagy NaOCl/HOCl kombináció elsődleges választás a szennyezett traumás sebek egyszeri vagy ismétlődő tisztítására és a krónikus sebek repetitív fertőtlenítő tisztítására a tisztítási fázis alatt. Hatékony az MRSA kolonizáció ellen. Optimális választás abban az esetben, ha az antiszepszisnek érinteni kell a központi idegrendszeri struktúrákat vagy a peritonitist.
Sebfertőtlenítéshez használt Magyarországon forgalomban lévő termékek
- Neomagnol, melynek a hatóanyaga a klorogén, amely klórra és NaOCl-re hidrolizál. HOCl-t nem tartalmaz.
- Microdacyn sebkezelő oldat
- Microdacyn sebkezelő hydrogel
Nem ajánlott, elavult antiszeptikumok
A CHD (cklórhexidin) alkalmazása, az anafilaxiás reakciók kialakulásának rizikója miatt, a rezisztens mikróbák megnövekedett száma következtében, valamint az OCT-hez és PHMB-hez képest magasabb citotoxicitása miatt, nem ajánlott (78). Alternatív megoldás az OCT és PHMB, akut, harapásos sebek esetében pedig a PVP-I. A helyileg alkalmazandó ezüst-szulfadiazin alkalmazása is korlátozandó. Ez azon az ajánláson alapszik, hogy a kemoterapeutikum lokális alkalmazása a citotoxicitás, valamint a szisztémás mellékhatások miatt kerülendő (79). Szakértői ajánlás (7) a sebkezelésben elavultként említi még a szerves higanyvegyületeket tartalmazó készítmények alkalmazását. Ennek oka az elégtelen antimikróbás hatása és a higanytartalma miatti toxicitás, valamint színe miatt sem javasolt a használata, hiszen a piros színu? oldat a szövetet megfesti, és a kezdődő sebgyulladás, ferto?zés a bőrpír felismerését nehezíti (80). A merbromint vagy mercurochromot több országban is kivonták a forgalomból: az USA-ban 1998 óta, Németországban 2003 óta, Franciaországban 2006 óta nem elérheto? (81). Ennek oka, hogy 1997-ben az FDA a merbromint az ?általánosságban biztonságosnak tekinthető? ("generally recognized as safe") kategóriából a ?nem bevizsgált? ("untested") kategóriába sorolta át, felhívva a higanymérgezés potenciális veszélyére a figyelmet (82). Az FDA nyilatkozatának hatására a merbromin teljesen kiszorult a fejlett országok sebkezelési palettájáról. Szintén nem a korszerű antiszeptikumok közé tartozik a hidrogénperoxid, melynek a toxikus hatása nem csak a baktériumokat és mikróbákat pusztítja el, hanem a hám- és kötőszöveti sejteket is, és a károsodott szöveti sejtek nem képesek a növekedési faktorok termelésére. A sebalapon maradt és a seb környékére jutott dezinficiensek irritációt, nem kívánt gyulladást (leukocytosis), macerációt és ekcémát okoznak (80). In vivo vizsgálatok bebizonyították, hogy 3%-os koncentrációban a sebgyógyulásra és a reepitelizációra nincs káros hatással. Viszont 0,25%-os AA (ecetsav), a 11%- os PVP-I és a 3%-os H2O2 hatását összehasonlítva, a heg leválása után a hidrogén-peroxid esetén hólyagok és kifekélyesedések jelentkeztek (7). A sebhintőporok és garnulátumok alkalmazása fizikai tulajdonságaik miatt nem javasolt, hiszen a por vagy a száraz granulátum a mély, erősen váladékozó vagy nekrotikus sebben a sebváladékkal ?sarat? képez, ezáltal szinte beleragad a szövetekbe, nem távolítható el tökéletesen és ezért fokozza az infekció rizikóját (83).
Gyakorlati ajánlás a különböző típusú sebek kezelésére
2. ábra.
Sebtisztítás 1.
3. ábra.
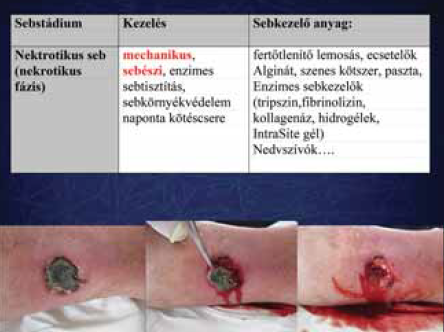
Sebtisztítás 2.
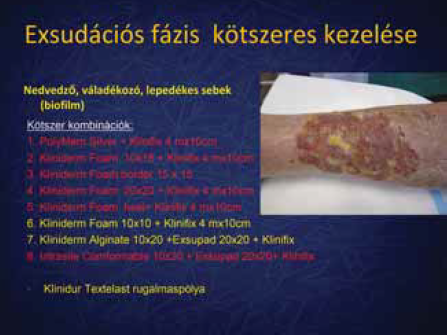
4. ábra.
Kötszeres kezelés 1.
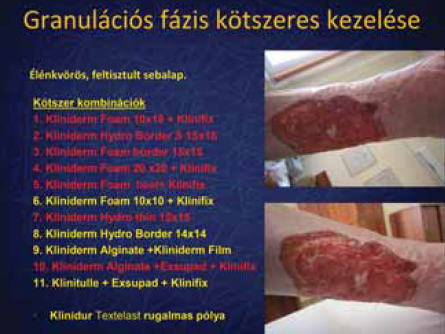
5. ábra.
Kötszeres kezelés 2.
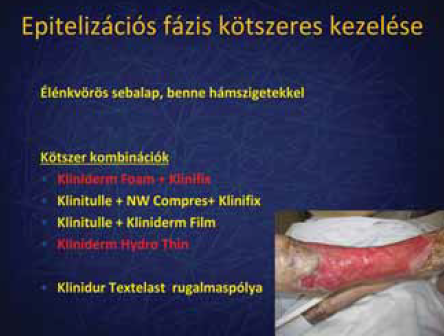
6. ábra.
Kötszeres kezelés 3.

7. ábra.
Ajánlott sebfertőtlenítők
Irodalom
- White RJ, Cutting K & Kingsley A: Topical antimicrobials in the control of wound bioburden: part 1. Ostomy Wound Manage 2006; 52(8):26-58.
- Scanlon E, Stubbs N: To use or not to use? The debate on the use of antiseptics in wound care. Br J Community Nursing (Wound Care Supp) 2002; 8-20.
- Leaper DJ, Simpson RA: The effect of antiseptics and topical antimicrobials on wound healing. J Antimicrob Chemother 1986; 2:135-37.
- Brennan SS, Leaper DL: The effect of antiseptics on the healing wound: a study using the rabbit ear chamber. Brit J Surg 1985;72:780?782 [PubMed]
- Fleming A. Penicillin? s finder assays its future. New York Times. 1945 June 26;21
- Roberts: The Role of Topical Antiseptic Agents Within Antimicrobial Stewardship Strategies for Prevention and Treatment of Surgical Site and Chronic Open Wound Infection. Wound Care; 2017 Feb 1; 6(2): 63?71
- Kramer A, Dissemond J, Kim S, Willy C, Mayer D, Papke R, Tuchmann F, Assadian O: Consensus on Wound Antisepsis: Update 2018. Skin Pharmacol Physiol 2018;31:28-58
- Angel DE, Morey P, Storer JG, Mwipatay BP: The great debate over iodine in wound care continues: a review of the literature. Wound Practice and Research 2008;16:6-21
- White RJ, Cutting KF Critical colonization - the concept under scrutiny. Ostomy Wound Manage 2006;52:50-56
- ://
- Dissemond J, Assadian O, Gerber V, Kingsley A, Kramer A, Leaper DJ, Mosti G, Piatkowski de Grzymala A, Riepe G, Risse A, Romanelli M, Strohal R, Traber J, Vasel-Biergans A, Wild T, Eberlein T: Classification of wounds at risk and their antimicrobial treatment with polyhexanide: a practice-oriented expert recommendation. Skin Pharm Physiol 2011; 24: 245-55
- http://www.woundsinternational.com/media/journals/_/ 547/files/p19-practice-development-innovations.pdf
- Hansmann F, Kramer A, Ohgke H, Strobel H, Geerling G: Polyhexamethylbiguanid (PHMB) as preoperative antiseptic for cataract surgery. Ophthalmol 2004;101:377-383.
- Hansmann F, Kramer A, Ohgke H, Strobel H, Muller M, Geerling G: Lavasept as an alternative to PVP-iodine as a preoperative antiseptic in ophthalmic surgery. Randomized, controlled, prospective double-blind trial. Ophthalmol 2005;102:1043-1050.
- Hoerauf H, Holz FG, Kramer A, Feltgen N, Krohne T, Behrens-Baumann W: Stellungnahme der Deutschen Ophthalmologischen Gesellschaft, der Retinologischen Gesellschaft und des Berufsverbandes der Augenärzte Deutschlands: Endophthalmitis-Prophylaxe bei intravitrealer operativer Medikamenteneingabe (IVOM). Klin Monatsbl Augenheilkd 2013;230:1157-1161.
- Kramer A, Assadian O, Below H, Willy C: Wound antiseptics today - an overview; in Willy C (ed): Antiseptics in Surgery - Update 2013. Berlin, Lindqvist, 2013, pp 85-111.
- https://www.pharmindex-online.hu/termekek/octenisept-kulsolegesoldat- 58950
- Braun M, Price J, Ellis M: An evaluation of the efficacy and cost-effectiveness of Octenilin? for chronic wounds. Wounds UK 2014;10:89-96.
- Cutting K, Westgate S (2012) The use of cleansing solutions in chronic wounds. Wounds UK 8(4): 130?3
- Harbs N, Siebert J (2007) In vitro efficacy of octenidine and polihexanide against biofilms composed of Pseudomonas aeruginosa. GMS Krankenhaushygiene Interdisziplina.r 2(2): 45
- Phillips PL, Wolcott RD, Fletcher J, Schultz GS (2010) Biofilms made easy. Wounds International 1(3): Available from: www. woundsinternational.com
- Urbach M, Mügge G: Libysche und syrische Kriegsverletzte - Wundversorgung am Bundeswehrkrankenhaus Hamburg. WundManagement 2013;4:51.
- Klein D, Becker D, Urbach M, Mügge G: Versorgung lybischer Kriegsverletzter am Bundeswehrkrankenhaus Hamburg unter spezieller Berücksichtigung der Hygienemassnahmen. Wehrmed Wehrpharm 2013;1:52-54.
- Krasowski G, Wajda R, Olejniczak-Nowakowska M: Economic outcomes of a new chronic wound treatment system in Poland. EWMA J 2014;14:7-13.
- Mayr-Kanhäuser S, Kränke B, Aberer W: Efficacy of octenidine dihydrochloride and 2-phenoxyethanol in the topical treatment of inflammatory acne. Acta Dermatovenerol Alp Pannonica Adriat 2008;17:139-143.
- Höning HJ: Erfahrungen bei der Anwendung von Octenisept? zur Wundantisepsis. Hyg Med 2012;37:360-362
- Hübner NO, Siebert J, Kramer A: Octenidine dihydrochloride, a modern antiseptic for skin, mucous membranes and wounds. Skin Pharmacol Physiol 2010;23:244-258.
- Good H: Charakterisierung der Desinfektionsmittel. Aktuelle Probleme der Chirurgie und Orthopädie. Bern, Huber, 1979, pp 87-96.
- Willenegger H: Local antiseptics in surgery ? revival and advance. Eur J Trauma 1994;20: 94?100.
- Chhabra RS, Huff JE, Haseman JK, Elwell MR, Peters AC: Carcinogenicity of p-chloroaniline in rats and mice. Food Chem Toxicol 1991;29:119-124.
- Below H, Assadian O, Baguhl R, et al: Measurements of chlorhexidine, p-chloroaniline, and p-chloronitrobenzene in saliva after mouth wash before and after operation with 0.2% chlorhexidine digluconate in maxillofacial surgery: a randomised controlled trial. Br J Oral Maxillofac Surg 2017;55:150-155.
- Roth B, Neuenschwander R, Brill F, et al: Effect of antiseptic irrigation on infection rates of traumatic soft tissue wounds: a longitudinal cohort study. J Wound Care 2017;26:1-6.
- Kramer A, Roth B, Mu.ller G, Rudolph P, Klo.cker N: Influence of the antiseptic agents polyhexanide and octenidine on FL cells and on healing of experimental superficial asep- tic wounds in piglets. A doubleblind, ran- domised, stratified, controlled, parallel- group study. Skin Pharmacol Physiol 2004; 17:141.146.
- Wiegand C, Abel M, Kramer A, Mu.ller G, Ruth P, Hipler U-C: Stimulation of prolifera- tion and biocompatibility of polihexanide. GMS Krankenhaushyg Interdiszip 2007; 2:Doc43 (20071228).
- Gilliver S: PHMB: a well-tolerated antiseptic with no reported toxic effects. J Wound Care/ACTIVA Healthcare 2009;(suppl 2):14.
- https://www.schuelke.com/intl-en/products/octenisept-gel.php
- Eberlein T, Assadian O: Clinical use of polihexanide on acute and chronic wounds for antisepsis and decontamination. Skin Pharmacol Physiol 2010;23(suppl 1):45-51.
- Harati K, Kiefer J, Behr B, Kneser U, Daigeler A: The use of Prontosan ? Wound Gel X in partial and full thickness burns requiring split thickness skin grafts - an interim analysis. Ann Burns Fire Disasters 2015;27:292-296.
- Daeschlein G, Assadian O, Bruck JC, Meinl C, Kramer A, Koch S: Feasibility and clinical applicability of polihexanide for treatment of second- degree burn wounds. Skin Pharmacol Physiol 2007;20:292-296.
- Moore K, Gray D: Using PHMB antimicrobial to prevent wound infection. Wounds UK 2007;3:96-110.
- Butcher M: PHMB: an effective antimicrobial in wound bioburden management. Br J Nurs 2012;21:16-21.
- Gilliver S: PHMB: a well-tolerated antiseptic with no reported toxic effects. J Wound Care 2009;18(suppl):9-14.
- Cutting KF: Addressing the challenge of wound cleansing in the modern era. Br J Nurs 2010;19:1-5.
- Lenselink E, Andriessen A: A cohort study on the efficacy of a polyhexanide- containing biocellulose dressing in the treatment of biofilms in wounds. J Wound Care 2011;20:534-539.
- Barrett S, Battacharyya M, Butcher M, et al: Consensus document: PHMB and its potential contribution to wound management. Wounds UK 2010;6:1-15.
- Shah C: Polyhexamethylene biguanide (PHMB) treated wound dressings and vancomycin-resistant enterococci (VRE). Managing Infect Control 2007;7:26-34.
- Kirker K, Fisher S, James G, McGhee D, Shah C: Efficacy of a ployhexamethylene biguanide-containing antimicrobial foam dressing against MRSA relative to standard foam dressing. Wounds 2009;21:229-233.
- Jahn B, Wassenaar TM, Stroh A: Integrated MRSA-Management (IMM) with prolonged decolonization treatment after hospital discharge is effective: a single centre, non-randomised open-label trial. Antimicrob Resist Infect Control 2016;5:25.
- Eberlein T, Kanis J: Use of a cellulose PHMB dressing in clinical practice. Int J Lower Extrem Wounds 2014;10(suppl 3):1-6.
- Behrens-Baumann W, Kramer A: Therapeutic indications for local antiinfectives. Anti- infectives against amebic keratitis. Dev Oph- thalmol 2002;33:297?303.
- https://www.bbraun.com/content/dam/catalog/bbraun/bbraunProduct- Catalog/S/AEM2015/en-01/b8/recommendation-fortreatmentusingphmb. pdf.bb-.01791389/recommendation-fortreatmentusingphmb.pdf
- Khan NM. Antiseptics, iodine, povidone-iodine and traumatic wound cleansing. J Tissue Viability 2006; 16(4):6-10.
- http://www.woundsinternational.com/media/issues/417/files/content_98 60.pdf
- Reimer K, Vogt PM, Brögmann B, et al: An innovative topical drug formulation for wound healing and infectin treatment: in vitro and in vivo investigations of a povidone iodine liposome hydrogel. Dermatology 2000;201:235-241.
- Capriotti K, Capriotti JA: Topical iodophor preparations: chemistry, microbiology, and clinical utility. Dermatol Online J 2012;18:11.
- Boothman S. Iodine White Paper: The Use of Iodine in Wound Therapy. 2010; Systagenix. 2010. Available at: http://www.systagenix.co.uk/cms/ uploads/1042_Iodine_White_Paper_A5_(INT )LP_003.pdf
- Burks RI. Povidone-iodine solution in wound treatment. Phys Ther 1998; 78(2): 212-18.
- Drosou A, Falabella A, Kirsner RS: Antiseptics on wounds: an area of controversy. Wounds 2003; 15(5): 149-66.
- Fumal I, Braham C, Paquet P et al: The beneficial toxicity paradox of antimicrobials in leg ulcer healing impaired by a polymicrobial flora: a proof-of-concept study. Dermatology 2002; 204 (Suppl) 1: 70-4.
- Moberg S, Hoffman L, Grennert ML, Holst A:A randomised controlled trial of cadexomer iodine in debubitus ulcers. J Am Geriatrics Soc 1983; 31(8): 462-65.
- Harcup JW, Saul PA: A study of the effect of cadexomer iodine in the treatment of venous leg ulcers. Br J Clin Pract 1986; 40(9): 360-64.
- Müller G, Kramer A: Biocompatibility index of antiseptic agents by parallel assessment of antimicrobial activity and cellular cytotoxicity. J Antimicr Chemother 2008;61:1281-1287.
- Gulati S, Qureshi A, Srivastava A, Kataria K, Kumar P, Ji AB: A prospective randomized study to compare the effectiveness of honey dressing vs. povidone iodine dressing in chronic wound healing. Ind J Surg 2014;76:193-198.
- Campbell N, Campbell D: Evaluation of a non-adherent, povidone-iodine dressing in a case series of chronic wounds. J Wound Care 2013;22:401-406.
- https://www.pharmindex-online.hu/termekek/betadine-kenocs-180
- https://www.pharmindex-online.hu/termekek/dermazin-10-mgg-krem-437
- Dissemond J, Böttrich JG, Braunwarth H, Hilt J, Wilken P, Münter KC: Evidenz von Silber in der Wundbehandlung - Meta-Analyse der klinischen Studien von 2000-2015. J Dtsch Dermatol Ges 2017;15:524-536.
- Fereshteh Eftekharizadeh, Reza Dehnavieh, Somayeh Noori Hekmat, Mohammad Hossein Mehrolhassan: Health technology assessment on super oxidized water for treatment of chronic wounds. Med J Islam Repub Iran. 2016; 30: 384.
- Thorn RMS, Lee SWH, Robinson GM, Greenman J, Reynolds DM: Electrochemically activated solutions: evidence for antimicrobial efficacy and applications in healthcare environments. Eur J Clin Microbiol Infect Dis 2012;31:641-653.
- Sekiya S, Ohmori K, Harii K: Treatment of infectious skin defects or ulcers with electrolyzed strong acid aqueous solution. Artif Organs 1997;21:32-38.
- Küster I, Kramer A, Bremert T, Langner S, Hosemann W, Beule AG: Eradication of MRSA skull base osteitis by combined treatment with antibiotics and sinonasal irrigation with sodium hypochlorite. Eur Arch Otorhinolaryngol 2016;273:1951-1956.
- Bongiovanni CM: Superoxidized water improves wound care outcomes in diabetic patients. Diabetic Microvasc Compl Today 2006;3:11-14.
- Küster I, Kramer A, Bremert T, Langner S, Hosemann W, Beule AG: Eradication of MRSA skull base osteitis by combined treatment with antibiotics and sinonasal irrigation with sodium hypochlorite. Eur Arch Otorhinolaryngol 2016;273:1951-1956.
- Aragón-Sánchez J, Lázaro-Martínez JL, Quintana-Marrero Y, et al: Super-oxidized solution (Dermacyn Wound Care) as adjuvant treatment in the postoperative management of complicated diabetic foot osteomyelitis: preliminary experience in a specialized department. Int J Low Extrem Wounds 2013;12:130-137.
- Garg PK, Kumar A, Sharda VK, Saini A, Garg A, Sandhu A: Evaluation of intraoperative peritoneal lavage with super-oxidized solution and normal saline in acute peritonitis. Arch Int Surg 2013;3:43-48.
- Ohno H, Higashidate M, Yokosuka T: Mediastinal irrigation with superoxidized water after open-heart surgery: the safety and pitfalls of cardiovascular surgical application. Surg Today 2000;30:1055-1056
- https://www.woundsresearch.com/sites/default/files/transfer/ - Innovacyn_WO_0515_web.pdf
- FDA Drug Safety Communication: FDA warns about rare but serious allergic reactions with the skin antiseptic chlorhexidine gluconate. 2017. https://www.fda.gov/Drugs/DrugSafety/ucm530975.html
- Kramer A, Daeschlein G, Kammerlander G, et al: Konsensusempfehlung zur Auswahl von Wirkstoffen für die Wundantiseptik. Z Wundheilung 2004;3:110-120.
- A nem gyogyulo (kronikus) bo.rsebek ellatasanak iranyelve. A Bo.rgyogyasz Szakmai Kollegium jovahagyasaval keszult iranyelv. 2012-es atdolgozott forma
- Histoire de la Pharmacie au Québec. Dictionnaire - Merbromine. 2013 Apr.
- Food and Drug Administration. Quantitative and Qualitative Analysis of Mercury Compounds in the List. 1997
- http://erbetegsegek.com/?p=aktualis&cikk=566. Dr. Daróczy Judit. A nem gyógyuló (krónikus) bőrsebek ellátásának irányelve - II. rész
- Wound Healing and Management Node Group: Evidence summary: polyhexamethylene biguanide (PHMB) wound dressings. Wound Pract Res 2013;21:82-85.
- Schedler K, Assadian O, Brautferger U, et al: Proposed phase 2/step 2 in-vitro test on basis of EN 14561 for standardised testing of the wound antiseptics PVP- iodine, chlorhexidine digluconate, polihexanide and octenidine dihydrochloride. BMC Infect Dis 2017;17:143.
- Vermeulen H, Westerbos SJ, Ubbink DT: Benefit and harm of iodine in wound care: a systematic review. J Hosp Infect. 2010 Nov;76(3):191- 9. doi: 10.1016/j.jhin.2010.04.026. Epub 2010 Aug 12.
- Vogt PM, Hauser J, Rossbach O, et al: Polyvinyl pyrrolidone-iodine liposome hydrogel improves epithelialization by combining moisture and antisepsis: a new concept in wound therapy. Wound Repair Regen 2001;9:116-122.
- Kramer A, Assadian O, Frank M, Bender C, Hinz P: Prevention of postoperative infections after surgical treatment of bite wounds. GMS Krankenhaushyg Interdiszip 2010;5: Doc12.
- Hübner NO, Wander K, Ryll S, Kramer A: Successful decolonisation of MRSA-positive patients. Med Monatsschr Pharm 2009;32:87-94.
- Kauffman CA, Terpenning MS, He X, et al: Attempts to eradicate methicillin- resistant Staphylococcus aureus from a long-term care facility with the use of mupirocin ointment. Am J Med 1993;94:371-378.
- Kampf G, Kramer A: Eradication of methicillin-resistant Staphylococcus aureus with an antiseptic soap and nasal mupirocin among colonized patients - an open uncontrolled clinical trial. Ann Clin Microbiol Antimicrob 2004;3:9.
Prof. Dr. Szokoly Miklós
Péterfy Kórház- Rendelőintézet és Országos Traumatológiai Központ, Budapest
Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2019/1. - 11-19. oldal