A thromboembóliás betegségek világszerte a haláloki statisztikák vezetői, az Egyesült Államokban például az összes rákmortalitás három-négyszeresét teszik ki. A ma rendelkezésre álló laboratóriumi módszerekkel a thrombózis hátterében kb. az esetek felében tudunk szerzett vagy veleszületett véralvadási és vérlemezke defektust felderíteni.
Érbetegségek: 2000/Suppl. 1. - 19 - 25. oldal
Jelentőség
A thromboembóliás betegségek világszerte a haláloki statisztikák vezetői, az Egyesült Államokban például az összes rákmortalitás három-négyszeresét teszik ki. A ma rendelkezésre álló laboratóriumi módszerekkel a thrombózis hátterében kb. az esetek felében tudunk szerzett vagy veleszületett véralvadási és vérlemezke defektust felderíteni.
Ezen ún. hyperkoagulábilis állapotok "találati gyakorisága" persze a thromboembóliás folyamat lokalizációjától függően eltérő: vénás betegségeknél kb. 80%-ot, fiatalkori szívinfarktusban 50%-ot, juvenilis stroke-ban 33%-ot érhet el. A thrombophiliás állapotok tehát az artériás thrombózi- sokban is - a jónéhány egyéb ismert rizikófaktorral együtt - biztosan szerepet játszanak, a vénás betegségek patogenezisében azonban kiemelkedő a jelentőségük.
A vénás thromboembóliák igen gyakoriak és mortalitásuk is meglepően nagy: az éves incidencia nagy nemzetközi felmérések szerint kb. 1-1,5%, a halálozás Molnár és mtsai 1990-es hazai adatai szerint 20/100 000, és az utóbbi két évtizedben megduplázódott. A boncolásra kerülő elhaltakban 10-60%-ban lehet korábbi vagy friss tüdőembóliát kimutatni. (Coon, 1976, Moser, 1994).
Az öröklött thrombózishajlam kimutatásának komoly jelentősége lehet, hiszen a betegnél adekvát antithrombotikus terápiát tesz lehetővé, nyilvánvalóan befolyásolja a szekunder prevenció (anticoaguláns kezelés) módját és időtartamát, továbbá meghatározhatóvá teszi a családtagok rizikóját.

I. táblázat.
Szerzett thrombosishajlam.
A thrombophilia fogalma, története
Virchow óta ismert a thrombózishajlam klasszikus triásza, a vénás sztázis, az érfal-sérülés és a véralvadási zavar szerepe (I. táblázat). Régi megfigyelés az is, hogy nemritkán olyan fiatal egyénekben is kialakul a thrombózis, akiknél az ismert szerzett rizikófaktorok nem állnak fenn. Ezen "idiopátiás" esetek, ahol a thrombózis látszólag kiváltó ok nélkül jelentkezik, és a családban halmozódnak a thrombo-embóliás epizódok, indították el a congenitális thrombophiliák megtalálására irányuló intenzív kutatómunkát. Elsőként Egeberg használta - a haemophilia analógiájára - a thrombophilia elnevezést, és 1965-ben, egy norvég családban írta le az első veleszületett thrombophiliát, nevezetesen az an- tithrombin III. defektust.
Tágabb értelemben a thrombophilia fogalmi körébe tartozik minden thrombózisra hajlamosító szerzett vagy veleszületett koagulációs zavar. Thrombotikus prediszpozíciót jelent, melynek a hátterében a természetes anticoaguláns és fibrinlitikus mechanizmusok zavara áll.
Szűkebb értelemben a thrombophilia csak a veleszületett (primer) hypercoagulációs állapotokat jelenti, melyeket az ismert (szerzett) rizikófaktorok jelenléte nélkül is a thrombózis kialakulásának és ismétlődésének fokozott kockázata jellemez. Természetesen az I. táblázatban felsorolt rizikófaktorok közül triggerként bármelyik szerepet kaphat egy thrombophiliás (veleszületett thrombózishajlammal rendelkező) beteg adott thrombobembóliás epizódjának kiváltásában.
Más megközelítésben: thrombophiliás az a beteg, akinél a mai laboratóriumi módszerekkel hypercoagulábilitást tudunk igazolni. A "klinikai" nézőpont szerint thrombophiliás az a beteg is, akinek fiatalkori, "idiopathiás", egyéb okkal kielégítően nem magyarázható thrombózisának hátterében a tudomány mai állása alapján koagulációs eltérést nem lehet találni.
Ahogy haemophiliában a súlyossági fok függvényében széles skálán helyezhetők el a klinikai manifesztáciők (enyhe-mérsékelt haemophiliában vérzések csak nagyobb traumák, műtétek után jelentkeznek, a súlyos haemophiliások viszont a gyakori spontán ízületi-, izomközti vérzések következtében idővel elnyomorodnak), úgy a thrombophiliák klinikai spektruma is jelentős változatosságot mutat. Az élettel hosszú távon összeegyeztethetetlen formák (pl.: homozygóta antithrombin és protein C deficiencia) és enyhe, társuló rizikófaktor nélkül thrombózist nem okozó mutációk (pl.: F V. Leiden, F II. 20 210) egyaránt ismertek.
Érthető, hogy először a ritkább, de kifejezettebb thrombózishajlammal járó thrombophiliák kerültek felfedezésre, sorrendben: antithrombin III. defektus (Egeberg, 1965), protein C deficiencia (Griffin, 1981), protein S deficiencia (Cornp és Esmon, valamint Griffin, 1984). Ezekben az esetekben a genetikai hiba a természetes anticoagulánsok (inhibitorok) génjére lokalizálódik, a mutációk rendkívül heterogének: az antithrombin III. hiányban kb. 80, protein C hiányban több mint 300, protein S hiányban legalább 60 az azonosított mutációk száma. Az utóbbi 5 évben leírt, enyhébb thrombózishajlammal járó thrombopbiliákat azonban egyetlen mutáció hozza létre: pl. az V. faktor Leiden mutációja (Bertinci, 1994), a metiléntetrahidrofolát-reduktáz gén mutációja (Frosst, 1995), a prothrombin 20 210 A mutációja (Port, 1996). Az újonnan felfedezett mutációk nem az inhibitorokat, hanem az alvadá si folyamatok szubsztrátjait (pl.: V. és II. faktor) érintik. A mutáns alvadási faktor vagy nagyobb mennyiségben termelődik, vagy aktivált formájának lebomlása nehezített. Enyhe thrombogenitásuk ellenére, éppen rendkívüli gyakoriságuk miatt népegészségügyi jelentőséggel rendelkezhetnek.
Klinikai kép
Már a kórelőzmény egyszerű adatai is felvethetik a figyelmes vizsgálóban az örökletes thrombózishajlam gyanúját.
A familiáris thrombophilia klinikai jellemzőit a következőkben pontokba szedve ismertetjük. (Bizonyos klinikai manifesztáciők egyes thrombophiliákra különösen jellemzőek, ilyenkor az adott defektust zárójelben feltüntettük.)
- Fiatalkori thromboembóliás betegség a családi anamnézisben.
- Laboratóriumi módszerekkel igazolt thrombophilia a közvetlen családtagoknál.
- Fiatal életkorban kialakuló thromboembóliás betegség az egyéni kórelőzményben (35 évesnél fiatalabb korban jelentkező artériás, vagy 40 év alatti vénás thrombózis, újszülöttkori spontán thrombózis).
- Ismétlődő thromboembóliás epizódok.
- "Idiopathiás" mélyvénás thrombózis (kiváltó ok nem azonosítható).
- Minimális provokáló tényező mellett kialakult vénás thromboembólia (pl.: terhesség, orális anticoncipiens kezelés, hormonpótló terápia, rövid immobilizáció, mint a transzkontinentális repülőjáratok utasainak "economy eláss syndromája").
- Kombinált vénás és artériás thrombózis (protein S deficiencia).
- Többszörös lokalizációjú vénás thrombózis (pl.: felső- és alsó végtagi + mesenteriális).
- Szokatlan lokalizációjú thrombózisok:
- - véna cava inferior,
- - véna mesenterica,
- - agyi sinus thrombdzis,
- - véna renalis,
- - - felső végtagi mélyvénás thrombózis,
- - véna lienalis, hepatica és portális thrombózis.
- Anticoaguláns kezelés ellenére is progrediáló thrombózis (antithrombinopathia, de malignus betegségek is).
- Thrombózis a serdülókortól (pl. 1-es típusú, súlyos antithrombin III. defitientia, kombinált defectusok).
- Újszülöttkori purpura fulminans (homozygóta protein C és protein S deficiencia).
- Kumarin okozta bőrnecrosis (protein C és S deficiencia, antiphospholipid syndroma).
- Klinikai és laboratóriumi heparin rezisztencia (antithrombin III. deficiencia).
- Migráló thrombophlebitis (protein C defiencia, de malignus tumornál is jellemzó lehet).
- Fokozott thromboembólia kockázat a terhesség alatt és postpartum időszakban.
- Magzati veszteség fokozott kockázata.
Mivel az uteroplacentáris keringés fenntartásában a hemosztatikus egyensúlynak különös szerepet tulajdonítanak, így nem meglepő, hogy nagy nemzetközi, multicentrikus vizsgálatban is igazolták a thrombophiliás terhesek átlagosnál nagyobb magzati veszteség arányát (Preston és mtsai, 1996). A kontrollcsoporthoz viszonyítva koraszülés vonatkozásában kb. négyszeres, spontán abortusz tekintetében másfélszeres kockázatot találtak, de egyes súlyos vagy kombinált thrombophiliákban a rizikó meghaladta a tízszeres értéket.

II. táblázat.
A thrombin sokrétű szerepe a véralvadásban.
A patomechanizmus alapjai
A hemosztatikus egyensúly biztosítja élettani körülmények között azt, hogy érsérülés esetén ne következzen be elvérzés, illetve szükségtelenül ne képződjék alvadék az erekben. Akkor tolódik el ezen finoman szabályozott egyensúly thrombogén irányban, ha
- procoagulánsok (klasszikus értelemben vett véralvadási faktorok) termelődése nő, vagy az aktivált koagulációs faktorok lebomlása szenved zavart,
- a természetes anticoaguláns - inhibitor rendszerek (antithrombin, thrombomodulin - protein C - protein S, valamint Tissue Factor Pathway Inhibitor) hatékonysága csökken,
- a kialakult véralvadék oldódása rendellenes a profibrinolitikus - fibronolitikus fehérjék egyensúlyának megbomlása következtében.
A véralvadás kulcslépése a prothrombin (II. faktor) - thrombin átalakulás, hiszen a képződő aktív szerin proteáz Ila sokolalú szerepet tölt be a koagulációs folyamatokban (II. táblázat). Kellő mennyiségben termelődve beindítja és pozitív "feed back" körökkel sokszorosára gyorsítja az alvadási folyamatokat. Érthető tehát, hogy a thrombin működését gátló, illetve termelődését szabályozó természetes anticoagulánsok hiányállapotai thrombosishajlammal járnak. A legfontosabb véralvadási inhibitorok jellemzőit a III. táblázatban foglaljuk össze.
A keletkezett thrombin inaktiválásában több inhibitor tulajdonságú fehérje is részt vesz (alfa 2-macroglobulin, tripszin inhibitor, heparin cofaktor II.), de a plazma thrombin- gátló kapacitásának döntő részét (kb. 80%-át) az antithrombin III. adja.
A klinikai szempontból fontos másik anticoaguláns mechanizmust az aktivált protein C rendszer képviseli. Résztvevői a thrombin maga, a K-vitamin dependens alvadási inhibitor protein C és protein S, valamint az intakt érendothel felszínén mindenütt megtalálható membrán fehérje, a thrombomodulin. Amint a véralvadási folyamatok során termelődött thrombin lekötődik a thrombomodulinhoz, elveszti pro- coaguláns hatását, viszont képessé válik a protein C aktiválására. A protein S a reakciósebességet gyorsító cofaktor- ként szerepel. A képződött aktivált protein C (APC) a koagulációs kaszkádban fontos cofaktor szerepet betöltő aktivált V. és VIII. faktorokat (V.a, VlII.a) inaktiválja, tehát a továbbiakban "lelassítja" az alvadási folyamatot, következésképpen kevesebb új thrombin képződik. A thrombin a protein C rendszeren keresztül tehát paradox módon anticoaguláns hatást is kifejt, mintegy gondoskodva saját "túltermelésének" megelőzéséről.

lll. táblázat.
Alvadási Inhibitorok jellemzői.
A throtnbopkiliál okozó öröklött defektusok
Számos véralvadásban szereplő procoaguláns és inhibitor faktorról mutatták ki, hogy csökkent termelésük, vagy kóros működésük thrombózishajlammal jár. Az egyes defektusok klinikai jelentősége persze más és más, hiszen gyakoriságuk és thrombogén hatásuk különböző. A IV. táblázatban foglaljuk össze a familiáris thrombophiliák előfordulási gyakoriságát az "egészséges" pupulációban és vénás thromboembólián átesett betegekben. Az adatok a "kaukázusi" (európai és észak-amerikai fehér) népességre vonatkoznak, és pl. az APC rezisztencia és prothrombin mutáció tekintetében jó egyezést mutatnak a hazai ismert adatokkal. A továbbiakban gyakoriságuknál vagy jelentősebb thrombogenitásuknál fogva fontosabb öröklött thrombophiliás állapotokat említjük külön.
Anlithrombiiiopathia
Autoszomális domináns öröklésmenet jellemzi, a heterozygóták antithrombin III. (AT III.) aktivitása általában 5060%. A fehérjét Morawitz már 1905-ben leírta, az emberi patológiában betöltött szerepe Egeberg 1965-ben közölt esete óta ismert. AT III. deficiencia/diszfunkció természetesen nemcsak mutáció következtében jöhet létre, hanem számos szerzett állapotot ismertettek (pl.: cirrhosis, proteinvesztő enteropathia, nephrosis syndroma, DIC, szepszis, heparin-, ösztrogén-, L-aszparagináz terápia), amelyekben a congenitálishoz hasonló thrombotikus kockázattal kell számolni.
Az AT III. gént 1-es kromoszóma hosszú karjának 23- 25-ös régiójára lokalizálták. A fehérje a szerin proteáz inhibitorok (SERPIN) családjába tartozik, képes az aktivált alvadási faktorok lebontására (Ha, Xa, IXa, Xla, Xlla, Vlla- szöveti faktor komplex), a heparin cofaktorként gyorsíthatja ezen reakciókat. Az AT III. 425 aminosav tartalmú egyláncú peptid, melynek biológiai félélet-ideje 48-60 óra. Ez az érték konszumpciós kórképekben, kiterjedt thromboembóli- ás folyamatokban, intenzív heparin kezelés alatt jelentősen lerövidülhet.
Az AT III. deficienciára a relatív heparin rezisztencia, a fiatal felnőttkortól jelentkező, gyakran szokatlan lokalizációid thromboembóliás epizódok jellemzőek. A betegek kétharmada 15 és 30 éves kora között szenvedi el első thromboembóliás betegségét. Fontos megemlíteni, hogy korántsem egységes kórkép, hiszen az enyhe, önmagában (hete- rozygóta formában) thrombózist nem okozó heparin-kötő- hely defektustól a súlyosabb thrombózishajlammal járó reaktív hely- vagy quantitatív defektusig terjed a klinikai spektrum.
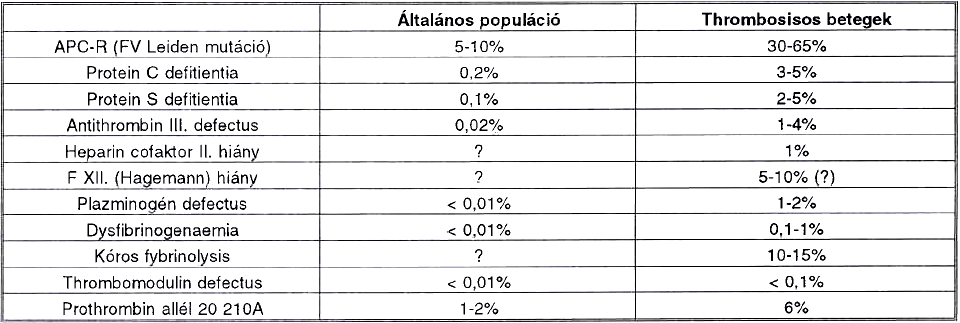
IV. táblázat.
A thrombophiliához vezető congenitalis defectusok gyakorisága.
Protein C defieieneia
A protein C K-vitamin dependens glikoprotein, mely a májban egyláncú polypeptid formájában termelődik és poszttranszlációs gamma-karboxiláción esik át. Szerzett hiányállapotain (pl: K-vitamin hiány, májbetegség, DIC, szepszis, posztoperatív állapotok, ARDS, kiterjedt thrombo-embóliás betegségek, terhesség, orális anticoncipiens terápia) kívül 1981 óta ismert az öröklött forma. A heterozygőta protein C defieieneia a defektus típusától (1-es: quantitatív, 2-es funkcionális) függetlenül 8-10-szeres thrombózis-rizikó fokozódással jár (Allaart, 1993). A deficiens egyének legalább fele 40 éves kora előtt átesik az első thromboem- bóliás betegségén.
Protein S defieieneia
A protein S ugyancsak K-vitamin dependens véralvadási faktor, a protein C aktivációjának cofaktora. A májsejteken kívül az endothelium és megakaryocyták is termelik. Élettanában egyedi vonás, hogy a keringő protein S 60%-a komplexet alkot a C4b-kötő fehérjével. Ez érhetővé teszi a protein C/protein S/thrombomodulin rendszer szoros patofiziológiai kapcsolatát a complement rendszerrel, a gyulladásos reakciókkal. A herediter protein S defieieneia előfordulási gyakorisága és thrombogenitása a protein C hiányhoz hasonló.
APC rezisztencia
Az APC rezisztencia jelenségét 1993-ban Dahlback ismerte fel. Idiopathiás thrombózisos betegeket vizsgálva azt találta, hogy egy részükben az ismert mennyiségű aktivált protein C (APC) a szokottal ellentétben nem nyújtotta meg az alvadási időt in vitro APTI alapú rendszerben. Az APC hatására bekövetkező anticoaguláns válasz elégtelenségéről, APC rezisztenciáról van tehát szó. Az esetek 95%-ában a jelenség hátterében álló V. alvadási faktor génjének Leiden mutációját (G 1691 A) Bertina 1994-ben írta le. Ez a mutáció későbbi populációgenetikai vizsgálatok szerint feltehetőleg 25-30 ezer évvel ezelőtt keletkezett, és valószínűleg kezdetben még némi szelekciós előnyt is jelenthetett heterozygóta hordozóinak. Elég csak az ebben az időben fontos morbiditási tényezőként szereplő gyermekágyi vérzésekre, harctéri sérülésekre gondolni. Érdekes a mutáció etnikai megoszlása: az eredetileg Európában élő (pl.: baszkok) és ázsiai népeknél (japánok, kínaiak) gyakorlatilag nem lehet FV Leiden mutációt detektálni, míg a mostani európai és észak-amerikai populáció jelentős hányada (5-10%) heterozygóta.
Az APC rezisztencia thrombogenitás szempontjából nem a legjelentősebb, viszont a leggyakrabban előforduló thrombophiliás állapot. A heterozygóták egynegyedénél alakul ki vénás thromboembólia az 50 éves életkor előtt. A számított thrombózis rizikó teherozygótáknál 7-szeres, míg a ritka homozygótáknál 50-100-szoros. Különösen figyelemre méltó az APC rezisztencia társulása egyéb szerzett vagy veleszületett rizikófaktorokkal. Jól illusztrálja ezt az anticoncipiensek példája: az egészséges, tablettát szedő nők thrombózis kockázata 4-6-szoros, a heterozygóta Leiden mutációt hordozóké, mint említettük kb. 7-szeres. Ha azonban egy Leiden mutáció pozitív szed anticoncipienst, a rizikó 35-50-szeresére emelkedik, ami rizikófaktorok "szuperadditív", potencírozó hatásának klasszikus példájaként tekinthető.
Prothrombin 20 210 GA
Poort és mtsai. 1996 novemberében közölték a mérsékelt thrombózishajlammal járó II. faktor mutációt. A pontmutáció a gén (11-es kromoszóma) át nem íródó 3' terminális régiójára lokalizálódik. Ez magasabb transzlációs rátához vagy stabilabb mRNS képződéshez vezet, mindenesetre nő a képződött prothrombin mennyisége, procoaguláns irányba tolva el ezáltal a hemosztázis egyensúlyát.
Az egészséges populáció 2%-a, az első thrombózison átesett betegek 6%-a, az idiopathiás thrombózis miatt vizsgáltak 18%-a bizonyult heterozygótának. Az eddigi vizsgálatok szerint mérsékelt, de gyakori, független thrombózis rizikófaktornak tekinthető, heterozygótáknál kb. 3-szoros vénás thromboembólia kockázattal, mely különösen egyéb throm- bophiliákkal kombinálódva juthat szerephez.
A kombinációk jelentősége
Magyar kutatók az elsők között mutattak rá az enyhébb, önmagukban thrombózist csak ritkán okozó defektusok kombinálódásának kiemelt jelentőségére (Sas és Pál, 1990, Sas és mtsai 1991). A mai korszerű szemlélet szerint a fiatalkori vénás thrombózis is többé-kevésbé multiplex gén betegségnek tekinthető.
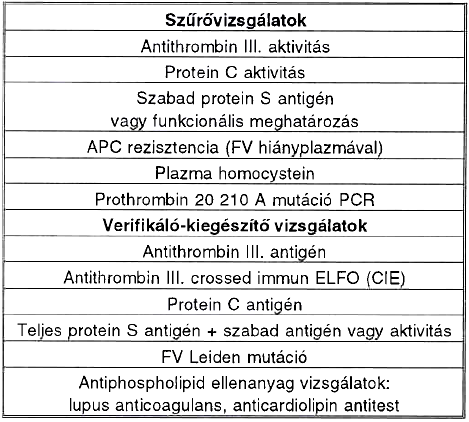
V. táblázat.
Thrombophilia diagnosztika.
Gyakorlati szempontok
Az eddigieket a mindennapi orvosi praxis szempontjából összefoglalva fontos kérdés, hogy kinél kérjünk hemosztázis vizsgálatokat familiáris thrombophilia irányában. Nyilvánvalóan indokolt a laboratóriumi szűrés minden 40 éves kor alatt jelentkező, objektív vizsgálóeljárásokkal igazolt throm- boembólia esetén, illetve rekurráló, vagy szokatlan lokalizációjú thrombózisok után. Az esetleges pozitív eredmény kapcsán a családtagok célzott szűrése szintén nem szorul hosszabb magyarázatra. Az egészségesek, de valamilyen komoly, egyéb rizikófaktorral rendelkezők korlát nélküli szűrésének elsősorban gazdasági, költség/haszon megfontolások szabnak gátat. Az elvégzendő szűrő és megerősítő-ki- egészítő vizsgálatokat az V. táblázatban soroljuk fel. Ugyancsak fontos gyakorlati szempont, hogy a vérvételnek a thrombotikus epizód után legalább 3 hónappal, az inhibitorok konszumpciójának, az akut fázis reakciónak lecsengése után, az orális anticoaguláns terápia szünetében kell történnie.
Új utak az anticoaguláns kezelésben
A ma a vénás thromboembóliás megbetegedések megelőzésére és kezelésére rendelkezésünkre álló heparin és kuma-rin készítményekkel az orvostudomány jelentős sikert ért el. A heparinok immáron hat-, a kumarinok négy évtizede képezik részét terápiás fegyvertárunknak. Elmondhatjuk tehát, hogy a mélyvénás thrombózis és tüdőembólia prevencióját és terápiáját hatásos gyógyszerekkel végezzük. Ismertek azonban a jelenlegi véralvadásgátlő eljárások korlátjai is.
A K-vitamin antagonista kumarin származékok indirekt anticoagulánsok, a K-vitamin dependens véralvadási faktorok (II-, VII-, IX-, X-) szintézisének befolyásolása útján hatnak. így a véralvadásgátló hatás kialakulásában és eltűnésében szükségképpen lényeges látencia mutatkozik: a terápiás hatás viszonylag lassan alakul ki, és túladagolásnál, amennyiben komoly vérzéses szövődmény áll fenn, önmagában nem elegendő az adagolás felfüggesztése. A thrombus kialakulását, expanzióját gátolják, thrombolyticus hatásuk nincs, tehát tulajdonképpen a thromboembóliás folyamat terjedésének, kiterjedésének profilaxisára alkalmasak. Az artériás oldalon hatékonyságuk kérdéses, inkább adjuváns jellegit Nagy individuális különbség van a kumarinok hatékony adagjában, ami elsősorban a hatóanyag eltérő biodegradációjából származik. A diéta K-vitamin tartalma nagyban befolyásolja a terápiás tartomány tartásához szükséges gyógyszeradagot. Klinikailag jelentős a nagyszámú ismert kumarin gyógyszer-interakció. A kumarin származékokat szűk terápiás ablak jellemzi: kis különbség van a hatékony megelőző és a már vérzéses mellékhatást okozó adag között. Ezért relatíve gyakori laboratómiumi (prothrombin-) ellenőrzésre van tehát szükség, ami a complience szempontjából előnytelen. Gyakori, hogy a dózismódosításra van szükség, és a kumarinok alkalmazása a beteg részéről is bizonyos intelligencia-szinthez kötött. A K-vitamin antagonisták átjutnak a placentán és teratogén hatásukat is leírták. A kumarin embriopathia többek között nasalis hypoplasia, központi idegrendszeri vérzések, végtagfejlődési rendellenességek formájában jelentkezhet. A kumarinok terhességben általában kontraindikáltak tehát. Egyes kumarin származékok az anyatejben is kimutathatóak, terápiás dózi-sokban azonban az újszülöttben anticoaguláns hatást nem hoznak létre. Hosszú távon osteporosist okozó mellékhatásukat is figyelembe kell venni. A ritkán előforduló kumarin rezisztencia és a kumarin necrosis lehetetlenné tehetik az orális anticoaguláns kezelést. Az alopecia, a "purple toes" syndroma, a máj funkciós eltérés, a gastrointestinalis panaszok szintén a ritka mellékhatások közé sorolhatóak. A legjelentősebb mellékhatás gyakoriságánál és súlyosságánál fogva a vérzés: fatális haemorrhagia < 0,5%/év; major, életet- vagy végtagot veszélyeztető vérzés 2-5%/év incidenciával jelentkezik. Ilyenkor általában nem elegendő a gyógy-szer adásának felfüggesztése és K-vitamin adagolása, hanem vérkészítmény (FFP vagy Prothrombin Complex Con- centrátum - PCC) transzfúziójára is szükség van. A vérzésveszély miatt a K-vitamin antagonisták a perioperatív időszakban általában nem használhatók.
Nem véletlen tehát, hogy intenzív kutatómunka irányul új orális anticoagulánsok kifejlesztésére. Előrehaladott klinikai vizsgálatok folynak például a direkt, reverzibilis thrombin inhibitor melagatrannal (AstraZeneca). Ennek a kistömegű véralvadásgátló szernek elméleti előnye, hogy a véralvadás utolsó lépcsőjét és annak "kulcsszereplőjét", a thrombint képes gátolni. Ehhez - szemben a heparinokkal - nem igényel cofaktort (pl.: antithrombin III., heparin cofaktor II.), és a kumarin származékokkal ellentétben szelektív. A thrombint az eddig kipróbált direkt thrombin inhibitorokkal szemben (pl.: hirudin, hirulog) reverzibilis módon gátolja, ettől várják a kutatók a szélesebb terápiás ablakot, a kevesebb vérzéses mellékhatást. A hagyományos anticoagulánsokhoz képest további előnye, hogy a már a fibrinhálóhoz kötött, a lokális propagációban fontos szerepet játszó thrombint lényegesen nagyobb mértékben képes gátolni. A hatékony vegyület melagatran, amely a thrombin aktív centrumához kötődik, csak lassan és változó mértékben szívódik fel per os adagolás után, és a táplálék jelentősen befolyásol-ja abszorpcióját. A H 376/95 jelzésű "pro-drug" azonban orálisan is hatékonyan adagolható, jól szívódik fel, és a szervezetben gyorsan a hatásos melagatranná alakul. II. fázisú klinikai vizsgálatok igazolták a se. melagatran és a H 376/95 pro-drug szekvenciális adásának hatékonyságát. A Metró II. vizsgálatban teljes csípő- vagy térdízületi endoprothesis műtétek során a standard kismolekula-tömegű heparinnal (1x5000 E dalteparin - Fragmin se.) összemérhető hatásosságot bizonyított a vénás thromboembóliák prevenciójában.
A vénás thromboembóliás betegségek megelőzésében és kezelésében az utóbbi évtizedben a kismolekula-tömegű heparinok átvették a vezető szerepet a hagyományos nem frakcionált heparin készítményektől. Ennek oka elsősorban az, hogy ha csak a hatás szempontjából fontosabb kismolekula-tömegű heparin láncokat visszük be a szervezetbe, akkor a mellékhatás-profil összességében kedvezőbben alakul. A biohasznosulás javul, az individuális plazmaszint különbségek csökkennek, a dózishatás összefüggés kiszámíthatóbb, a féléletidő megnyúlik naponta egyszeri adagolást lehetővé téve, kevesebb Heparin-Indukálta Thrombocytopenia (HIT) fordul elő, csökken az osteoporosis kockázata a hosszú távú profilaxis során, általában nincs szükség véralvadási monitorozásra. Mindez azonos profilaktikus és terápiás hatékonyság mellett valósul meg, és a vérzéses mellékhatások előfordulási gyakorisága is legalább egyenlő, vagy még inkább az LMWH készítmények előnyösebbek ebből a szempontból is a nagy multicentrikus összehasonlító vizsgálatok többségének tanúsága szerint.
A molekulatömeg csökkenésének folyamata, úgy látszik nem áll meg: III. fázisú klinikai vizsgálatok (például Pen- tathlon) folynak a legkisebb még hatékony anti Xa aktivitással rendelkező egység pentaszachariddal, melyet már szintetikusan is elő lehet állítani. A szelektív és szintetikus Xa inhibitor pentaszacharid (Org 3150/SR 90107A) maximális plazmakoncentrációja a se. injekció után két órával alakul ki.
Az optimális preventív dózis megtalálására végzett Pentatal vizsgálatban totál térdízületi endoprothesis műtétek során az Észak-Amerikában standard megelőzésnek számító naponta kétszer harminc mg se. Enoxaparin (nálunk Clexa- ne) injekcióval hasonlították össze a pentaszacharid 1x0,75- 8 pg/die dózisait. Az első eredmények alapján úgy tűnik, hogy a pentaszacharid 1x2,5 mg/nap se. injekcióban a kismolekula-tömegű heparinnal összemérhető profilaktikus hatékonysággal és vérzési kockázattal rendelkezik. A fejlesztők várakozása szerint a heparin-készítmények néhány mellékhatásától (heparin-indukálta thrombocytopenia, alopecia, osteoporosis) az új szintetikus, szelektív Xa antagonista már mentes lehet.
Az orális antieoaguláns kezelés laboratóriumi követése
A K-vitamin antagonisták adásakor a prothrombin idő, az APTI és az alvadási idő egyaránt megnyúlik. A II-, VII- és X alvadási faktorok aktivitás csökkenése természetesen jellemezhető a portohrombin idővel vagy a normál plazmával való összehasonlítás alapján prothrombin ratioval (%), azonban az alkalmazott reagensek szenzitivitása eltérő, és az egyes laboratóriumokban különböző módszereket és coagulometert használnak. Ezek a változók az International Normalized Ratio (INR) érték következetes használatával küszöbölhetőek ki. Az INR érték az adott reagens ISI - (International Sensitivity Index-) értékének ismeretében számolható.
Még jól beállított, stabil kumarin kezelés mellett is 4-6 hetente szükséges az INR meghatározása. A betegek jelentős része hosszú távú vagy élethosszig tartó orális anticoaguláns profilaxisra szorul (pl.: pitvarfibrilláció, mechanikus műbillentyű, familiáris thrombophilia, recidív thromboem- bőliás betegségek). Ezekben az esetekben a complience jelentősen javítható lehet otthoni önellenőrzés alkalmazásával. Erre példa a Németországban és Olaszországban is kipróbált CoaguChek rendszer. A hordozható készülék otthoni és ágy melletti körülmények között is alkalmazható, azonnal eredményt ad, prothrombin és APTI meghatározására egyaránt alkalmas. A prothrombin mérésre kapilláris- (ujjbegy-) vagy vénás vér is felhasználható. A vizsgálatok szerint a terápiás INR tartományban a hagyományos, coagulometerrel végzett meghatározással egyenértékű specificitás és szenzitivitás érhető el a módszerrel. Széles körű elterjedésének egyelőre költség-szempontok szabhatnak gátat.
Dr. Nemes László
Országos Haemophilia Központ,
Országos Haematológiai és Immunológiai Intézet,
II13 Budapest, Daróci u. 24.
Érbetegségek: 2000/Suppl. 1. 19 - 25. oldal