A thrombusképződés multifaktoriális folyamat, amelyben számos egymásra ható genetikai, szerzett vagy veleszületett betegség és környezeti tényező vesz részt. A thrombosis hajlam rendszerint a klinikai tünetek során derül ki. Az artériás thromboembolia kialakulásának oka objektív igazolást igényel. Első lépésként a beteg tüneteit kell megszüntetni, invazív vagy non-invazív vizsgálatokat követően megfelelő gyógyszeres, invazív radiológiai vagy sebészeti eszközökkel. Ezt követően legalább 6 hét múlva javasolt az immunológiai és thrombophilia vizsgálatok elvégzése, amelyeket erre a feladatra specializálódott laboratóriumban érdemes elvégeztetni. Eseteinkben a leggondosabb vizsgálatokkal sem tudtunk olyan rendellenességet bizonyítani, amely mindkét esetben strokeot, illetve egy alkalommal jobb felső végtagi ischaemiát okozó artériás thrombus létrejöttének oka lehetett volna.
Érbetegségek: 2007/1. 63-66. oldal
Bevezetés
A thrombosis igen ritkán idiopathiás. Általában a háttérben megtalálható a thrombosishoz, az artériás thrombus kialakulásához vezető ok, hiszen ez nem maga a betegség, hanem csak annak következménye. A haemostasisban kialakult zavar, hajlamosító tényezők közreműködésével artériás thrombus kialakulásához vezet. Az artériás thrombosis kialakulására is alkalmazható a Virchow triász: az érfal sérülése, a vér haemostaseológiai paramétereinek változása (elsősorban a thrombocyta aktiválódása) és a véráramlási viszonyok megváltozása. A felnőttkori artériás thrombosisok döntő többségében arteriosclerosis áll a háttérben. Az artériás plaque-ból felszabaduló inflammatorikus molekulák (selectinek, adhéziós molekulák, cytokinek etc.) szoros együttműködésben az aktiválódott thrombocytákkal, elindítói és részesei a thromboticus folyamatnak.
A leggyakoribb thrombosis kialakulására hajlamosító tényezők: atherosclerosis, dohányzás, hypertensio, diabetes mellitus, hyperviscositas, LDL cholesterin emelkedés, hypertriglyceridaemia, oralis kontraceptivum, hormonpótló kezelés, halmozott familiaris thrombosis, polycythaemia, thrombocythaemia, lipoprotein(a), bal szívfél elégtelenség, obesitas, autoimmun betegség, nem és az életkor. Az atherothromboticus megbetegedések progressziója szorosan összefügg a haemostasis rendszerrel. Számos nemzetközi vizsgálat bizonyította a fibrinogén szintnek, mint önálló rizikótényezőnek, a fontosságát. A fibrinogén szintet emelő tényezők közül talán legfontosabb a dohányzás. A Cardiovascular Health Study-t 5100 65 év feletti résztvevővel végezték, és azt találták, hogy a fibrinogén és a VIII. faktor emelkedett szintje egyértelműen emeli a cardiovascularis megbetegedés kockázatát. A protein C, a Protein S hiányállapotainak szerepe a vénás thromboemboliák esetében igazolt, de az artériás oldalon szerepük nem ennyire egyértelmű. Az aktivált protein C rezisztencia (APCR) kifejezett összefüggést mutat az atherothromboticus betegségek kockázatával. Ma már számos mutáció ismert, de leggyakoribb az elsőként leírt Leiden mutáció, ahol a defektus az V. faktorban van. A lipoprotein(a) emelkedett szintje a vizsgálatok tanúsága szerint független rizikófaktora a carotis stenosisnak.
Nagy számban előforduló autoimmun betegség az antifoszfolipid (APA) syndroma, amelynek leggyakoribb és legjellemzőbb megnyilvánulási formája a thrombosis és a thromboemboliás occlusiók. Láthatjuk tehát, hogy az artériás thrombus kialakulásához számtalan ok vezethet. Alábbi két esetünkben a leggondosabb kivizsgálás után sem sikerült az artériás thrombus okát megtalálnunk.
Esetismertetés
42 éves nőbeteg családi anamnézise negatív. Normál testlakatú, soha nem dohányzott, semmiféle gyógyszeres kezelésben nem részesült. Már egy évvel korábban is volt pár pillanatig tartó jobb felső végtagi-, fél évvel korábban néhány percig tartó jobb arcfél zsibbadása, valamint bal testfél gyengesége, amivel nem fordult orvoshoz. Felvétele előtt három héttel epileptiform, eszméletvesztéssel járó rosszullét miatt kezdték kivizsgálni. A koponya CT és MRI vizsgálat bal oldali parasaggitalis, kb. 2 cm átmérőjű meningeomat és bal cerebri media területi, kb. 1,5 x 2cmes vascularis károsodást igazolt, Felvételekor elvégezett rutin laboratóriumi paramétereiben kóros nem volt. A betegnél elektív műtétként a meningeoma eltávolítására készültek, amikor gyors progressziót mutató bal oldali hemiparesis alakult ki. Az ismételt koponya CT vizsgálat progressziót nem mutatott, a carotis duplex scan vizsgálat negatív volt. Az echocardiographia számottevő eltérést nem igazolt. A beteg alacsony molekulasúlyú heparint kapott, ennek ellenére 10 nappal később jobb felső végtagi akut ischaemiára utaló tünetek jelentkeztek. A kéz elfehéredett, hűvössé, fájdalmassá vált, a radialis pulzus tapinthatatlan lett. Az ekkor készült duplex scan az a. anonyma lumenéből az a.subclavia lumenébe terjedő, 45 mm hosszú, az oszlástól 25 mm távolságban szabadon lebegő inhomogén thrombust mutatott. A beteg utólagos elmondása szerint az utóbbi fél évben már többször jelentkezett a jobb kéz elfehéredése és átmeneti fájdalma, valamint a 10 nappal ezelőtt lezajlott stroke felvetette annak lehetőségét, hogy az ismételt szórás ebből a fel nem ismert, régebben kialakult thrombusból származik. Idegsebészeti osztályról való átvételét követően mellkas CT vizsgálatot és angiographiát végeztünk. A mellkas CT vizsgálat az aorta dissectiót, a mellkasi térszűkítő folyamatot, vagy gyulladást kizárta, a hasi CT vizsgálat is negatív volt. Az angiographia az a. anonyma lumenében telődési hiányt mutatott, amely folytatódott a jobb a. subclavia felé (1. ábra). Az ismételt echocardiographia sem talált emboliaforrást. Ép billentyűket, normális méretű szívüregeket és falmozgást írt le. A többszörösen kontrollált laboratóriumi vizsgálatok során sem találtunk kóros értékeket.
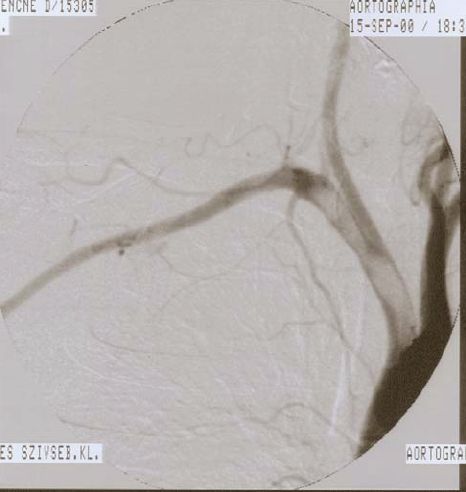
1. ábra.
Első esetünkben angiographiával igazoltuk a lebegő thrombust az a. anonymában és a jobb a. subclaviában.
Sürgősséggel műtétet végeztünk, amelynek során feltártuk a jobb a. subclaviát, az a. carotis communist és az a. brachio-cephalicat. 10.000 NE heparin adása után kirekesztettük az a.carotis communist a distalis harmadban és az a. subclaviát az a. vertebralis eredése előtt. Az arteriotomiát az a. subclavia felől vezettük az a. anonymára. Fogarthy katéterrel proximalis thrombectomiát végeztünk, a subclavia felől is eltávolítottuk a thrombust, amely friss és idősült thrombus keverékének látszott. Az a. subclavia felől nem volt kielégítő a visszavérzés, ezért miután az arteriotomia nyílását direkt varrattal zártuk, feltártuk a jobb a. brachialis oszlását is. Az a. radialisból és a. ulnarisból is a fentihez hasonló szerkezetű thrombust távolítunk el. A postoperativ carotis duplex scan negatív volt, a felső végtagon a perifériás pulzusok tapinthatók voltak. A hisztológiai vizsgálat az artériafal normális szerkezetét mutatta, kóros eltérés speciális festéssel sem igazolódott. A thrombus a hisztomorfológiai megjelenés alapján szedimentációs típusúnak bizonyult. Autoimmun betegség és thrombophilia irányában egyetemünk immunológiai és haemostasis laboratóriumába küldött vérmintáink negatív eredményt adtak.
Hazabocsátása után másfél hónappal akut jobb felső végtagi panaszok miatt ismételten felvételre került. Az angiographia az a.anonyma lumenének részleges thrombosisát igazolta. Az a. subclaviában thrombus nem ábrázolódott, de az a. radialis nem telődött, és a tenyéri ív is csak részlegesen telődött. Elektíven aorto-anonymalis bypass műtétet végeztünk, amelyet követően felső végtagi panaszai megszűntek, de az a. radialis pulzus továbbra sem volt tapintható. A két kar közötti tenziókülönbség 30 Hgmm volt. Per oralis anticoagulans terápiát állítottunk be és otthonába bocsátottuk.
Újabb góckutatás, embóliaforrás keresés és a komplett thrombophilia és autoimmun laboratóriumi vizsgálatok megismételése történt, negatív eredménnyel. A szövettani vizsgálat az anonyma falában pathológiás eltérést nem igazolt, a thrombusban a szövettani vizsgálat nem talált gyulladásos elemeket.
Távozása után 1 hónappal tervezetten vettük fel a nőbeteget, hogy a korábbi angiographiával igazolt a. radialis occlusiója miatt fibrinolysist végezzünk. Az angiographia a beültetett aorto-anonyma bypass occlusióját, az a. brachialis szegmentális telődését és az a. radialis occlusióját igazolta. Tekintettel arra, hogy a kézen akut ischaemia nem volt, ezért további érsebészeti beavatkozást nem végeztünk. A meningeoma exstirpatióját is elvégezték 2001-ben, egy évvel az érsebészeti beavatkozások után. Ez hisztológiailag is benignus elváltozásnak bizonyult.
A beteg jelenleg is szoros angiológiai gondozás alatt áll. A szokásos rheológiai és mikrocirkulációt javító gyógyszeres kezelés mellett tartós anticoagulans, és szükség szerint parenterális prosztaglandin terápiában részesül. Így állapota kielégítő, felső végtagi panaszai csak jelentős fizikai megterhelés során jelentkeznek. Neurológiai tünete nincs.
Másik 51 éves nőbetegünk távolabbi anamnézisében myoma miatt uterus exstirpatio szerepel. Kezelést igénylő betegsége nem volt, gyógyszert nem szedett.
Felvételére dyspnoe, mellkasi fájdalom, bal faciobrachialis paraesthesia és jobb szemen észlelt látótérkiesés miatt került sor. Tartós mellkasi fájdalom és jelzett ST elevatio miatt akut coronarographia történt, amely a LAD distalis harmadának kezdetén rövid muscularis bridge-t mutatott, ez azonban az áramlást nem korlátozta. A mellkasi CT és CTA vizsgálat kizárta a pulmonalis embolisatiót, mediastinalis térszűkítő folyamatot. A truncus brachio-cephalicus és a bal a. carotis communis eredésében szokatlan lokalizációjú, körülírt intraluminaris thrombust igazolt (2. ábra).
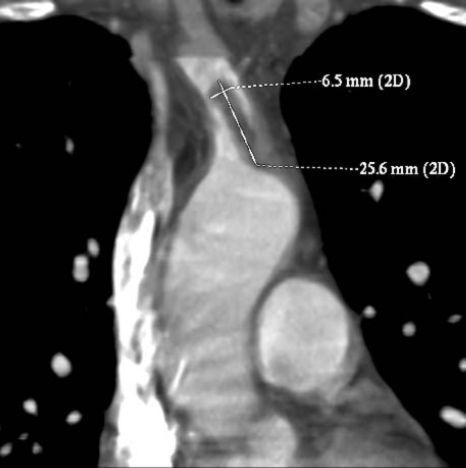
2. ábra.
Második esetünkben CT angiographia igazolta az a. anonymában lebegő thrombust.
Az aortában az aortaívből eredő nagyereken kóros elváltozás nem volt. Laboratóriumi vizsgálatai enyhe troponin T- és D-dimer pozitivitást mutattak, egyéb kóros eltérés nem volt. Az echocardiographiás vizsgálat kissé tágabb bal kamrát, jó bal kamra funkciót, mérsékelt fokú mitralis insufficientiát igazolt. Embóliaforrást nem találtunk.
Felvételekor 20 Hgmm-es tensio különbséget, a jobb kéz ujjainak lividitását észleltük, látótérkiesése, neurológiai góctünete felvételekor már nem volt. A perifériás artériák tapinthatóak, felettük zörej nem volt hallható.
A műtét során jobb oldali ferde nyaki metszésből óvatosan kipreparáltuk az a. anonymát, a jobb oldali carotis communist és az a. subclavia proximalis harmadát oly módon, hogy a kirekesztés a thrombustól distalisan felhelyezhető legyen. Heparin védelemben először az a. carotis communist, majd az a. subclaviát rekesztettük ki. Az a. carotis communisról az a. brachio-cephalicára vezetett arteriotomia után azonnal 7-es Fogarthy katéterrel blokkoltuk a beáramlást. Előtűnt az anonyma felét kitöltő, a falhoz nem tapadó, lebegő, vegyes szerkezetűnek imponáló thrombus, amelyet teljes egészében kiemeltünk, az artéria falából kicsiny területet szövettani vizsgálat céljából eltávolítottunk (3. ábra). Az arteriotomia nyílását direkt varrattal zártuk. Az artérián sem arterioscleroticus plaque-ot, sem fekélyt vagy bármiféle strukturális elváltozást nem láttunk. A szövettani vizsgálat friss thrombust igazolt, A kontroll angiographián az aortaív és a supraaorticus erek ép kontúrral ábrázolódtak kóros eltérés nélkül (3. ábra).
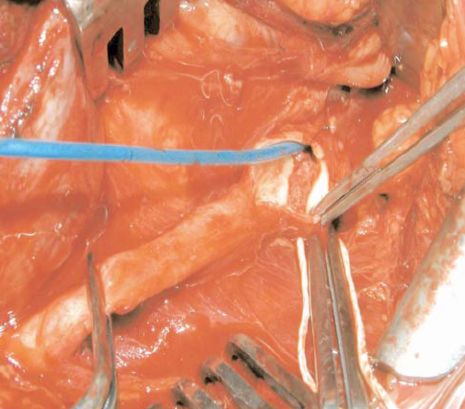
3. ábra.
Második esetünk műtéti képe. Az a. carotis communisról az a. anonymára vezetett arteriotomia után Fogarty katéterrel blokkoltuk az aorta felől a beáramlást, az ép érben a thrombus látható.
A műtét után a beteg 6 hétig preventív dózisú LMWH-t és 75 mg clopidogrelt kapott, majd megtörténtek thrombophilia, antifoszfolipid antitestestek és autoimmun háttérbetegség irányában a laboratóriumi vizsgálatok, amelyek negatív eredményt adtak. A beteg rendszeres ellenőrzés alatt áll, jelenleg napi 75 mg clopidogrel, 100mg ASA szedése mellett tünet- és panaszmentes.
Megbeszélés
Thrombosis a cardiovascularis rendszer bármely szakaszán kialakulhat. Napjainkban, a fejlett országokban kétségtelenül az artériás thrombosisok, thromboemboliás szövődmények a vezető halálokok (stroke, TIA, myocardialis infarktus, arteriosclerosis obliterans). Létrejöttükben a haemostasis nyugalmi állapotának felborulása, fokozott thromboticus aktivitás, a hiperviszkozitással kapcsolatos áramlási zavarok, az endothel dysfunctio, a thrombocyták működési zavara, a veleszületett, vagy szerzett thrombophiliák, autóimmun kórképek játszanak bizonyítottan fontos szerepet. Számtalan tényező van azonban, amelyek vizsgálata, egymásra gyakorolt hatásának megismerése még további kutatásokat igényel. Feltehetően a fent leírt két eset hátterében is létezik ok, amelyet az általunk elérhető leggondosabb vizsgálatokkal sem tudtunk kimutatni.
Irodalom
- Boda Z: Thrombosis és vérzékenység. Medicina, Budapest, 2006.
- Meskó É.: Vascularis medicina. Therapia Kiadó, Budapest, 2003.
- Silver D., Gulka I., Nicolle M., Sahjpaul R., Hachinski V.: Idiopathetic Free-Floating Thrombus of the Common Carotid Artery. Can. J. Neurol. Sci. 29: 97-99. (2002).
- Combe J., Poinsard P., Besancenot J. et al.: Free-floating thrombus of the extracranial internal carotid artery. Ann. Vasc. Surg. 4: 558-562. (1990).
- Angelkort B. et al.: Hemorrheology and hemostasis in vascular disease. A pathophysiological review. Clinical Hemorrheology and Microcirculation 26: 145. (2002).
Dr. Laczkó Ágnes
Ér- és Szívsebészeti Klinika
1122 Budapest, Városmajor u. 68.
Érbetegségek: 2007/1. 63-66. oldal