A szerzők 139 alsó végtagi perifériás obliteratív érbeteg esetében határozták meg foszfolipid ellenes antitestek előfordulási gyakoriságát a hagyományos cardiovascularis rizikófaktorok mellett. Lapus antikoaguláns 1 esetben fordult elő, kardiolipin ellenes antitestet 30 esetben, mit (32-tlycoprotein I. ellenes ellenanyagot 41 hete; esetéhen lehetett kimutatni. A Cardivascularis rizikófaktorok mellett megvizsgálták a perifériás verőér betegek cardialis és cerebrovascularis atherothromboticus érintettségét, és összefüggést kerestek a 1'oszfolipid ellenes ellenanyatok jelenléte és ezen klinikai manifesztációk között.
Az antifoszfolipid antitest pozitív és negatív betegcsoport nem különbözött egymástól a hagyományos rizikófaktorok előfordulási gyakoriságát illetően, azonos arányban fordultak elő hypertonia, cukorbetegség, dohányzás és lipid abnormalitások. Kardiolipin és (32glycoprotein I. ellenes ellenanyatok jelenlétében szignifikánsan gyakoribbnak észlelték korábbi cerebrovascularis ischaemiás megbetegedések előfordulását. Hasonló összefüggést a lapus antikoaguláns vonatkozásában nem találtak. További érdekes összefüggésként a hypertoniás és a dohányos hete-csoportban a (32glycoprotcin L ellenes antitestek szignifikánsan gyakoribb előfordulását észlelték.
Az antifoszfolipid antitestek jelenléte a perifériás érbetegségek szekunder prevenciója során alkalmazott antithromboticus stratégia megválasztása szempontjából kiemelt jelentőséggel bír.
Érbetegségek: 2006/1. 21-26. oldal
KULCSSZAVAK
kardiolipin ellenes antitestek, ß2-glycoprotein I. ellenes antitestek, atherosclerosis, perifériás obliteratív érbetegség, cardiovascularis rizikikófaktorok
Bevezetés
Az atherosclerosis komplex pathomechanizmusának egyik domináns folyamata az a krónikus gyulladás, amely tetten érhető az atheroscleroticus léziókban. A folyamatban kitüntetett szereppel bírnak az aktivált T-lymphocyták. A plaque-ban kimutatható autoantigének jelenlegi ismereteink szerint az oxidált alacsony intenzitású lipoprotein (ox-LDL), a hőshock protein (HSP), valamint a (ß2-glycoprotein I. (ß2GPI). A közelmúlt kutatási eredményei alapján a (ß 2GPI mint autoantigén, valamint az ellene irányuló autoantitestes mechanizmus az, amely bizonyítja a kapcsolatot az atherosclerosis folyamata és az antifoszfolipid szindróma pathomechanizmusa között. Az antifoszfolipid szindróma maga egy lényegesen tágabb klinikai entitás, amelyben több autoantitest vesz részt (lupus antikoaguláns, kardiolipin ellenes antitestek (ß2GPI-dependens rendszerben, valamint foszfolipid struktúrák mellett az immunogcnitást fokozó fehérje kofaktorok ellen irányuló ellenanyagok, úgymint inti-( ß2GPI, anti-annexin, antifoszfatidilszerin). Az antifoszfolipid szindróma többirányú klinikai manifesztációval jár együtt: az akcelerált atherosclerosis mellett artériás, vénás, illetve szívbillentyűket érintő thromboticus folyamatok, ismétlődő vetélések és korai magzati halálozások egy meghatározott csoportja.
A foszfolipid struktúrák elleni antitestek jelenléte az egyik legfontosabb szerzett thrombophil tényező. A vénás thromboembóliás folyamatok mellett szerepet játszanak az artériás thromboticus folyamatok kialakulásában is, amelyek közül kiemelkedő jelentőségű a cerebralis erek (stroke, illetve ischaemiás cerebrovascularis léziók) és a coronariák thromboticus érintettségei. Ezen antitestek thromboticus hatásmechanizmusai többrétűek. Komplex módon gátolni képesek az endothel antithromboticus funkcióit. Az antithrombin III., protein S és protein C gátlás, a thromboxan/prostacyclin balance thromboticus irányba történő eltolása, valamint a csökkent fibrinolyticus aktivitás emelhető ki, de nem elhanyagolható a szöveti faktor gátló proteinjeinek inaktiválása sem (7, 8, 15).
Az antifoszfolipid szindróma diagnózisa thromboticus klinikai kritériumokon és antifoszfolipid antitestek (aPL) ki mutatására irányuló laboratóriumi kritériumokon alapul (19). A thromboticus folyamat lehet bármely szerv artériáinak, vénáinak, illetve kisereinek egy vagy több alkalommal bekövetkezett, egzakt módon igazolt thromboticus folyamata.
Laboratóriumi kritériumok:
1. IgG és/vagy IgM típusú antikardiolipin antitestek (aKL) jelenléte a vérben, közepes vagy magas titerben, két vagy több alkalommal, legalább 6 hét különbséggel meghatározva. Az antikardiolipin antitestek kimutatására (ß2glycoprotein L-dependens standardizált ELISA módszeri kell alkalmazni.
2. Lupus antikoaguláns (LA) jelenléte a plazmában, két vagy több alkalommal, legalább 6 hét különbséggel, a kimutatást a Nemzetközi Thrombosis és Haemostasis Társaság ajánlása alapján végezve.
3. A (32-glycoprotein 1.-ellenes antitest (a~2GPI) mint foszfolipid ellenes antitest a jelenleg érvényes kritériumrendszerben nem szerepel ugyan, de egyre több adat látszik alátámasztani szerepét az antifoszfolipid szindróma egyes klinikai manifesztációiban (12, 13).
Betegek és módszerek
A DE OEC III. sz. Belklinikán kezelt, illetve az angiológiai szakrendelés által gondozott alsó végtagi perifériás obliteratív érbetegekben prospektív jelleggel vizsgáltuk az aPL antitestek jelenlétét. Az antifoszfolipid antitest meghatározásoknál a Wilson és munkatársai által meghatározott irányelveket alkalmaztuk (19).
Lupus antikoaguláns, antikardiolipin antitestek és (32glycoprotein 1.-ellenes antitest meghatározások történtek, valamint felmértük az érbetegség szempontjából hagyományos rizikófaktorokat is. Az anamnesztikus adatokat felhasználva összefüggést kerestünk a perifériás érbetegséghez társuló coronaria atherosclerosis és az antifoszfolipid antitestek jelenléte között. Hasonló összefüggési rendszerben vizsgáltuk a perifériás érbetegséghez társuló cerebrovascularis atherosclerosis manifesztációinak antifoszfolipid antitest függését Kontrollcsoportként ötven egészséges véradó mintáit használtuk fel.
A vizsgálatba a DE OEC III. sz. Belklinikán kezelt, illetve az angiológiai szakrendelésen gondozott perifériás érbetegek közül 139-et választottunk ki, random módon, prospektív jelleggel.
A perifériás érbetegség igazolása color duplex UH és/vagy artériás angiographiás vizsgálattal történt.
A perifériás érbetegséghez társuló coronaria atherosclerosist abban az esetben fogadtuk el, ha a beteg anamnesztikus adataiban pozitív coronarogramm, pozitív terheléses EKG került dokumentálásra, vagy az anamnézisben korábbi akut myocardialis infarctus, instabil angina miatti kezelés vagy stabil angina pectoris szerepelt. A perifériás érbetegséghez társuló cerebrovascularis atherosclerosisos manifesztációkat pozitív carotis UH-, illetve angiographiás lelet, pozitív CT- vagy MR-lelet, illetve korábbi TIA vagy ischaemiás stroke esetén fogadtuk el.
A hagyományos rizikótényezők felmérése a következőkre terjedt ki: dohányzás, hypercholesterinaemia (cholesterin > 5,2 mmol/l), hypertriglyceridaemia (triglycerid > 1,7 romol/1), emelkedett LDL-cholesterin (LDL-chol. > 3,4 romol/1), hypertonia betegség, diabetes mellitus.
Az alkalmazott statisztikai módszer a chi-2 próba és a Fisher-féle egzakt teszt volt.
Eredmények
A vizsgált betegek közül 1 bizonyult lupus antikoaguláns pozitívnak, kardiolipin ellenes antitestet 30 beteg szérumában találtunk, valamint 41 beteg volt (32-glycoprotein I. ellenes antitest pozitív. Többes pozitivitást 7 beteg esetében észleltünk, közülük 6 volt aKL és a(32GPI antitest pozitív, míg 1 beteg esetében volt hármas pozitivitás kimutatható (I. táblázat). Lupus antikoaguláns nem gyakoribb, mint az egészséges kontrollcsoportban, de az aKL és az a(32GPI ellenes ellenanyagok aránya jelentősen magasabb perifériás artériás érbetegségben.
Az antifoszfolipid antitest pozitív és negatív betegek a nemek arányában nem mutattak lényeges eltérést, a számszerű adatokat a II. táblázatban tüntettük fel.
Vizsgált érbetegeink funkcionális stádiumát az antifoszfolipid antitestek jelenlétével összefüggésben a III. táblázatban részletezzük. A betegek jelentős része (113 páciens) Fontaine II. stádiumban volt a vizsgálat időpontjában. A Fontaine szerinti stádium-beosztást az alábbiak szerint alkalmaztuk (20):
Fontaine I. stádium: tünetmentes szak, a beteg szubjektív panaszt nem említ, a boka-kar index mérsékelten beszűkülhet.
Fontaine II. stádium: claudicatio intermittens, a tünet lényege, hogy járás közben az érintett végtagban fájdalom keletkezik, emiatt a betegnek meg kell állnia. Megállás után a fájdalom fokozatosan mérséklődik, majd megszűnik. A fájdalom nélkül megtett úthossz (dysbasiás távolság) csökkenése a kórfolyamat súlyosságát jelölheti, azaz Fontaine II/a: a dysbasiás távolság 200 méter feletti, Fontaine II/b: a dysbasiás távolság 200 méter alatti.

I. táblázat: Antifoszfolipid antitestek előfordulási gyakorisága a perifériás artériás érbetegségben.

II. táblázat: Az antifoszfolipid antitest pozitív és negatív betegek megoszlása.

III. táblázat: A perifériás érbetegség funkcionális stádiumai a foszfolipid ellenes antitestek jelenlétével összefüggésben.
Fontaine III. stádium: nyugalmi fájdalom, amely főleg éjszaka jelentkezik, ami a beteget a végtag lógatására készteti.
Fontaine IV. stádiumo gangraena, nyilvánvaló szubjektív panaszok mellett trophicus zavarok alakulnak ki.
A hagyományos rizikófaktorokat, illetve rizikóbetegségeket elemezve: azonos arányban fordult elő az antifoszfolipid antitest pozitív és az antifoszfolipid antitest negatív csoportban a hypertonia betegség (69,3%, illetve 62,5%), a cukorbetegség (28%, illetve 21,87%), a hypercholesterinaemia (69,33%, illetve 62,5%), a kóros LDL-cholesterin (54,66%, illetve 39%), a hypertriglyceridaemia (49,43%, illetve 40,62%), valamint a dohányzás (46,66%, illetve 64,06%). Az adatokat a IV. táblázatban foglaltuk össze.
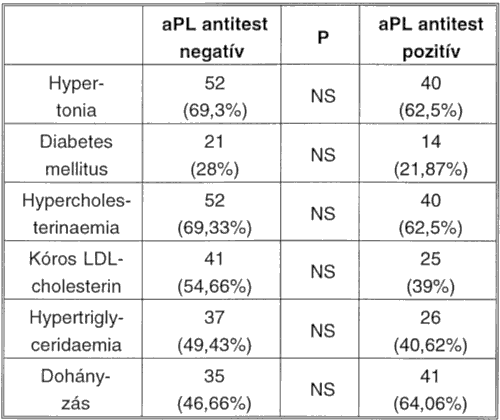
IV. táblázat: Rizikófaktorok, rizikóbetegségek előfordulása antifoszfolipid antitest pozitív és negatív betegeink esetében.
Összefüggést keresve a perifériás érbetegséghez társuló coronaria, illetve cerebrovascularis megbetegedések és az antifoszfolipid antitestek jelenléte között, azt találtuk, hogy a coronaria érintettség egyik antifoszfolipid antitest csoporttal sem mutat összefüggést, azaz ezen antitestek jelenléte nem növeli a társuló coronaria érintettség valószínűségét. Ezzel szemben az aKL és az a(ß2GPI antitest pozitív csoportban is szignifikánsan magasabb a perifériás érbetegséghez társuló cerebrovascularis érintettség. A (ß2GPI ellenes antitest pozitív csoportban a cerebrovascularis manifesztáción túl a hypertonia betegség és a dohányosok száma is szignifikánsan magasabbnak adódott, így a (ß2GPI ellenes ellenanyagok jelenlétét, mint önálló tényezőt, a magasabb cerebrovascularis társulásban nem tudtuk igazolni. Ezzel szemben az aKL antitest pozitív betegek csoportjában a hypertonia betegség és a dohányzás aránya nem volt magasabb, mint az aKL antitest negatív csoportban, így az aKL antitest pozitivitással bíró csoportban észlelt szignifikánsan magasabb cerebrovascularis társulás hypertoniától és dohányzástól független rizikótényezőnek bizonyult (V. táblázat).

V. táblázat: Antifoszfolipid antitest pozitivitással összefüggésbe hozható klinikai manifesztációk.
Mivel az aKL és a(ß2GPI ellenanyag pozitivitás esetén a cerebrovascularis érintettség fordult elő szignifikánsan gyakrabban a többi klinikai manifesztációhoz képest, ezért ezen elváltozásokat részletesen is elemeztük. A legtöbb betegnél nem szignifikáns, 60% alatti arteria carotis stenosis volt kimutatható (VI. táblázat).
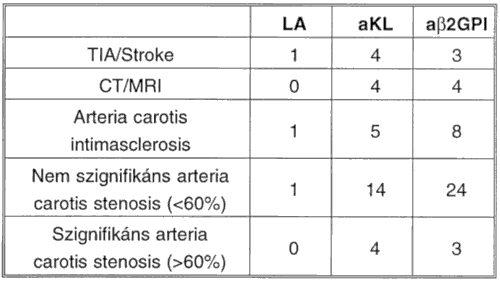
VI. táblázat: Foszfolipid ellenes antitestek előfordulási gyakorisága perifériás érbetegeink cerebrovascularis érintettsége esetén.
Megbeszélés
Az utóbbi években a kutatások előterébe került az immuno-inflammatorikus folyamatok tanulmányozása az atherosclerosis folyamatában (16). Korrelációt találtak a hőshock protein-60 ellenes antitestek litere és a carotis UH által kimutatott atherosclerosisa között. Bizonyított az összefüggés az oxidált-LDL elleni antitestek szerepét illetően myocardialis infarktusban, a coronaria atherosclerosisos progressziójában és az angioplastica utáni restenosisok létrejöttében. A (ß2-glycoprotein I. elleni antitestek jelenléte jól korrelál az atherosclerosissal. In vitro a (ß2PGI ellenes antitestek fokozzák a macrofagok oxidált LDL-felvételét. Az oxidált LDL-elleni antitestek szerepére vonatkozó adatok ellentmondóak az irodalomban. Egyrészt ezen antitestek szintje emelkedett lehet perifériás vascularis betegségekben, súlyos carotis stenosisban és angiographiával igazolt coronaria betegségben (14, 5). Ezzel ellentétben idős ischaemiás stroke-os betegek szérumában csökkent ellenanyag-szintet mértek (6), valamint állatmodellekben az oxidált LDL-1e1 történő immunizálással az atherogenesis suppressiója volt elérhető (1, 9). Igazolták, hogy a (ß2GPI a makrofágok oxidált-LDL felvételét csökkenti (11). Megfigyelték, hogy az oxidált-LDL elősegíti a (32GPI molekula konformációs változását, és ezáltal segíti az antifoszfolipid antitestek kötődését (18). Az oxidatív LDL elleni antitestek nem közvetlenül avatkoznak be a véralvadási rendszerbe, hanem az érfal atheroscleroticus, illetve vasculitises gyulladásos folyamataiban vesznek részt. A (ß2GPI és a prothrombin ellenes antitestek viszont a thromboticus folyamatokkal asszociálódnak, valószínűleg a haemostasis egyensúlyt a hypercoagulatio felé tolják el (17).
Az aPL antitestek és az atherosclerosis klinikai kapcsolata jól vizsgálható az alsó végtagi artériás obliteratív érbetegségben, számos kísérletes adat ebből a betegpopulációból származik. Ennek ellenére az irodalomban nincs sok nagyszámú beteganyagon végzett olyan klinikai tanulmány, amely a különböző aPL antitestek pontos arányát célozta meghatározni ebben a betegcsoportban, valamint választ keresni arra a kérdésre, hogy önálló rizikófaktorként tekinthetünk-e ezen antitestekre az atherosclerosis progressziójában. Glueck és munkatársai 864 beteg adatait dolgozták fel kor, cholesterin, triglycerid, lipoprotein (a), homocystein, IgG és IgM aKL antitest, valamint származás, nem, hypertensio, diahetes és dohányzás vonatkozásában. A vizsgált betegpopulációjukban az aKL antitestek jelenléte független rizikótényezőnek bizonyult az atherosclerosis érbetegségek kialakulásában, beleértve a myocardialis infarctust, coronaria artéria bypass graft műtétet, a coronaria angioplasticát, a transiens ischaemiás attackot, illetve stroke-ot (10).
A fenti irodalmi adatok ismeretében logikusnak adódott azon célkitűzésünk, hogy perifériás érbetegek között prospektív jelleggel határoztuk meg a lupus antikoaguláns, az antikardiolipin- és a (ß2-glycoprotein I. ellenes ellenanyagok jelenlétének gyakoriságát és klinikai relevanciáját.
Lupus antikoaguláns 1 betegben, kardiolipin ellenes antitestek 30 betegben, anti-ß2-glycoprotein L antitest 41 beteg esetében volt kimutatható a 139 beteg adatainak feldolgozása során. Többes pozitivitást 7 beteg esetében találtunk. Az érbetegség multilokularitása szempontjából összefüggést lehet kimutatni a kardiolipin és (ß2-glycoprotein I. ellenes antitestek jelenléte és a perifériás érbetegség mellett jelenlévő cerebrovascularis atheroscleroticus manifesztáció között. A (ß2GPI elleni antitest pozitív csoportban azonban a hypertonia betegség és a dohányzás szignifikánsan magasabb volt, ezért ezen antitest jelenlétét mint önálló rizikótényezőt nem definiálhatjuk. Felvetődik azonban az az érdekes, további vizsgálatokat involváló kérdés, hogy a dohányzás és a hypertensio - hipotetikusan felvetve endothelt károsító hatásuk miatt potenciálisan megjelenő epitópok lehetőségét - indukálja RZGPI ellenes ellenanyagok termelődését. A (ß2GPI ellenes antitest pozitív csoporttal szemben a KL ellenes antitest csoportban nem volt magasabb a dohányosok és a hypertoniás betegek aránya, így ebben a csoportban az aKL antitest pozitivitást független rizikótényezőként adhatjuk meg a perifériás érbetegséghez társuló cerebrovascularis atherothrombosis megjelenésében.
Adatainkat lényegesnek tartjuk a perifériás érbetegek hosszú távú antithromboticus kezelése szempontjából. Joggal merül fel, hogy ezen betegek esetében erőteljes antithromboticus - melyen belül kiemelt jelentőségű optimális antikoaguláns - kezelés indokolt. Ezek a betegek ugyanis potenciális jelöltek arra, hogy a vénás oldalon is jelentkezik thromboticus esemény, amelynek kivédésére az artériás thromboticus események prevenciójára használt thrombocyta funkciót gátló kezelés önmagában nem elegendő. Multicentrikus klinikai vizsgálatok folynak a perifériás érbetegség, illetve az antifoszfolipid szindróma optimálisan tartós antithromboticus kezelésének meghatározására.
(A klinikai tanulmány a Bólyai ösztöndíj és a T46517 számú OTKA pályázat támogatásával készült.)
Irodalom
- Ameli, S., Hultgardh-Nilsson, A., Regnstrorn, J. és mtsai.: Effect of immunisation with homologous LDL ami oxidized LDL on early atherosclerosis in hypercholesterolemic rabbits. Arterioscler. Thromb. Vasc. Biol., 16: 1074-1079. (1996.)
- Asherson, R. A., Khamasta, M. A., Ordi-Ros, J. és mtsai: The primary antiphospholipid syndrome: major clinical and serological features. Medicine (Baltimore), 68: 366-374. (1989.)
- Asherson, R. A. és mtsai.: Cerebrovascular disease and antiphospholipid antibodies in systemic lupus erythematosus, lupus-like disease and the primary antiphospholipid syndrome. Am. J. Med., 86: 391. (1989.)
- Bick, R. L., Baker, W. F.: Antiphospholipid syndrome and thrombosis. Seminars Thromb. Haemost., 25: 333-350. (1999.)
- Bui, M. N., Sack, M. N., Moiutsathos, G. és mtsai: Autoantibody titers to oxidized low-density lipoprotein in paticnts with coronary atherosclerosis. Am. Heart. J., 131: 663-667. (1996.)
- Cherubini, A., Mecocci, P., Serein, U. és mtsai.: Autoantibodies against oxidized low-density lipoproteins in okiét stroke patients. J. Am. Geriatr. Soc., 45: 125. (1997.)
- Cosgriff, T. M., Martin, B. A.: Low functional and high antigenic antithrombin III. lével in patient with the lupus anticoagulant and recurred thrombosis. Arthritis Reumatol., 24: 94. (1981.)
- Freysinnet, J. M., Wiesel, M. L., Gauchy, J. és mtsai.: An IgM lapus anticoagulant that neutralizes the enhancing effect of phospholipid on purified endothelial thrombomodulin activity - a mechanism far thrombosis. Thrombosis and Haemostasis, 55: 309. (1986.)
- George, J., Afek, A., Gilburd, B. és mtsai.: Induction of early atherosclerosis in LDL-receptor-deficient mice immunized with beta2-glycoprotein L Circulation, 98: 1108-1115. (1998.)
- Glueck, C. J., Lang, J. E., Tracy, T. és mtsai.: Evidence that anticardiolipin antibodies are independent risk factors for atherosclerotic vascular disease. A. J. Cardiol., 83: 1490 1494. (1999.)
- Hasunuma, Y., Matsuura, E., Makita, Z. és nitsai.: Involvement of beta2-glycoprotein I and antibodies in oxidatively modified low-density lipoprotein uptake by macrophages. Clin. Exp. Immunol., 107: 569-573. (1997.)
- Lakos G., Kiss E., Zeher M. és mtsai.: A (32-glikoprotein I. elleni antitest az antifoszfolipid szindróma specifikus laboratóriumi markere. Magyar Belorv. Arch., 51: 307-310. (1998.)
- Lakos G., Kiss E., Regéczy N. és mtsat.: Isotype distribution and clinical relevance of anti-B2-glycoprotein I (B2-GPI) antibodies: importance of IgA isotype. Clin. Exp. Immunol., 117: 574-579. (1999.)
- Lehtimaki, T., Lehtinen, S., Solakivi, T. és mtsai.: Autoantibodies against oxidised low density lipoprotein in patients with angiographically verified coronary artery disease. Arterioscler. Thromb. Vasc. Biol., 19: 23-27. (1999.)
- Marciniak, E., Romond, E. H.: Impaired catalytic function of activated protein C: a new in vitro manifestation of lupus anticoagulant. Blood, 74: 24-26. (1989.)
- Sherer, Y., Shoenfeld, Y.: Immunmodulation for treatment and prevention of atherosclerosis. Autoimmun. Rev., 1-2. (2002.)
- Vaarala, O.: Antiphospholipid antibodies and adlerosclerosis. Lapus, 5: 442-447. (1996.)
- Vaarala, O.: Antibodies to oxidized LDL. Lupus, 9: 2022005. (2000.)
- Wilson, W. A., Gharavi, A. E., Koike, T. és nttsai: International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome. Am. Coll. Rhewnatol., 42: 1309-1311. (1999.)
- Meskó É.: Fontaine szerinti stádiumbeosztás. Iu: Belgyógyászati Angiológia, szerk.: Meskó É., Farsang Cs., Pécsvárady Zs. Medicina, Budapest, 1999. 247-249.
Dr. Veres Katalin
DE OEC, III. sz. Belgyógyászati Klinika
4004 Debrecen, Móricz Zsigmond krt. 22.
Érbetegségek: 2006/1. 21-26. oldal