Célkitűzés: az égési trauma jelentős oxidatív stresszt vált ki a szervezetben, azonban még kevés adat áll rendelkezésre az égési sérültek antioxidáns terápiájának hatékonyságáról. Munkánk során vizsgálni kívántuk a kiegészítő antioxidáns kezelés hatását súlyos égési traumát szenvedett betegek oxidatív stressz válaszára.
Beteganyag és módszer: 16 beteget vontunk be vizsgálatunkba, akiket két csoportra osztottunk. A folyadékterápiát mindkét betegcsoportban azonos módszerrel végeztük, amit a második csoportban nacetilcisztein kezeléssel egészítettünk ki. A betegektől vénás vérmintát vettünk közvetlenül a felvétel után, majd ezt követően öt napig naponta. Meghatároztuk a vérképet és az oxidatív stressz markereit. A csoportokban mért adatokat egymáshoz, valamint egészséges populációhoz (n=9) viszonyítva értékeltük.
Eredmények: a két csoport betegeinek kora és égett testfelületük nagysága között nem volt szignifikáns különbség. A felvételkor mért magas fehérvérsejt szám a harmadik napra mindkét csoportban normalizálódott. A kifejezett granulocitózis és limfocitopénia fokozatosan javult az n-acetilcisztein csoportban, míg az n-acetilcisztein kezelés nélküli csoportban a leukociták relatív aránya a 4. naptól ismét emelkedést mutatott. A plazma malondialdehid szintje, valamint a teljes vér indukált szabadgyök termelése mindkét betegcsoportban magasabb volt a kontroll populáció értékeihez viszonyítva. A gyöktermelés-maximum szignifikánsan magasabb volt az n-acetilciszteinnel kezelt csoportban a kezeletlen csoporthoz képest a 4. és az 5. napon. Az n-acetilcisztein kezelés kifejezetten megemelte a plazma szulfhidril csoportok szintjét, és a glutation szint is hamarabb normalizálódott. A szuperoxid dizmutáz és kataláz enzimek aktivitásának alakulását az n-acetilcisztein kezelés nem befolyásolta. Az n-acetilciszteinnel kezelt csoportban magasabb volt a betegek túlélése a kezeletlen csoporthoz viszonyítva (63% vs. 37%), azonban ez a különbség statisztikailag nem volt szignifikáns.
Konklúzió: előzetes eredményeink szerint az égett betegek kiegészítő n-acetilcisztein kezelése emeli a szervezet endogén, nem enzimatikus antioxidáns szintjét, de nem csökkenti a prooxidáns paramétereket, különösen nem a fehérvérsejtek aktiválódását.
A kutatást az OTKA K060227 támogatta.
Érbetegségek: 2009/2. 35-44. oldal
KULCSSZAVAK
égési sérülés, oxidatív stressz, antioxidáns kezelés, Nacetilcisztein
Bevezetés
Az égési sérülés után kialakuló patológiás szabadgyökös reakciók során a ROS (reactive oxygen species - reaktív oxigén származékok) száma megsokszorozódik és a közömbösítésükhöz rendelkezésre álló endogén antioxidáns védőrendszer kapacitása már nem elegendő (1). A fokozott gyöktermelés és az antioxidáns mechanizmusok elégtelen működése következtében súlyos károsodásokat okozó állapot alakulhat ki, amit "oxidatív stressznek" nevezünk Az oxidatív stressz hatására fokozódik a kapilláris permeabilitás és fehérjében gazdag folyadék lép ki a pórusokon. A kilépő folyadék megreked a szövetek között és ödéma formájában felszaporodik. Ezek a változások a hő mikrocirkulációra történő direkt hatásának és a keletkező kémiai mediátoroknak a komplex kölcsönhatása révén alakulnak ki, így nem csak az égési sérülés által közvetlenül érintett területeken jelennek meg, hanem a felszabadult mediátorok hatására a test egésze érintett lesz az ödémaképződés folyamatában. Az antioxidáns terápia célja a szabadgyök képződés gátlása vagy csökkentése, a ROS termékek közömbösítése, valamint a gyulladásos válasz kialakulásának a gátlásával a szöveti sérülés létrejöttének, progressziójának megakadályozása (2).
Oxidatív hatásokra az antioxidánsok szintjében csökkenés figyelhető meg, miközben lipidperoxidáció és proteinkárosodás alakul ki. A jelátviteli utak ennek hatására létrejövő aktivációja váltja ki az antioxidánsoknak a szervezet raktáraiból történő mobilizációját. A káros következmények megelőzése szempontjából fontos lehet az antioxidánsok szintjének magasan tartása és szükség szerint exogén bevitellel történő pótlása (3). Terápiásan a leggyakrabban használt anyagok a deszferrioxamin, az allopurinol (a xantin oxidáz specifikus inhibitora), a NAC, a szuperoxid dizmutáz (SOD), a C- és E-vitamin.
Számos tanulmány igazolta már a C-vitaminnak mint gyökfogónak az égési sérülést követő lipidperoxidációt, ér permeabilitást, ödémaképződést és folyadék igényt csökkentő hatását. Dubick és munkatársai kísérletes tanulmányában a C-vitamint tartalmazó infúzió szignifikánsan csökkentette a folyadékigényt és a nettó folyadék egyensúlyt, a kizárólag Ringer-laktátal kezelt csoporttal összehasonlítva. Csökkentette a plazma lipidperoxidációs indexet, és fenntartotta a teljes antioxidáns státuszt (4). Matsuda és munkatársai megfigyelése szerint a nagy dózisú C-vitamin alkalmazása emberekben 60%-kal csökkentette a folyadékigényt a csak Ringer-laktát infúzióval reszuszcitált csoporttal szemben, csökkentette továbbá az égett szövet víztartalmát, a lélegeztetett napok számát. A hemodinamikai paraméterek és a bázis deficit azonos volt a két csoportban. A C-vitamin a folyadékpótlás csökkentésére kifejtett hatásának mechanizmusa pontosan még nem ismert. Feltételezések szerint csökkenti a kapilláris permeabilitást és fokozza a negatív interstíciális nyomást (5). Tanaka és munkatársai szintén a nagy dózisú C-vitamin hatását vizsgálták súlyosan égett betegek esetében. Kimutatták, hogy az első 24 órában szignifikánsan csökkent a bevitt folyadékmennyiség, csökkent a lélegeztetett napok száma és javult a gázcsere. A testsúlynövekedés és az ödéma is kisebb volt a kontroll csoporthoz képest (6).
A szelén státusz égést követő károsodásának következtében csökken a szelén-függő glutation peroxidáz (GPx) aktivitása is, így fokozódik az oxidatív stressz kialakulásának veszélye, csökken az immunvédelem és gyulladás alakul ki. Az amúgy is alacsony szelén bevitelű európai emberek égési sérülése esetén szükséges lehet a korai szelén pótlás, mely csökkenti az infekciós komplikációkat, valamint segíti a sebgyógyulást (7).
A NAC egyike a legszélesebb körökben vizsgált anyagoknak, mely prekurzora a glutationnak és gyökfogóként is szerepet játszik. Reakcióba lép a hidroxil gyökkel és a hidrogén peroxiddal, sőt újratölti a leukocitákban a glutation raktárakat, ennek eredménye az oxigén szabadgyökök detoxifikációja. Endotoxémiában is hatékony, csökkenti a neutrofilok adhézióját és aggregációját, a pulmonáris hipertenziót és a vaszkuláris permeabilitást (8). Védelmet jelent az iszkémia-reperfúziós károsodásokban, gátolja a citokin expressziót, a molekula adhéziót, és az NF-ęB aktivációt. Állatkísérletben égést követően az N-acetil-cisztein (NAC) kezelés hatékonynak bizonyult a mukóza barrier védelmében (9). Égést követően patkányok tüdőszövetében a NAC kezelés szignifikánsan csökkentette a plazma malondialdehid (MDA), és fokozta a redukált glutation (GSH) szintet, mely feltételezések szerint vagy a NAC általi csökkent GSH degradációnak, vagy a fokozott szintézisnek volt a következménye (10). Légúti égést szenvedett felnőttek esetében alkalmazott NAC terápia során viszont nem találtak szignifikáns különbséget a klinikai (halálozás, kórházi tartózkodási napok száma) és a tüdő paraméterek (lélegeztetett napok száma, PaO2/FiO2 arány) szerinti kimenetelben (11).
Nincs még egyértelmű vélemény arról, hogy melyik antioxidáns a legmegfelelőbb az égett betegek terápiája során, illetve, hogy hatásos-e ezen szerek kombinációban való használata gyulladásgátló gyógyszerekkel együtt (3). A klinikai rutinban egyelőre a C és E vitamin rutinszerű alkalmazása terjedt el.
Jelen tanulmányunk célja a kiegészítő antioxidáns kezelésként alkalmazott NAC pro- és antioxidáns státuszra, valamint a fehérvérsejtek aktivációjára gyakorolt hatásának vizsgálata volt a csak standard folyadékterápiában részesült betegekkel szemben az égési traumát követő első héten.
Beteganyag és módszer
Betegeink
Vizsgálatunkba - a regionális etikai bizottság engedélyét követően, a betegek vagy legközelebbi hozzátartozójuk írásbeli engedélye alapján - eddig 16 beteget vontunk be. A betegek 2007 és 2008 között kerültek felvételre az a PTE Klinikai Központ Aneszteziológiai és Intenzív Therápiás Intézetébe. Bevételi kritérium a testfelület legalább 20 %-át meghaladó égési sérülés, a betöltött 18. életév, valamint a sérülés utáni első három órában intézetünkben megkezdett folyadékterápia volt. Kizárási kritérium volt az elektromos eredetű égési sérülés, a krónikus vese- és szívelégtelenség, a 72 órán belül kialakult akut veseelégtelenség és a 18 év alatti életkor. Betegeinket két csoportra osztottuk. Az első csoportban (n=8) standard folyadékterápiát alkalmaztunk az intratorakális vérvolumen index (ITBVI) alapján, melyet a második csoportban (n=8) NAC kezeléssel egészítettünk ki (150 mg/ttkg bólus, utána 12 mg/ttkg/óra folyamatos infúzió). A csoportokban mért adatokat egymáshoz, valamint egészséges önkéntesekhez (n=9) viszonyítva értékeltük. A két csoport betegeinek kora és égett testfelületük nagysága között nem volt szignifikáns különbség.
A betegektől vénás vérmintát vettünk közvetlenül a kórházi felvétel után, majd az ezt követő öt napon át naponta, amiből meghatároztuk a fehérvérsejt számot, a granulociták, a limfociták és monociták százalékos arányát. Az oxidatív stressz paraméterei közül mértük a MDA koncentrációt, a mieloperoxidáz (MPO) enzim aktivitását, valamint a teljes vér stimulált szabadgyök termelését (ROS). Az endogén antioxidánsok közül pedig meghatároztuk a plazma SH (PSH) csoport szintjét, a teljes vér redukált glutathion (GSH) koncentrációját, valamint SOD és kataláz (KAT) enzimek aktivitását. A malondialdehid a többszörösen telítetlen zsírsavak oxidatív károsodása során keletkezik, ezáltal a lipidperoxidáció fontos markere. Mérése Ohakawa módszerével történt (12). Alvadásában EDTA-val (etiléndiamin-tetraecetsav) gátolt vért 4000-es fordulatszámon 10 percig centrifugáltuk. A plazmához 0,2%-os nátrium-dodecil-szulfátot, Na-acetát-puffert (pH: 3,5) és 200 µMEDTA-t adtunk, majd az elkészített keveréket 0,67%-os tiobarbitursav oldattal egy órán keresztül 90 oC-on inkubáltuk. Az oldat lehűtése után butanolt adtunk a keverékhez és 10 percig 5000-es fordulatszámmal 4 oC-on centrifugáltuk. A felülúszót spektrofotométerrel 535 nm-es hullámhosszon mértük. Kalibráló sorként tetrametoxipropánt használtunk, a MDA értékét µM/l-ben fejeztük ki. Az egészséges populáció átlagos értéke: 0,16 (0,12-0,24) micromol/l.
A mieloperoxidáz lizoszomális enzim, mely megtalálható a neutrofil graulocitákban és szérumszintje rendszerint megemelkedik gyulladásos állapotokban. A plazma MPO-szintjének meghatározásakor 200 µl plazmát adtunk a következő keverék 1ml-éhez (10,9 ml Na-citrát, 100 µl o-dianisidin, 1ml H2O2 és 5 µl 0.05% Triton-x-100). Az összeöntést követően az elegyet 5 percig 37 şC-on inkubáltuk. 1 ml 35%-os perklórsav hozzáadását követően az oldatot 10 percig centrifugáltuk 2500-as fordulatszámon, majd ezt követően fotometriás mérést végeztünk 560 nmes hullámhossznál. Az egészséges populáció átlagos értéke: 0,26 (0,20-0,35) BE/ml.
A ROS-termelődés vizsgálata teljes vérben: az aktivált leukociták, elsősorban a neutrofilek, a szabadgyökök potenciális forrásai a gyulladásos folyamatok során. A keringő leukociták gyöktermelő képességére a teljes vér indukált gyöktermelése alapján vonhatunk le következtetéseket. A kemilumineszcenciás mérés alapját a luminol szabadgyökökkel való reakciója adja. A meghatározást a mérőműszer gyártója által megadott előírás szerint végeztük. 20 µl Na-citráttal antikoagulált vért 1400 µl 37 şC-os DMEM (Dulbecco's modifikált Eagle's médium) tápláló oldattal hígítottunk, hozzáadtunk 50 µl 0,01%-os luminolt és a küvettát azonnal a lumiaggregométerbe helyezzük (Chrono-Log, Model 560, USA). Az esetleges spontán gyöktermelés mérését követően 30 µl PMA-t (forbol-12-mirisztát-13-acetát, Sigma, USA) mértünk a küvettába. Az oldatot a mérés alatt folyamatosan kevertük és 37 şC-on tartottuk. A fény kibocsátás változását regisztráltuk (Chrono-Log, Model 707, USA), és a felvett görbéből meghatároztuk a gyöktermelés fehérvérsejt számra vonatkoztatott maximumát, és a PMA stimulációtól a gyöktermelés elindulásáig eltelt időt, az úgynevezett indukciós időt. A gyöktermelés normál értékei: maximum: 34,0 (30,0-42,0), meredekség: 0,048 (0,038-0,056) AU, indukciós idő: 415 (380-470) sec.
A plazma szulfhidril-csoportok szintje túlnyomóan plazmafehérjékből származik, melyek részt vesznek a szervezet oxidatív stressz elleni védekezésében. A SH-csoportok méréséhez 100 µl plazmát, 100 µl El Ellman-reagenst (1 mM/l koncentraciojú, metanolban oldott DTNB) es 800 µl El EDTA-t tartlmazó TRIS-puffert kevertünk össze es 412 nm-es hullámhosszon fotometráltuk. A kalibrációhoz standard PSH-oldatokat használtunk, a PSH-t µM/l-ben adtuk meg. Az egészséges populáció átlagos értéke: 52,8 (51,0- 58,0) micromol/l (13). A redukált gluthation az egyik legfontosabb endogén antioxidáns, melynek szintje oxidatív stressz során csökken. A GSH mérése során 0,2 ml EDTAval antikoagulált vért 0,8 ml desztillált vízzel hidrolizáltunk, majd 4 ml 10%-os koncentrációjú TCA-val (triklóresetsav) összekevertük. Centrifugálást követően 2 ml felülúszóhoz 4 ml 8,7-es pH-jú TRIS-puffert (Tris[hidroximetil]- aminometán) adtunk. A színreakciót 100 µl 10 mM-os DTNB (5,5'-ditio-bis[2-nitrobenzosav] - Ellman reagens) hozzáadásával hoztuk létre, majd 412 nm-es hullámhosz- szon fotometráltuk. A kalibráláshoz standard GSH-oldatokat használtunk, az eredményeket µM/l-ben fejeztük ki. Az egészséges populáció átlagos értéke: 806 (780-830) micromol/l (13).
A szuperoxid dizmutáz az endogén enzimatikus antioxidáns rendszer részét képezi. Aktivitásának meghatározásához 100 µl EDTA-val antikoagulált vért 900 µl desztillált vízzel hemolizáltunk, majd etanol és kloroform 2:1 arányú keverékével centrifugálással (4 oC, 5 perc, 1300-as fordulatszám) távolítottuk el a hemoglobint. Az enzimaktivitás meghatározása az adrenalin adrenokróm spontán oxidáció gátlásán alapul. Spektrofotometriás méréseket 480 nm-os hullámhosszon végeztünk, kontrollként nátrium-karbonát-puffert (pH 10,2) használtunk, a SOD-enzim aktivitását L-adrenalin hozzáadásával (16,48 mg adrenalin 10 ml 0,1 N sósavban) mértük és IU/ml-ben adtuk meg. Az egészséges populáció átlagos értéke: 780 (750-820) IU/ml (14).
A H2O2-t a kataláz enzim bontja le a szervezetben vízre és oxigénre, így gátolja a H2O2 toxikus metabolitokká alakulását. A kataláz enzim szerepe a megemelkedett hidrogénperoxid szinttel járó állapotokban kifejezett. A kataláz aktivitását 100 µl EDTA-val antikoagulált vérből határozzuk meg 900 µl fiziológiás sóoldattal történt kimosás után. A minta centrifugálása után megismételtük a mosási eljárást. 37 şC-on, 240 nm-es hullámhosszon vizsgáltuk a minta fényelnyelését a hozzáadott foszfát puffer, 10 µl vörösvértest és 30 mM H2O2 után. Az egészséges populáció átlagos értéke: 1531 (1420-1756) BU/mL.
Statisztika
Statisztikai analízisünk során Mann-Whitney tesztet és Kruskal Wallis próbát használtunk. Adatainkat mint átlagot és interkvartilis tartományt (25 és 75 százalék) tüntettük fel. A túlélésben megmutatkozó különbség szignifikáns voltát chi-négyzet teszttel vizsgáltuk. A végső mintaméret meghatározására power analízist végeztünk.
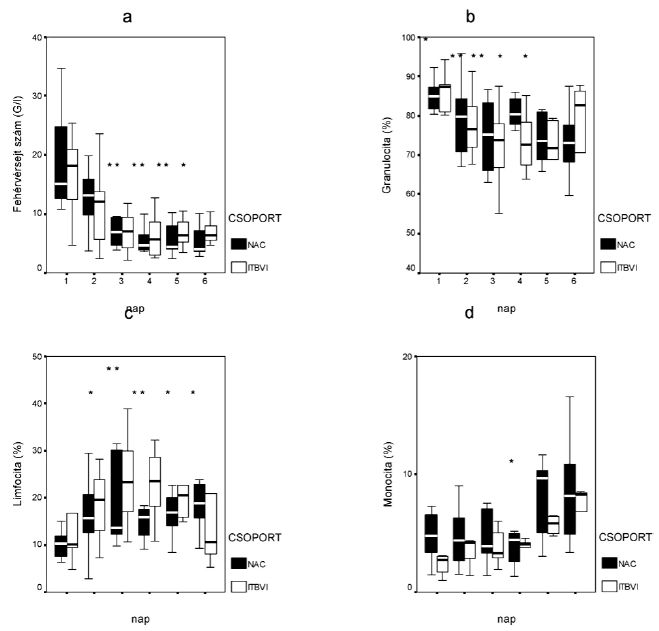
1. ábra:
Fehérvérsejtszám (a), a keringő granulociták (b), limfociták (c), monociták (d) aránya a két betegcsoportban. A kockák a csak ITBVI kezelt, a körök a kiegészítő NAC kezelésben részesült betegek eredményeit jelölik. Szignifikáns különbség: * = p<0,05 az első naphoz viszonyítva, # = p<0,05 a csak ITBVI kezelt és a kiegészítő NAC kezelésben részesült betegek között.
Eredmények
A fehérvérsejtek abszolút és relatív százalékos aránya
Felvételkor az égett betegek mindkét csoportjánál jelentős leukocitózis jelentkezett, mely a harmadik naptól kezdve szignifikánsan csökkenve mindkét csoportban normalizálódott (1/a. ábra). A két csoport között nem mutatkozott szignifikáns különbség. A mindkét csoportban megfigyelhető jelentős granulocitózis a harmadik napig csökkent (1/b. ábra). A standard terápiában részesült betegek esetében ez a csökkenés a 3. és 4. napon szignifikáns mértékű volt, majd ismét fokozatosan emelkedett. A kiegészítő NAC kezelést kapott betegek esetében végig szignifikáns csökkenés volt megfigyelhető a negyedik nap átmeneti emelkedésétől eltekintve. A két csoport között nem volt kimutatható szignifikáns különbség. Az égési trauma a granulocitózissal egyidejűleg jelentős limfocitopéniát idézett elő a betegekben (1/c. ábra). Ezt követően a limfociták %-os aránya a standard kezelésben részesült betegcsoportban a harmadik napig emelkedett, majd újra csökkent, és értéke a 3., 4. napon szignifikánsan magasabb volt a kiinduláshoz képest. A kiegészítő NAC kezelésben részesültekben alacsonyabb szintről ugyan, de szignifikáns emelkedés volt megfigyelhető. A monociták %-os aránya az ITBVI csoportban folyamatosan emelkedett (1/d. ábra). Ez az emelkedés az 5. napon szignifikáns mértékű volt. A kiegészítő NAC kezelésben részesült betegekben a 3. napon jelentős emelkedés, a negyediken pedig csökkenés jelentkezett, melyet az ötödik, hatodik napon ismételt emelkedés követett. A két csoport között szignifikáns különbség nem mutatkozott.
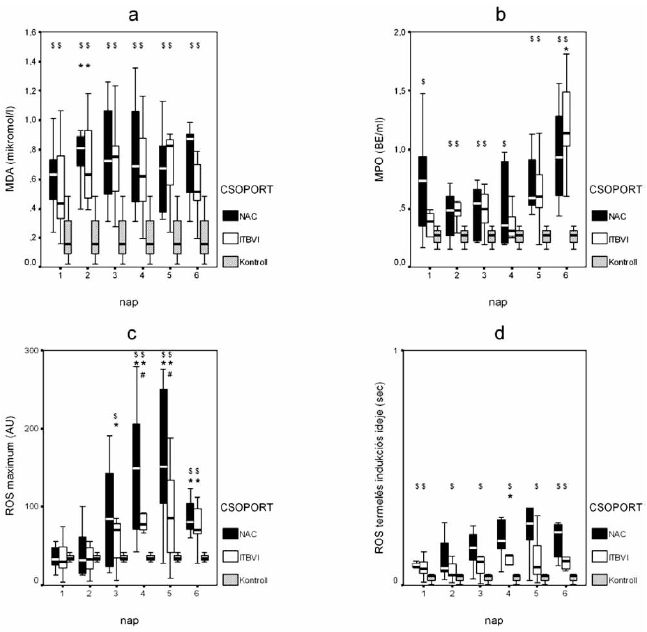
2. ábra:
A plazma malondialdehid (MDA) koncentrációjának (a), a mieloperoxidáz (MPO) enzim aktivitásának (b), teljes vér indukált szabadgyök termelés (ROS) maximumának (c), és a gyöktermelés indukciós idejének (d) alakulása a két beteg csoportban. A kockák a csak ITBVI kezelt, a körök a kiegészítő NAC kezelésben részesült betegek eredményeit jelölik. Szignifikáns különbség: * = p<0,05 az első naphoz viszonyítva, $=p<0,05 az egészséges kontroll csoporthoz képest, # = p<0,05 a csak ITBVI kezelt és a kiegészítő NAC kezelésben részesült betegek között.
Prooxidáns paraméterek
A plazma MDA szintje a vizsgálat teljes ideje alatt mindkét betegcsoportban szignifikánsan magasabb volt, mint az egészségesekben mért érték (2/a. ábra). A felvételkor mért egyébként is magas szint a 2. napra mindkét betegcsoportban szignifikánsan tovább emelkedett. Bár az átlagos érték a kiegészítő NAC kezelésben részesült betegekben az első 5 nap alatt a standard csoport értékénél alacsonyabb volt, a két csoport között szignifikáns eltérés nem volt kimutatható. A MPO enzim aktivitása a kiegészítő NAC kezelésben részesült betegekben a vizsgálat teljes ideje alatt, míg a standard módon kezelt csoportban a 2., 3., 5. és 6. napon szignifikánsan magasabb volt, mint az egészségesekben (2/b. ábra). Feltűnő volt mindkét csoport esetében az 5. és 6. napon mutatkozó jelentős emelkedés, mely a standard csoportban a 6. napon szignifikáns volt a felvételkor mért értékhez viszonyítva. A két csoport között szignifikáns eltérés nem mutatkozott. A teljes vér indukált gyöktermelésének maximális értéke mindkét betegcsoportban az egészségesekben mért tartományban volt a vizsgálat első 2 napján, majd a harmadik naptól kezdve mindkét betegcsoportban jelentősen megemelkedett (2/c. ábra). Ez az emelkedés a 3. naptól kezdve mind a felvételkor mért, mind pedig az egészséges populáció értékéhez képest mindkét csoportban szignifikáns mértékű volt. A kiegészítő NAC kezelésben részesült betegekben a 3. naptól mért emelkedés meghaladta a standard terápia alapján kezelt betegekben mért értékeket, és ez a különbség a 4., 5. napon szignifikáns mértékű volt. Az indukált gyöktermelés indukciós fázisa a standard csoportban a vizsgálat teljes ideje alatt, míg a kiegészítő NAC kezelésben részesült betegekben a 1. és 6. napon szignifikánsan hosszabb volt az egészségesekben mért értéknél (2/d. ábra). A standard folyadékterápiával kezelt betegek esetében a 4. napig emelkedő, majd ezt követően enyhén csökkenő tendencia mutatkozott, a 4. napon pedig szignifikánsan meghaladta a felvételkor mért értéket.
A kiegészítő NAC kezelésben részesült betegekben csak enyhe emelkedő tendencia volt megfigyelhető. A két csoport között szignifikáns eltérés nem mutatkozott.

3. ábra:
A plazma szulfhidril csoportok szintjének (a), a hemolizátum redukált glutathion koncentrációjának (b), a szuperoxid dizmutáz enzim (c) és a kataláz enzim (d) aktivitásának alakulása a két beteg csoportban. A kockák a csak ITBVI kezelt, a körök a kiegészítő NAC kezelésben részesült betegek eredményeit jelölik. Szignifikáns különbség: * = p<0,05 az első naphoz viszonyítva, $=p<0,05 az egészséges kontroll csoporthoz képest, # = p<0,05 a csak ITBVI kezelt és a kiegészítő NAC kezelésben részesült betegek között.
Endogén antioxidánsok
A plazma SH csoport szintje a standard kezelésben részesült betegeknél a vizsgálat ideje alatt végig alacsonyabb volt (3/a. ábra). Az észlelt folyamatos, lassú csökkenés a 3. naptól volt szignifikáns a felvételkor mért értékekhez viszonyítva, illetve a 2. naptól szignifikánsan alacsonyabb értékű volt, mint az egészségesekben mért érték. A kiegészítő NAC kezelésben részesült betegekben a PSH érték a felvételt követő napon megemelkedett, majd fokozatosan csökkent, de csak a vizsgálat 5. és 6. napján volt szignifikánsan alacsonyabb értékű, mint az egészségesekben. A kiegészítő NAC kezelésben részesült betegekben mért PSH érték a vizsgálat teljes időtartama alatt magasabb volt a standard kezelésben részesült betegekben mértnél, és a két csoport közötti különbség a 2. és 6. napon volt szignifikáns. A betegek felvételekor a hemolizátumban mért GSH érték mindkét betegcsoportban - a NAC kezelteknél szignifikáns mértékben - meghaladta az egészségesekben mért értéket (3/b. ábra). Ezt követően mindkét betegcsoportban szignifikánsan csökkent, és a standard kezelésben részesült betegeknél az 5. napra az egészségesekben mért értékhez képest szignifikánsan alacsonyabb volt. A kiegészítő NAC kezelésben részesült betegekben a GSH a 3. naptól már kis mértékben ismét emelkedett, és a két csoport között az 5. napon mutatkozott szignifikáns különbség. A SOD enzim aktivitása mindkét betegcsoportban, időben ingadozó értéket mutatva az egészségesekben mért szint alatt volt (3/c. ábra). A két csoport eredményei között szignifikáns eltérés nem mutatkozott. A SOD enzim változásával ellentétben a kataláz enzim aktivitása mindkét betegcsoportban szignifikánsan meghaladta az egészségesekben mért szintet (3/d. ábra). A standard módon kezelt betegek esetében értéke folyamatosan emelkedett. A NAC kezeltek esetében az átmeneti csökkenést a harmadik napon jelentős emelkedés, ezt pedig fokozatos csökkenés követte. A két csoport között nem mutatkozott szignifikáns különbség.
Megbeszélés
Az aerob metabolizmus során az oxigén szabadgyökök folyamatosan képződnek, és jelenlétük elengedhetetlen számos enzim működéséhez és különböző mediátorok felszabadulásához. Az úgynevezett patológiás szabadgyökös reakciók során azonban a reaktív szabadgyökök száma megsokszorozódik, és a közömbösítésükhöz rendelkezésre álló endogén antioxidáns védőrendszer kapacitása már nem elegendő (1). A fokozott gyöktermelés, vagy az antioxidáns mechanizmusok elégtelen működése következtében súlyos károsodásokat okozó állapot, az "oxidatív stressz" alakulhat ki.
Az oxigén szabadgyökök számos betegség patogenezisében - mint az iszkémiás reperfuziós károsodások, kardiovaszkuláris kórképek, vérzéses shock, ateroszklerózis, hipertenzió, politrauma - jelentős szerepet játszik (15, 16, 17, 18). Az égés által kiváltott oxidatív stresszt számos tanulmány leírta (19, 20, 21, 22). A vizsgálatok időtartama 24 óra és 30 nap között változott, azonban a követési periódus hosszától függetlenül minden vizsgálat a pro- és antioxidáns egyensúly jelentős, és tartós kisiklását igazolta égett betegekben.
A szabadgyökök kimutatása nehézkes, nagyon rövid féléletidejük miatt, ezért az általuk indukált folyamatok mértékére, általában a lipidperoxidációs végtermékek szintjéből, illetve a szervezet endogén antioxidáns kapacitásából, az antioxidáns enzimek aktivitásának méréséből következtetnek. Jutkiewicz-Sypniewska és munkatársai égett gyermekeken vizsgálták az oxidatív stressz alakulását. Az első, második, harmadik, hetedik és huszonegyedik napon mérték a totál antioxidáns kapacitás (TAC) és a TBARS (MDA) szintjének alakulását vörösvértestekben (23). Eredményeinkhez hasonlóan csökkent TAC és emelkedett TBARS szintet találtak a teljes vizsgálati periódus alatt. Bertin-Maghit és munkatársai az égési sérülést követő első öt napon vizsgálták az oxidatív stressz alakulását, melyben a szérum szelénium és az antioxidáns vitaminok szintjének csökkenését, valamint a TBARS jelentős emelkedését találták (20). Pintaudi és munkatársai felvételkor szignifikánsan emelkedett MDA szintet mértek, mely később gyorsan csökkenő tendenciát mutatott, de a harminc napos vizsgálati periódus alatt végig emelkedett maradt (22). Ezekhez az eredményekhez hasonlóan, a vizsgálatunk teljes időtartama alatt, szignifikánsan emelkedett MDA szintet mértünk.
A szabadgyök termelődésének egyik fő forrását patológiás állapotokban, így égésben is a neutofil granulociták NADPH-oxidáz rendszere képezi (2). A keringő granulociták érzékenyített állapota stimulált szabadgyöktermelésük in vitro mérésével jellemezhető. Beteganyagunkban a PMA-val stimulált szabadgyök termelés a teljes vérben nem tért el jelentősen a kontroll csoporttól a felvételkor és az azt követő napon. Ennek hátterében a neutrofil granulociták gyors kitapadása állhat (24). Patkányban végzett kísérlet során 15 perccel a sérülés után a leukociták gördülését és kitapadását figyelték meg intravitális fluorescensz mikroszkóppal az intestinális venülákban, ugyanakkor a keringő leukocyták ROS termelése csökkent volt (25). Kísérletes adatok szerint az égési sérülés megbontja o-neutrofil granulocita termelés és kibocsájtás egyensúlyát a csontvelőben. A fehérvérsejt kibocsátás meghaladja a fevérvérsejt termelődés mértékét, ami a neutrofil granulocita raktár átmeneti kimerülését idézi elő. A későbbiekben azonban újra helyreáll az egyensúly. Letális égési sérülés esetén a kibocsátás végig meghaladja a termelődést, ami a csontvelő neutrofil termelő képességének csökkenése miatt is a csontvelői neutrofil készlet teljes kimerüléséhez vezet (26). Ezek az adatok magyarázatul szolgálhatnak arra az általunk talált tényre, hogy a keringő granulociták szabadgyök termelése nem mutatott emelkedést az első két napon. Ugyanakkor a plazma MPO aktivitása megemelkedett az égési traumát közvetlenül követően, majd kifejezetten a vizsgálat 5. és 6. napján, ami a szintén jelentős mértékű perifériás neutrofil kitapadásra utal (27).
Az égés által emelkedett szabadgyöktermelés és lipidperoxidáció jelentős változásokat hozott létre az antioxidáns státuszban is. A plazma PSH szintje folyamatosan és szignifikánsan csökkent a kezelés második napjától kezdve az egészséges önkéntesekhez képest. Eredményünk alátámasztja Bertin-Maghit és munkatársai megfigyelését (20). A teljes vér GSH koncentrációja meghaladta a kontroll csoportét a felvétel időpontjában. Ennek oka lehet, hogy a GSH stressz hatására fokozott mértékben szabadul fel a szervezet raktáraiból, így elsősorban a májból. A második naptól a GSH koncentráció szignifikánsan csökkent a felvételkori értékhez képest, de nem különbözött jelentősen a kontroll csoporthoz viszonyítva. E minimális eltérés hátterében az a tény állhat, hogy a szervezet megpróbálja aktív szabályozás révén a GSH-t a normál tartományban tartani (20).
A SOD enzim aktivitása mérsékelt volt a normál tartomány alatt vizsgálatunkban. E megfigyelés összecseng Saitoh és munkatársai eredményével (28), viszont ellentmond Bertin-Maghit és munkatársainak adataival (20), akik enyhén emelkedett SOD aktivitást mértek égési sérülést követően. Kisérletes adatok (29) és tanulmányunk adatai szerint, a kataláz enzim aktivitása enyhén emelkedett égési traumát követően a hatnapos megfigyelési periódus alatt.
Tanulmányunkban a kezdeti magasabb fehérvérsejt szám mindkét csoport esetében normalizálódott ugyan a harmadik napra, azonban a NAC kezelés nélküli csoportban később kis mértékben ismét emelkedett. A kifejezett granulocitózis és limfocitopénia fokozatosan javult a NAC csoportban, míg a csak ITBVI alapján kezelteknél ismét fokozódott a 4. naptól, tehát a NAC kezelés kedvezőnek mutatkozott e gyulladásos markerek vonatkozásában.
Meglepő eredménye volt tanulmányunknak, hogy a teljes vér indukált gyöktermelése a kiegészítő NAC kezelés hatására a 3. naptól jelentősen megemelkedett, azaz a NAC kezelés fokozta a fehérvérsejt aktivációt. Ezt a plazma MPO enzim aktivitásának emelkedése is igazolta. Sadowska vizsgálata szerint az in vitro NAC kezelés csak a terápiásnál jóval nagyobb koncentrációban volt képes csökkenteni a neutrofil aktivációt (30). Ennek alapján nem meglepő, hogy esetünkben a NAC kezelés nem csökkentette a gyöktermelést, de az emelkedésre mindez nem nyújt magyarázatot.
Égést követően patkányok tüdőszövetében a NAC kezelés szignifikánsan csökkentette az MDA szintet 1 és 24 órával az égési sérülést követően, és szignifikáns GSH emelkedést hozott létre a 24. órában (10). Ezzel ellentétben, a tanulmányunkban a betegek vérmintáiban az MDA szint csak kis mértékben csökkent a NAC kezelés hatására, és a GSH is csak az 5. napon volt szignifikánsan magasabb az antioxidáns kezelésben nem részesültekkel összehasonlítva. Ugyanakkor a NAC kezelés kifejezetten megemelte a plazma szulfhidril csoportok szintjét, és a glutation szint is hamarabb normalizálódott. A NAC terápiában részesülteknél azonban a többlet SH csoport ellenére a PSH sem emelkedett az egészségesek értékei fölé a terápia előrehaladtával. A kiegészítő NAC kezelés ugyanakkor nem befolyásolta sem a SOD, sem pedig a kataláz enzimek aktivitásának alakulását.
A fenti eredményekből megállapítható, hogy az égési sérülést szenvedett betegek NAC kezelése jelentősen javítja a szervezet endogén, nem enzimatikus antioxidáns szintjét, azonban nincs hatással az enzimatikus antioxidánsok aktivitására, és nem csökkenti az oxidatív stresszt jelző prooxidáns paraméterek szintjét. Váratlan eredménye vizsgálatunknak az, hogy NAC antioxidáns terápia mellett a keringő fehérvérsejtek aktiválódása, szabadgyök termelő képességük szignifikánsan fokozódik.
Vizsgálatunkban a két csoport betegeinek kora és az égett testfelület nagysága között nem volt jelentős különbség, viszont az antioxidáns terápiában részesült betegek magasabb túlélési arányt mutattak. Vizsgálatunk értékét, értékelhetőségét az alacsony betegszám kétségtelenül rontja, ennek ellenére feltűnő, hogy az égési sérülés hasonló kiterjedése ellenére a kiegészítő NAC kezelésben részesült betegek 37%-a, míg anélkül 63%-a halt meg a trauma következtében (Az elvégzett chi-négyzet teszt alapján nincs szignifikáns különbség a két csoport között.). Bár az égési traumát követő általunk vizsgált 6 napos időtartamban az égett betegekben általában még nem mutatkoztak a szepszis jelei, a súlyos szepszisben szenvedő betegek túlélésének tekintetében hasonló eredményt mutatott Emet és munkatársainak megfigyelése is, ami szerint a NAC terápiában részesült betegek esetében a halálozás 26%, míg a kontroll csoportban 31% volt (31). Holt és munkatársai szintén alacsonyabb halálozást mutattak a NAC-nel kezelt légúti égést szenvedett betegekben (20%) a NAC-nel a nem kezeltekkel szemben (24%) (31).
Következtetések
Klinikai vizsgálatunkban az égési trauma indukálta oxidatív stressz mértékére mind a prooxidáns, mint pedig az antioxidáns markerek párhuzamos méréséből kívántunk következtetni. Összefoglalva megállapítható, hogy a vizsgált betegek alacsony száma mellett szignifikáns különbség a kiegészítő NAC terápiában részesült és a nem kezelt betegcsoportok között csak a plazma szulfhidril csoportok és a GSH szint tekintetében mutatkozott. Ennek ellenére a mielőbb megkezdett kiegészítő antioxidáns terápia fontosnak bizonyult az égett betegek túlélését illetően. Előzetes eredményeink alapján indokoltnak tűnhet egy prospektív, randomizált tanulmány elvégzése a kiegészítő NAC kezelés klinikai hasznának, hatékonyságának eldöntésére, melybe 30 - 30 beteg bevonása szükséges.
Irodalom
- Parks D. A., Granger O. N.: Oxigen-derived radicals and ischemia-induced tissue injury. In: Greenwald RA. Choen G. (eds). Oxyradicals and their scavenger systems. Cellular and medical aspects. 1983: Vol II. 135.
- Horton J. W.: Free radicals and lipid peroxidation mediated injury in burn trauma: the role of antioxidant therapy. Toxicology 2003; 189: 75-88.
- Parihar A., Parihar M. S., Milner S., Bhat S.: Oxidatíve stress and anti-oxidatíve mobilization in burn injury. Burns 2008; 34: 6–17.
- Dubick M. A., Williams C., Elgjo G. I., Kramer G. C.: High-dose vitamin c infusion reduces fluid requirements in the resuscitation of burn-injured sheep. Shock 2005; 24: 139-144.
- Matsuda T., Tanaka H., Shimazaki S., Matsuda H., Abcarian H., Reyes H., Hanumadass M.: High dose vitamin C therapy for extensive deep dermal burns. Burns 1992; 18: 127-131.
- Tanaka H., Matsuda T., Miyagantani Y., Yukioka T., Matsuda H., Shimazaki S.: Reduction of Resuscitation Fluid Volumes in Severely Burned Patients Using Ascorbic Acid Administration. Arch Surg. 2000; 135: 326-331.
- Sandre C., Agay D., Ducros V., Faure H., Cruz C., Alonso A., Chancerelle Y., Roussel A.: Kinetic Changes of Oxidatíve Stress and Selenium Status in Plasma and Tissues following Burn Injury in Selenium-Deficient and Selenium-Supplemented Rats. J Trauma. 2006; 60: 627– 634.
- Akca T., Canbaz H., Tataroglu C., Caglikulekci M., Tamer L., Colak T., Kanik A., Bilgin O., Aydin S.: The Effect of N-Acetylcysteine on Pulmonary Lipid Peroxidation and Tissue Damage. Journal of Surgical Research 2005; 129: 38–45.
- Ocal K., Avlan D., Cinel I., Unlu A., Ozturk C., Yaylak F., Dirlik M., Camdeviren H., Aydi S.: The effect of Nacetylcysteine on oxidatíve stress in intestine and bacterial translocation after thermal injury. Burns 2004; 30: 778–784.
- Konukoglu D., Cetinkale O., Bulan R.: Effects of Nacetylcysteine on lung glutathione levels in rats after burn injury. Burns 1997; 23: 541-544.
- Holt J., Saffle J., Morris S., Cochran A.: Use of Inhaled Heparin/N-acetylcystine in Inhalation Injury: Does it help?. Journal of Burn Care & Research 2008; 192-195.
- Ohakawa H. N., Okishi N., Yagi K.: Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem 1979;95:351-8.
- Sedlak J., Lindsay R. H.: Estimation of total proteinbound and non-protein sulphydryl groups in tissue with Ellman’s reagent. Anal Biochem 1968; 25: 192-205.
- Misra H. P., Fridovich I.: The role of superoxide anion in the antioxidation of epinephrine and a simple assay for superoxide dismutase. J Biol Chem 1972; 27: 3170- 5.
- Boili R.: Oxygen-derived free radicals and myocardial repertusion injury: An overview. Cardiovasc Drugs Ther. 1991; 5: 249·268.
- Bridges A. B., Scott N. A., Pronge T. H., McNeill G. P., Belch J. J. F.: Relationship between the extent of coronary artery disease and indicators of free radicals activity. Clin Cardiol 1992; 15: 169-174.
- Henning B., Chow C. K.: Lipid peroxidation and endothelial cell injury implications in atherosclerosis. Free Radical Biol Med 1988; 4: 99-106.
- McCord J. M., Fridovich I.: The biology and pathology of oxygen radicals. Ann Med 1982; 89:122. Keel M, Trentz O. Pathophysiology of polytrauma. Injury 2005; 36: 691-709.
- Roth E., Manhart N., Wessner B.: Assessing the antioxidative status in critically ill patients. Current Opinion in Clinical Nutrition and Metabolic Care 2004; 7:161–168.
- Bertin-Maghit M., Goudable J., Dalmas E., Steghens J. P., Bouchard C., Gueugniaud P. Y., Petit P., Delafosse B.: Time course of oxidative stress after major burns. Intensive Care Med 2000; 26: 800-803.
- Ritter C., Andrades M., Guerreiro M., Zavaschi L., Gelain D. P., Souza L. F., Ribeiro C. A., Clausell N., Menna-Barreto S., Moreira J. C, F., Dal-Pizzol F.: Plasma oxidative parameters and mortality in patients with severe burn injury. Intensive Care Med 2003; 29: 1380–1383.
- Pintaudi A. M., Tesoriere L., D’Arpa N., D’Amelio L., D’Arpa D., Bongiorno A., Masellis M., Livrea M. A.: Oxidative stress after moderate to extensive burning in humans. Free Radic Res. 2000; 33: 139-46.
- Jutkiewicz-Sypniewska J., Zembro-Lacny A., Pucha J., Szyszka K., Gajewski P.: Oxidative stress in burnt children. Adv Med Sci 2006; 51: 316-20.
- John F., Hansbrough A., Wikström T., Braide M., Tenenhaus M., Rennekampff O. H., Kiessig V., Bjursten L. M.: Neutrophil Activation and Tissue Neutrophil Sequestration in a Rat Model of Thermal Injury. J. Surg. Res 1996; 61: 17-22.
- Yoshida M., Wakabayashi G., Otani Y., Oshima A., Shimazu M., Kubota T., Kumai K., Kurose I., Miura S., Kitajima M.: Active oxygen species generation by circulating leukocytes and gastric submucosal microcirculatory disturbances in the early period after thermal injury. J Clin Gastroenterol. 1995; 21: 87-92.
- Rosinski M., Yarmush M. L., Berthiaume F.: Quantitative dynamics of in vivo bone marrow neutrophil production and egress in response to injury and infection. Ann Biomed Eng. 2004; 32:1108-19.
- Rana S. N., Li X., Chaudry I. H,, Bland K. I., Choudhry M. A.: Inhibition of IL-18 reduces myeloperoxidase activity and prevents edema in intestine following alcohol and burn injury. Journal of Leukocyte Biology. 2005; 77: 719-728.
- Saitoh D., Ookawara T., Fukuzuka K., Kawakami M., Sakamoto T., Ohno H., Okada Y.: Characteristics of plasma extracellular SOD in burned patient. Burns 2001; 27: 577–581.
- Leff J. A., Burton L. K., Berger E. M., Anderson O., Wilke C. P., Repine J. E.: Increased serum catalase activity in rats subjected to thermal skin injury. Inflammation 1993; 17: 199-204.
- Sadowska A. M., Manuel-y-Keenoy B., Vertongen T., Schippers G., Radomska-Lesniewska D., Heytens E., De Backer W. A.: Effect of N-acetylcysteine on neutrophil activation markers in healthy volunteers: in vivo and in vitro study. Pharmacol Res. 2006; 53: 216-25.
- Emet S., Memi D., Pamukçu Z.: The influence of Nacetyl- L-cystein infusion on cytokine levels and gastric intramucosal pH during severe sepsis. Critical Care 2004; 8: 172-179.
Dr. Földi Viktor
Pécsi Tudományegyetem,
Általános Orvostudományi Kar,
Aneszteziológiai és Intenzív Terápiás Intézet
7624 Pécs, Ifjúság útja 13.
Érbetegségek: 2009/2. 35-44. oldal