Napjainkban az őssejtek terápiás alkalmazása a biológia és az orvostudomány egyik leginkább kutatott és legígéretesebb területe. Az egyik lehetséges felhasználási módot a szívinfarktust követő őssejtbeültetés jelenti. Az új eljárás jelentőségét az adja, hogy az iszkémiás szívbetegség és ennek következtében kialakuló akut vagy krónikus szívelégtelenség incidenciája és prevalenciája, az egyre fejlődő terápiás eljárások és a megfelelő prevenciós módszerek ellenére is világszerte növekszik. Az ideális alkalmazási módszerre irányulóan a nemzetközi és hazai irodalomban egyaránt számos kísérletes és klinikai megközelítési módszer van jelen, de egységes, egyértelműen eredményes terápiás protokoll még nem alakult ki. Megválaszolásra vár az a kérdés is, hogy sejtszinten milyen típusú folyamatok zajlanak le a sérült szövet és az őssejtek között, azaz mi a hozzáadott sejtek hatásának mechanizmusa. A jövőbeli sikeres terápiás alkalmazáshoz szükséges a folyamat lépéseinek feltérképezése. Célkitűzésünk az volt, hogy kardiomioblasztokból álló sejttenyészetben iszkémiához hasonló állapotot létrehozva infarktust modellezzünk, és mezenhimális őssejtek hozzáadásával részleteiben vizsgálhassuk a sejtek között kialakuló folyamatokat és azok eredményét. Kísérleteink során H9c2 kardiomioblasztokból álló tenyészethez 2,5 óra időtartamú oxigén- és glükóz megvonás után egerekből származó mezenhimális őssejteket adtunk, majd a közös tenyészetet különböző sejtjelölő festékek segítségével mikroszkóp alatt vizsgáltuk. Az alkalmazott festékekkel lehetőségünk volt elkülöníteni egymástól a kardiomioblaszt- és őssejteket, valamint az iszkémia hatására elpusztult sejteket. Eredményeink alapján az őssejtek hozzáadása szignifikánsan javította a károsodott sejtek túlélését a kontrollhoz képest, és ezt a hatást az in vitro modellünkben a hozzáadott őssejtek közvetlen sejt-sejt kapcsolatok és intercelluláris nanotubulusok kialakításával hozzák létre.
Érbetegségek: 2011/1. 3-11. oldal
KULCSSZAVAK
szívinfarktus, csontvelői őssejt terápia, nanocsövek
Bevezetés
Világszerte évente 1-2 millióan halnak meg szívelégtelenség következtében, az 5 éves halálozás pedig meghaladja az 50%-ot. A szívelégtelenség hátterében a kardiomiopátiák, a szívizom gyulladásos betegségei, a hipertónia, a ritmus- és vezetési zavarok és az esetek nagy részében az iszkémiás szívbetegség áll. A miokardiális infarktus egyre eredményesebb kezelése jelenleg nem képes a károsodott myocardium funkciójának visszaállítására, ezért a betegek jelentős részében hosszú távon szívelégtelenség alakul ki. A funkcionális regenerációt létrehozó sejtalapú terápiák alkalmazása - kombinálva a konvencionális módszerekkel - jelentheti a jövőt ezen betegek kezelésében. A kutatások célja azon sejtek, főleg őssejtek és faktorok meghatározása, melyek képesek direkt vagy indirekt módon aktiválni az angiogenezist és szívizomsejtek képződését a sérülés helyén, ezáltal javítani a szív funkcionális működését [1-3].
Sejtalapú terápiák
A sejtalapú terápiák felosztása, csoportosítása nem egységes, hanem több szempont szerint is történhet: milyen típusú sejtekkel történik a kezelés, vagy milyen módon juttatják be az adott sejteket a sérült szervbe. A sejtalapú terápiák esetében a kezelések vagy őssejtekkel, vagy érett, differenciálódott testi sejtekkel történnek.
Alapjában véve két őssejt-típust különböztethetünk meg egymástól: az embrionális őssejteket és a felnőtt szervezetből származó őssejteket. Amíg az embrionális őssejtek szinte mindenféle sejttípussá képesek differenciálódni, hosszú idő után megújulni, és ezáltal minden szövetet, szervet létrehozni, addig a felnőtt szervezetből származó őssejtek már specifikusabbak, elkötelezettek egy bizonyos fejlődési irány felé, azaz ekto-, endo-, vagy mezodermális differenciáció útjára léptek, de ezen irányokon belül képesek különböző sejtvonalakká differenciálódni. Egy adott szöveten belül kevés található, képesek megújulni és specializálódni. Élettani szerepük a sérült sejtek, szövetek helyreállítása. A felnőtt szervezetben található őssejtek közül a csontvelői eredetű őssejtek (BMSC) karaktere a legtöbbet kutatott és leginkább ismert, a klinikai vizsgálatok többségében ezt a sejttípust alkalmazzák [4, 5]. A csontvelő a különböző progenitor sejtek komplex választékát tartalmazza, köztük vérképző őssejtek, úgynevezett "side population" sejtek, mezenhimális őssejtek és ezen belül multipotens felnőtt progenitor sejtek. A kísérleti eredmények azt mutatják, hogy a különböző csontvelői eredetű sejtek iszkémiával károsított szövetbe egyszerre beadva eltérő funkciókat látnak el a sérült szövet regenerációs folyamataiban.
Érett, differenciálódott testi sejtekkel történtek olyan klinikai vizsgálatok, amelyekben biopsziával vett vázizomsejteket növesztettek fel in vitro körülmények között, és ezeket a sejteket juttatták be az infarktusos területre. Előnyük ezeknek a sejteknek, hogy autológok, nem váltanak ki immunológiai reakciót. Bizonyos fokú funkcionális javulást sikerült ezekkel a sejtekkel is elérni, azonban ezek a sejtek nem voltak képesek megfelelően kapcsolódni a szívizomsejtekkel, ezért egyes esetekben aritmiát okoztak, további kutatásuk jelenleg is folyamatban van [6].
Hatásmechanizmus
A beültetett őssejtek feltételezett hatásmechanizmusa meglehetősen összetett, bonyolult folyamat. Három fő mechanizmust különböztetnek meg: a transzdifferenciációt, a parakrin hatásokat és a sejtfúziót. Emellett a legújabb kutatások beszámolnak még a közvetlen sejt-sejt kontaktus során bekövetkező citoplazma és organellum cseréről. Ezen folyamatok nem egymástól elszigetelten jelennek meg, hanem egymás hatását elősegítve zajlanak le, megoszlásuk valószínűleg az alkalmazott sejttípustól és a sérült rész mikrokörnyezeti tényezőitől függ. Differenciálódáson azt a jelenséget értjük, amikor egy őssejt vagy egy szöveti prekurzor sejt elkötelezi magát egy bizonyos sejtvonal felé. A transzdifferenciáció pedig azt jelenti, hogy egy nem őssejt egy másik sejttípussá transzformálódik, vagy egy már előzőleg differenciálódott őssejt az elkötelezettségével nem egyező sejteket hoz létre. A legfontosabbnak tartott mechanizmus jelenleg a parakrin faktorok hatása, vagyis a bejuttatott őssejtek szekretálhatnak olyan anyagokat, amelyek egyrészt "odavonzzák" a vérben keringő őssejteket és más sejteket, másrészt helyileg fokozzák az angiogenezist, anti-apoptotikus hatást fejtenek ki, és csökkentik a gyulladás mértékét, fokozzák a sejtek proliferációját, ezzel segítve elő a regenerációt [7]. Sejtfúziónak nevezzük, ha két különálló sejt összeolvad, létrehozva ezzel egy több magvú, nagyobb citoplazmával rendelkező sejtet. A sejtfúzió jelensége fiziológiás körülmények között is megfigyelhető akkor, amikor a szatellita prekurzor sejtek többmagvú izomsejteket hoznak létre. Az őssejtbeültetés során is kimutatták olyan sejteket, amely egy testi sejt és egy beültetett őssejt fúziójával jöttek létre [8]. A legújabb kutatások során megfigyelték, hogy immunsejtek, epiteliális progenitor sejtek és más sejtek között is ún. nanocsövek, nanotubulusok alakulnak ki. Ezek a csövek néhány 10 nm átmérőjűek, hosszuk több µm is lehet, bennük mitokondriumok és egyéb sejtorganellumok áramlását figyelték meg [9]. Abban az esetben, amikor az egyik sejt mitokondriumait elpusztították, és így a sejt anaerob respirációra kényszerült, a megmentő sejtekből mitokondriumok jutottak a sérült sejtekbe [10].
Sejtalapú terápiák alkalmazása a klinikai gyakorlatban
A miokardiális infarktus kezelésére az elmúlt évtizedben sok klinikai vizsgálat zajlott a legkülönbözőbb típusú őssejtekkel, ezen vizsgálatokat összesítve azt találták, hogy a bal kamrai ejekciós frakcióban a legjobb esetben néhány százalékos javulás volt kimutatható a kontroll csoporthoz képest, és a többi funkcióban sem találtak jobb eredményeket. Azonban az bebizonyosodott, hogy a csontvelői mezenhimális őssejt alapú terápiák biztonsággal használhatók, nem rejtenek veszélyeket [11]. Ezen eredmények tudatában számos kutató és orvos úgy gondolja, hogy először inkább a sejtek hatásmechanizmusát kell megfejteni, és csak azután folytatni a klinikai vizsgálatokat. Más szakembereknek azonban az a véleménye, hogy mivel nincsenek káros mellékhatásaik, ezért lehet folytatni a klinikai vizsgálatokat, és tovább keresni az optimális megoldásokat. A jövőben még számos kérdésre kell választ találni, hogy a sejtalapú terápiák biztonsággal használhatók legyenek. Meg kell határozni, hogy mennyi legyen az optimális sejtszám beültetéskor, fontos a sérült szerv vaszkularizációjának mértéke, és új metodikákat kell kidolgozni a beadott sejtek jelölésére, hogy nyomon lehessen követni őket implantáció után.
Célkitűzések
Fukahara és mtsai, illetve más kutatók is kimutatták in vitro kísérletekben, hogy csontvelői eredetű őssejtek szívizomsejtekké differenciálódnak, ha a két sejttípust együtt növesztik. A differenciáció abban az esetben következett be, ha a két sejttípus közvetlen sejt-sejt kapcsolatokat tudott egymással kialakítani. Ezek a kutatócsoportok normál, nem iszkémiás körülmények között vizsgálták a ko-kultúrákat [12-14]. Kajstura és mtsai in vivo iszkémiás kísérletekben bebizonyították, hogy csontvelői eredetű progenitor sejtek sejtfúzió nélkül szívizomsejtekké differenciálódnak, és ez funkcionális javulást eredményez 10 nappal a transzplantáció után. Orlic és mtsai szintén in vivo kimutatták, hogy a beültetett őssejtek 9 nap után szívizomsejtekké alakultak [4, 15]. Ezekben a kísérletekben több mint egy héttel a transzplantáció után vizsgálták az őssejtek regenerációs képességeit.
Ezekre a már korábban kivitelezett módszerekre támaszkodva célunk egy in vitro körülmények között működő iszkémia modell beállítása volt, amivel megérthetők az iszkémiás sejtkárosodás sejtszintű mechanizmusai. E modellel azt kívántuk vizsgálni, hogy a sérült kardiomioblasztokhoz in vitro iszkémia után adott mezenhimális őssejtek milyen sejtszintű mechanizmusokkal vesznek részt a regeneráció folyamatában 24 órán belül, ameddig transzdifferenciáció még nem történik.
Vizsgálatainkban elemeztük a parakrin faktorok hatását, a közvetlen sejt-sejt kapcsolatok jelentőségét iszkémiás körülmények között.
Módszerek
Felhasznált sejttípusok
Kísérleteinkhez patkányból származó H9c2 kardiomioblaszt sejtvonalat (ATCC, Wesel, Németország), és C57Bl/6 egérből izolált mezenhimális őssejteket használtunk. A kardiomioblasztokat 4,5 g/l glükóztartalmú DMEM-ben tenyésztettük, amely tartalmazott még 10% FCS-t, 2 mM L-glutamint, 100 U/ml penicillint és 100 :g/ml streptomycint. A H9c2 kardiomioblaszt sejtvonal embrionális patkány szívből származik, szívizomra és vázizomra is jellemző elektrofiziológiai és biokémiai tulajdonságokat mutat, ezért mind szívizom, mind vázizom in vitro modelljeként használatos [16, 17]. Szérummegvonás hatására a mononukleáris mioblasztok miotubulusokká alakulnak. A differenciáció során a sejtek megtartják a szívizomsejtekre jellemző elektromos és hormonális szignalizációs útvonal néhány elemét, ezért lehet az iszkémiás szív vizsgálatára alkalmazott in vitro modell része.
A mezenhimális őssejtek izolálása C57Bl/6 egerek femurjából történt Tropel módszerével [18], azaz az egereket pentobarbitállal (ip, 50 mg/kg, Nembutal, Ovation, Deerfield, IL, USA) túlaltattuk, majd kipreparáltuk a femurt. A csont mindkét végéről eltávolítottuk a csontvégeket, majd a csontvelőt egy injekciós tű segítségével sejttenyésztő médiumba (1g/l glükóztartalmú DMEM, 10% FCS, 2 mM L-glutamin, 100 U/ml penicillin és 100 :g/mlstreptomycin) gyűjtöttük, 1200 RPM-en lecentrifugáltuk, majd T75-ös sejttenyésztő flaskába helyeztük. Négy-öt nap után a csontvelőben lévő mezenhimális őssejtek kitapadnak a sejttenyésztő edény aljára, a le nem tapadt sejteket fiziológiás sóoldatos mosással eltávolítottuk. A sejtek korábbi vizsgálata kimutatta, hogy a kitapadt sejtek pozitívak voltak a jellegzetes MSC markerre (Sca-1), és negatívak a vérképző sejtfejlődési sorok tipikus markereire (CD34, CD3g, CD45R/B220, CD11b, 6G, és TER-119), illetve differenciálhatóak voltak adipogén és oszteogén irányba [19].
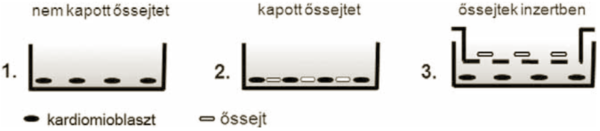
1. ábra
Három vizsgálati csoport iszkémiás körülmények között.
A kísérletekben használt fluoreszcens festékek
Kísérleteinkben a konfokális mikroszkópiához és az áramlási citometriához a kardiomioblasztokat és az őssejteket különböző hullámhosszúságú fénnyel gerjeszthető fluoreszcens festékekkel jelöltük meg azonosításuk céljából. A sejteket a lipidoldékony Vybrant fluoreszcens festékcsaláddal festettük meg, amelynek tagjai a sejtek plazmamembránjába épülnek be az inkubálás során. A kardiomioblasztokat Vybrant DiO-val jelöltük. A mezenhimális őssejteket Vybrant DiD-del festettük meg. A sejttenyésztő médiumhoz 1:200 arányú koncentrációban hozzáadott festékeket 37°C-on 30 perces inkubáció után mostuk ki.
Az élő sejtek jelölésére calcein AM-et használtunk (koncentráció: 1:2000, 37°C, 30 perc), amely a négy negatív töltése miatt a sejtmembránon átdiffundálva a sejtek citoplazmájába kerül. Itt észterázok lehasítják az amino-metilészter csoportot, így szabaddá válik az erős fluoreszcens jelet kibocsátó calcein festék, amely már nem képes a plazmamembránon átjutni. Mivel észteráz aktivitása csak az élő sejteknek van, ezért a calcein alkalmazható az élő sejtek jelölésére és detektálására. Az iszkémia során elpusztult sejtek jelölésére ethidiumhomodimert használtunk (koncentráció: 1:500, 37°C, 30 perc), amely a sérült sejtmembránon átdiffundálva a sejtmaghoz kapcsolódik. Mivel a molekula erős pozitív töltéssel rendelkezik, az ép sejtmembránon nem képes átjutni, így az egészséges sejtek nem festődnek.
Iszkémia modell
Az in vitro iszkémia modell során a H9c2 sejteket egyidejű oxigén- és glükóz megvonásnak (OGD) tettük ki. Az oxigénmegvonást a konfokális mikroszkóp sejtinkubációs rendszerével értük el, amellyel 0,3-0,4% O2 koncentrációt lehet beállítani. A glükózmegvonást glükózmentes tenyésztő médium használatával végeztük. A kísérletek során a kardiomioblaszt sejteket Vybrant DiO fluoreszcens festékkel jelöltük, és 2,5 óráig 0,5% O2 és 99,5% N2 atmoszférában tartottuk glükózmentes médiumban.
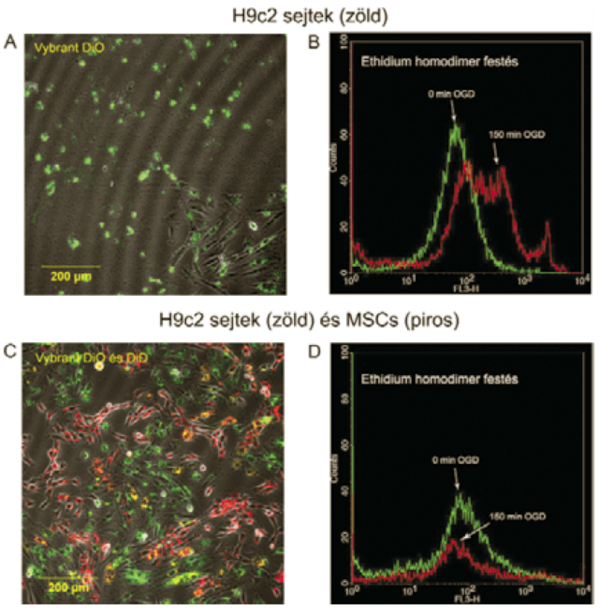
2. ábra
H9c2 sejtek morfológiája és életképessége 24 órával az OGD után.
Kísérleti protokoll
A kardiomioblasztok és az őssejtek vizsgálata a következő kísérleti protokoll szerint történt: vizsgáltuk a kardiomioblasztok túlélését azután, hogy mesterséges iszkémiának tettük ki őket 2,5 óráig, majd mezenhimális őssejteket adtunk a tenyészethez. A kísérleteket 12 lyukú tenyésztőlemezen végeztük, lyukanként 3x104 H9c2 sejttel, amihez 2x104 mezenhimális őssejtet adtunk. A kardiomioblasztokat minden esetben Vybrant DiO-val (zöld) jelöltük meg, a hozzáadott mezenhimális őssejteket pedig Vybrant DiD-del (piros) festettük. Ebben az esetben is három vizsgálati csoportot hoztunk létre (1. ábra): kardiomioblasztok, amelyek iszkémia után nem kaptak őssejtet (kontroll), kardiomioblasztok, amelyek iszkémia után mezenhimális őssejtet kaptak, kardiomioblasztok, amelyek iszkémia után mezenhimális őssejtet kaptak inzertben (az inzertek 0,4 :m nagyságú membránpórusokkal rendelkeznek, amelyek nem teszik lehetővé a direkt sejt-sejt kapcsolatokat, de a sejtek által szekretált anyagok eljuthatnak a másik sejtig) Iszkémia után 24 órával ethidium-homodimerrel festettük meg a ko-kultúrákat, és konfokális mikroszkóppal képeket készítettünk, illetve áramlási citometriával vizsgáltuk a különböző sejtpopulációkat.
Sejtfúzió vizsgálata OGD során, valamint nanocsövek megfigyelése
42 mm átmérőjű tárgylemezre 1x105 H9c2 sejtet növesztettünk, egy nap múlva megfestettük Vybrant DiOval, és a jelölt sejteket oxigén- és glükóz megvonásnak tettük ki. OGD után 1x105 Vybrant DiD-del jelölt mezenhimális őssejteket adtunk, majd a sejttenyészetet a konfokális mikroszkópon található sejtinkubációs rendszerbe helyeztük. 24 óráig felvételeket készítettünk a sejttenyészetről 15 perces gyakorisággal. Ezeken a feltételeken vizsgáltuk a sejtfúzió jelenségét és nanocsövek kialakulásának folyamatát. Abban az esetben, amikor a sejtek mitokondriumait vizsgáltuk OGD után, a tenyészeteket MitoTracker Reddel festettük meg 1:2000-es hígításban 10 percig 37°C-on.
A konfokális képek kiértékelése, alkalmazott statisztikai módszerek
Az iszkémiát szenvedett sejtekről készült konfokális képek kiértékelése az ImageJ szoftverrel történt. A morfológia és a festődés alapján elkülönített élő és elpusztult kardiomioblasztokat, valamint az őssejteket a program segítségével számoltuk meg. A kardiomioblasztokat (zöld Vybrant DiO festés), amelyek ép morfológiával rendelkeztek, és nem volt detektálható ethidium homodimer festés, vagyis amelyek túlélték az OGD-t, piros ponttal jelöltük. A halott kardiomioblasztokat, amelyek felkerekedtek, és ethidium-homodimert találtunk bennük, fekete ponttal jelöltük. A kapott adatokat ANOVA-val, Neumann- Keuls poszt hoc teszttel értékeltük ki.
Eredmények
Iszkémiát szenvedett H9c2 kardiomioblasztok és mezenhimális őssejtek együtt tenyésztése
A 2,5 órás in vitro iszkémia után azt vizsgáltuk. hogy megfigyelhető-e javulás a 2,5 óra hosszú iszkémiát követően őssejtekkel kezelt, károsodott kardiomioblasztok túlélésében. A 24 óráig tartó ko-kultivációt követően az ethidiumhomodimerrel jelölt tenyészetről a konfokális mikroszkóppal készített képeket értékeltük ki, illetve áramlási citometriás vizsgálatokat végeztünk. Konfokális mikroszkóppal kimutattuk, hogy a kardiomioblasztok OGD után 24 órával egyedül növesztve ugyanazt a felkerekedett, "kihólyagosodott membránú" morfológiát mutatták, mint a kardiomioblasztok rögtön OGD után. Az áramlási citometriás vizsgálatokkal bebizonyítottuk, hogy az OGD után szignifikáns mértékben emelkedett a halott sejteket jelző festék, az ethidium-homodimer jel intenzitása (medián fluoreszcencia intenzitás 19-ről 65-re emelkedett). Az ábra azt is bemutatja, hogy sejtek egy része 150 perc után festetlen maradt az ethidium homdimer jelölés után a modell variabilitása következtében. Abban az esetben, amikor mezenhimális őssejteket adtuk a károsodott kardiomioblasztokhoz, a sejtek az egészséges sejtekre jellemző morfológiát mutatták. Az áramlási citometriával megállapítottuk, hogy a halott H9c2 sejtek száma a kontroll szinten marad (median fluoreszcencia intenzitás: 24 vs 23) (2.ábra).
A mezenhimális őssejtek hatását a konfokális mikroszkópos képek felhasználásával kvantifikáltuk. A csoportokat összehasonlítva arra az eredményre jutottunk, hogy a kontrollhoz képest szignifikánsan kevesebb az elpusztult sejtek aránya (0,85 ± 0,086 vs. 0,16 ± 0,035, p<0,05, n=6), ha az OGD után őssejtet adtuk a tenyészethez. Azonban ha az őssejteket a sejttenyésztő inzert segítségével adtuk a károsodott kardiomioblasztokhoz, akkor a kontrollhoz hasonló képet kaptunk (halott sejtek aránya: 0,90±0,055, p<0,05, n=6). Az ábrán a következő csoportok szerepelnek, amelyek megfelelnek a 3. ábrán látható csoportoknak: C: kardiomioblasztok egyedül OGD után, C+MSCs: kardiomioblasztok és hozzáadott őssejtek, C+MSCs ins: kardiomioblasztok és hozzáadott őssejtek inzertben. Megvizsgáltuk azt is, hogy alakult az élő sejtek száma a különböző kezelt csoportokban a kísérlet kezdetén, és 24 órával az őssejtek hozzáadása után. A kísérlet kezdetén a sejtek közel 80-90%-os konfluenciát értek el (63120±7694 sejt), így 24 óra elteltével abban a csoportban, ahol nem történt oxigén- és glükóz megvonás, a sejtszám csak kismértékben emelkedett (76116±3396 sejt). 24 órával OGD után, amennyiben a kardiomioblasztokhoz nem adtunk megmentő mezenhimális őssejteket vagy ezeket a sejteket inzertben adtuk, a túlélő sejtszám alacsony maradt (1757±1081 és 990±608 sejt), azonban ha az őssejteket közvetlenül adtuk, akkor a túlélő sejtszám szignifikánsan emelkedett (15174±3975 sejt) (3. ábra).
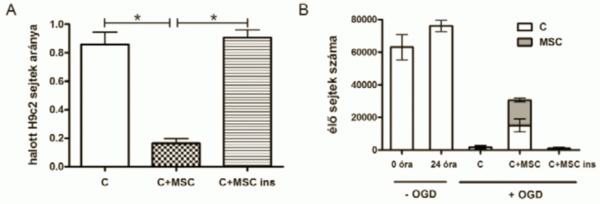
3.ábra
A: A halott sejtek arányának alakulása a különböző kísérleti csoportokban.
B: Az élő H9c2 sejtek abszolút számának alakulása az OGD előtt és után.
Az intercelluláris kapcsolatok kialakulása mellett a kettősen festődött, kétmagvú sejtek jelezték, hogy a ko-kultiváció során sejtfúzió is történt. A sejtfúzió kialakulásához közel 4 órára volt szükség (4.ábra). A kardiomioblasztok és az őssejtek között OGD után gyakran megfigyelhető volt intercelluláris kapcsolatok, úgynevezett nanocsövek kialakulása. Ezek a nanocsövek több 10µm hosszúságúak voltak, átmérőjük 200-500 nm között volt. MitoTracker Red festéssel kimutattuk, hogy a kardiomioblasztok és őssejtek közötti nanocsövekben funkcionálisan aktív mitokondriumok vannak. A videomikroszkópos felvételeken nem volt megállapítható az intercelluláris kapcsolatokban a mitokondriumok áramlásának iránya, az azonban megállapítható volt, hogy egy nanocső kialakulásához közel 2 órára volt szükség (5.ábra).
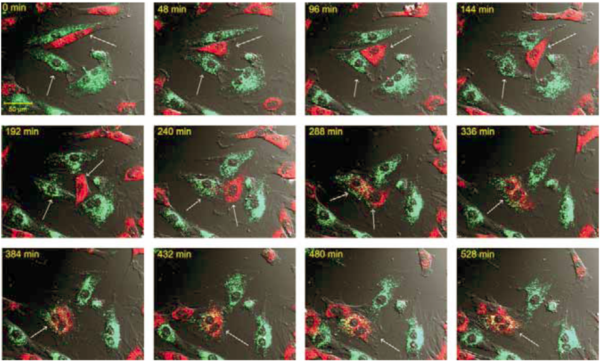
4. ábra
Sejtfúzió egy kardiomioblaszt és őssejt között. Videomikroszkópiával megfigyeltünk sejtfúziót Vybrant DiO-val jelölt H9c2 sejt (zöld szín) Vybrant DiD-del jelölt őssejt (piros szín) között.
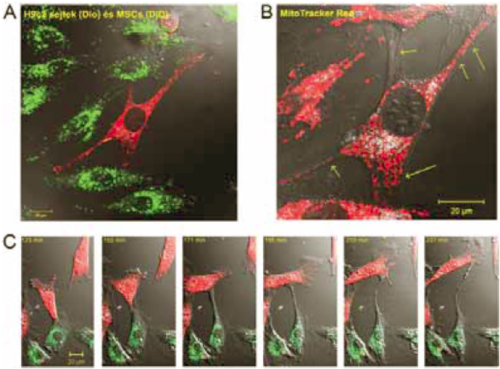
5. ábra
Intercelluláris kapcsolatok kialakulása OGD után
A: Nanocsöves hálózat kialakulása DiO-val jelölt H9c2 és DiD-del jelölt mezenhimális őssejt között OGD után 24 órával.
B: A sejtek között az intercelluláris kapcsolatokban MitoTracker Reddel jelölt (piros szín) aktív mitokondriumokat mutattunk ki (sárga nyilak).
C: Nanocső kialakulás videomikroszkópos megfigyelése a DiO-val jelölt H9c2 és DiD-del jelölt mezenhimális őssejt között.
Megbeszélés
Az egészséges mezenhimális őssejtek képesek megmenteni az iszkémiát szenvedett kardiomioblasztokat egy olyan mechanizmuson keresztül, amit eddig nem említettek az őssejtek hatásai között iszkémiás állapotokban. Az őssejtes terápia hatásossága nem csak a neovaszkularizációban és az elpusztult sejtek pótlásában nyilvánulhat meg, hanem abban, hogy az őssejtek megmentik a sérült sejteket. A hatás legvalószínűbb magyarázata az lehet, hogy az őssejtek javítják a károsodott kardiomioblasztok esélyét a túlélésre, meggátolják a sejthalál kialakulását. Az alkalmazott in vitro iszkémia modellel bemutattuk, hogy az őssejtek ko-kultivációjának jótékony hatása függ a direkt sejt-sejt kapcsolatoktól és az intercelluláris nanocsövektől. Nanocső kialakulást endoteliális progenitor sejtek, szívizomsejtek [9, 13], immunsejtek és más sejttípusok között is megfigyeltek [20, 21]. A nanocsövek jellemzése feltárta, hogy aktin filamentumokat tartalmaznak, néhány esetben mikroszómákat vagy mitokondriumokat talalták bennük. Azt találtuk, hogy ez a jelenség gyakran megy végbe kardiomioblasztok és mezenhimális őssejtek között. Ha az intercelluláris kapcsolatok kialakulását a sejtek között egy fizikai akadállyal korlátoztuk, akkor az őssejtek nem tudták a posztiszkémiás kardiomioblasztokat megmenteni. Ezek a megfigyelések arra utalnak, hogy az intercelluláris kapcsolatoknak szerepük lehet a sejtek túlélésében iszkémia során és iszkémia után, azonban a mögöttes mechanizmusok kis mértékben eltérhetnek. A megmentő hatás egyik lehetséges mechanizmusa az lehet, hogy a transzplantált sejtek parakrin faktorok szekréciójával fokozzák a regenerációt [22-26]. Sejtinzerttel folytatott kísérleteink eredményei azonban azt mutatják, hogy a sejtek által szekretált parakrin faktorok szintje túl alacsony volt ahhoz, hogy megmentő hatást fejtsen ki a károsodott kardiomioblasztokra. Elképzelhető azonban, hogy in vivo, egy-egy kis térfogatú mikrokörnyezetben, niche-ben a bejutattott sejtek által leadott parakrin faktorok helyileg olyan magas koncentrációt érjenek el, amely mellett már fontos szerepet játszhatnak a regeneráció folyamatában.
A kísérleti protokoll időkerete szintén fontos. Kísérleteinkben a sejteket korai időpontban adtuk a károsodott kardiomioblasztokhoz, és a kísérleteket még azelőtt befejeztük, mielőtt differenciáció történhetett volna. A kísérletek késői szakaszában a parakrin faktorok hatása valószínűleg nagyobb jelentősséggel bír, főleg a differenciációs folyamatokban [27, 28]. A másik, in vivo kísérletekben is gyakran megfigyelt jelenség kokultivációs vizsgálatok során a sejtfúzió [29-31]. Számos vizsgálat bemutatta, hogy a sejtfúzió eredményeként transzdifferenciáció történik, amelyik egy alternatív mechanizmus lehet az infarcerált miokardium regenerálásában őssejt-transzplantáció által. A videomikroszkópos felvételeken mi is találtunk néhány kettős festődésű, kétmagvú sejtet, ami azt jelzi, hogy sejtfúzió történt. Azonban, a sejtfúzió jelensége nagy variációt mutat a különböző tenyésztési és detektálási technikákkal, ezért nem zárható ki az sem, hogy részben in vitro artefakt jelenségről van szó [8, 22, 32]. Kísérleteink során csak néhány, megkérdőjelezhetetlen sejtfúziót figyeltünk meg, amely nem elégséges a nagyszámú károsodott kardiomioblaszt megmentéséhez [33]. Szintén találtunk kettős festődésű, azonban egymagvú sejteket a kardiomioblasztok és az őssejtek együtt tenyésztése során. Ez a kettős jelölődés a direkt sejt-sejt kapcsolatok kialakulásának eredménye lehet. Ezen kapcsolatok kialakulása során a sejtek membránrészleteket cserélnek ki egymással, ezáltal a Vybrant festék az egyik sejtből a másik sejtbe kerülhet át. Driesen és mtsai [34] kimutatták, hogy az alacsony molekulasúlyú sejtjelző anyagok, mint például a calcein-AM réskapcsolatokon át tudnak jutni egyik sejtből a másikba, nagy molekulasúlyú anyagok pedig parciális sejtfúzió által, vagyis levonhatjuk a következtetést, hogy 24 óra után kísérleteinkben a sejtjelölő festékek egyik sejtről másikra jutása valószínűleg a direkt sejt-sejt kapcsolatok következménye. Ebben a kísérleti felállásban a legtöbb sejt-sejt kölcsönhatás rövid idejű intercelluláris kapcsolat volt, amely egy állandóan változó hálózatot alakított ki a két vizsgált sejttípus között. A modell akut hatások vizsgálatára alkalmas nagy térbeli és időbeli felbontással, ami kizárja a differenciáció lehetőségét, de nem lehetséges a 3D szövetstruktúra modellezése, ahol a sejt-sejt kölcsönhatások más jellegűek. Ezek a körülmények limitálják a levonható következtetéseket. Másfelől a modell fontos és szükséges volt abból a szempontból, hogy rövid ideig tartó intercelluláris kapcsolatokat vizsgáljunk. Eredményeink alapján azt a következtetést vontuk le, hogy in vitro iszkémiás modellben a hozzáadott őssejtek közvetlen sejt-sejt kapcsolatok és intercelluláris nanotubulusok kialakításával javítják a károsodott sejtek túlélését, és ez a jelenség feltehetően fontos, új mechanizmust jelenthet in vivo körülmények között is.
Köszönetnyílvánítás
Jelen munka az OTKA 47095, 49488, 45933, 049621, 83803, ÖAD 66öu5, TÁMOP 4.2.2-08/1/KMR-2008- 0004, Öveges és Bolyai ösztöndíjak támogatásával valósulhatott meg.
Irodalom
- Dimmeler, S., J. Burchfield, and A.M. Zeiher, Cell-Based Therapy of Myocardial Infarction. Arterioscler Thromb Vasc Biol, 2007.
- Antonio Giordano, U.G.I.R.M., From the laboratory bench to the patient’s bedside: An update on clinical trials with mesenchymal stem cells. Journal of Cellular Physiology, 2007. 211(1): p. 27-35.
- Jawad, H., et al., Myocardial tissue engineering. Br Med Bull, 2008. 87(1): p. 31-47.
- Orlic, D., et al., Bone marrow cells regenerate infarcted myocardium. Nature, 2001. 410(6829): p. 701.
- Dittmar, T., et al., Carcinogenesis driven by bone marrow- derived stem cells. Contrib Microbiol, 2006. 13: p. 156-69.
- Horackova, M., et al., Cell transplantation for treatment of acute myocardial infarction: unique capacity for repair by skeletal muscle satellite cells. Am J Physiol Heart Circ Physiol, 2004. 287(4): p. H1599-1608.
- Gnecchi, M., et al., Paracrine action accounts for marked protection of ischemic heart by Akt-modified mesenchymal stem cells. Nat Med, 2005. 11(4): p. 367-8.
- Garbade, J., et al., Fusion of bone marrow-derived stem cells with cardiomyocytes in a heterologous in vitro model. European Journal of Cardio-Thoracic Surgery, 2005. 28(5): p. 685.
- Koyanagi, M., et al., Cell-to-Cell Connection of Endothelial Progenitor Cells With Cardiac Myocytes by Nanotubes: A Novel Mechanism for Cell Fate Changes? Circ Res, 2005. 96(10): p. 1039-1041.
- Spees, J.L., et al., Mitochondrial transfer between cells can rescue aerobic respiration. Proc Natl Acad Sci USA, 2006. 103(5): p. 1283-8.
- Abdel-Latif, A., et al., Adult bone marrow-derived cells for cardiac repair: a systematic review and meta-analysis. Arch Intern Med, 2007. 167(10): p. 989-97.
- Fukuhara, S., et al., Direct cell-cell interaction of cardiomyocytes is key for bone marrow stromal cells to go into cardiac lineage in vitro. Journal of Thoracic and Cardiovascular Surgery, 2003. 125(6): p. 1470.
- Plotnikov, E.Y., et al., Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. J Cell Mol Med, 2008. 12(5A): p. 1622-31.
- Xu, M., et al., Differentiation of bone marrow stromal cells into the cardiac phenotype requires intercellular communication with myocytes. Circulation, 2004. 110(17): p. 2658-65.
- Kajstura, J., et al., Bone marrow cells differentiate in cardiac cell lineages after infarction independently of cell fusion. Circ Res, 2005. 96(1): p. 127-37.
- Kimes, B.W. and B.L. Brandt, Properties of a clonal muscle cell line from rat heart. Experimental Cell Research, 1976. 98(2): p. 367-381.
- Sardao, V.A., et al., Vital imaging of H9c2 myoblasts exposed to tert-butylhydroperoxide—characterization of morphological features of cell death. BMC Cell Biol, 2007. 8: p. 11.
- Tropel, P., et al., Isolation and characterisation of mesenchymal stem cells from adult mouse bone marrow. Exp Cell Res, 2004. 295(2): p. 395-406.
- Urbán, V.S., et al., Mesenchymal Stem Cells Cooperate with Bone Marrow Cells in Therapy of Diabetes. Stem Cells, 2008. 26(1): p. 244-253.
- Onfelt, B., et al., Cutting edge: Membrane nanotubes connect immune cells. J Immunol, 2004. 173(3): p. 1511-3.
- Onfelt, B., et al., Long-distance calls between cells connected by tunneling nanotubules. Sci STKE, 2005. 2005(313): p. pe55.
- Menasche, P., You Can’t Judge a Book by Its Cover. Circulation, 2006. 113(10): p. 1275-1277.
- Gnecchi, M., et al., Paracrine Mechanisms in Adult Stem Cell Signaling and Therapy. Circ Res, 2008. 103(11): p. 1204-1219.
- Paul, W.M.F., Paracrine Effects of Cell Transplantation: Modifying Ventricular Remodeling in the Failing Heart. Seminars in thoracic and cardiovascular surgery, 2008. 20(2): p. 87.
- Takahashi, M., et al., Cytokines produced by bone marrow cells can contribute to functional improvement of the infarcted heart by protecting cardiomyocytes from ischemic injury. Am J Physiol Heart Circ Physiol, 2006. 291(2): p. H886-93.
- Uemura, R., et al., Bone marrow stem cells prevent left ventricular remodeling of ischemic heart through paracrine signaling. Circ Res, 2006. 98(11): p. 1414-21.
- Dai, W., et al., Allogeneic Mesenchymal Stem Cell Transplantation in Postinfarcted Rat Myocardium: Short- and Long-Term Effects. Circulation, 2005. 112(2): p. 214-223.
- Kinnaird, T., et al., Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms. Circ Res, 2004. 94(5): p. 678-85.
- Ishikawa, F., et al., Purified human hematopoietic stem cells contribute to the generation of cardiomyocytes through cell fusion. Faseb J, 2006. 20(7): p. 950-2.
- Lacza, Z., E. Horvath, and D.W. Busija, Neural stem cell transplantation in cold lesion: a novel approach for the investigation of brain trauma and repair. Brain Research Protocols, 2003. 11(3): p. 145.
- Nygren, J.M., et al., Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat Med, 2004. 10(5): p. 494-501.
- Kajstura, J., et al., Bone Marrow Cells Differentiate in Cardiac Cell Lineages After Infarction Independently of Cell Fusion. Circ Res, 2005. 96(1): p. 127-137.
- Rose, R.A., et al., Bone marrow-derived mesenchymal stromal cells express cardiac-specific markers, retain the stromal phenotype, and do not become functional cardiomyocytes in vitro. Stem Cells, 2008. 26(11): p. 2884-92.
- Driesen, R.B., et al., Partial cell fusion: a newly recognized type of communication between dedifferentiating cardiomyocytes and fibroblasts. Cardiovasc Res, 2005. 68(1): p. 37-46.
Cselenyák Attila
Klinikai Kísérleti Kutató- és Humán Élettani Intézet
Semmelweis Egyetem
Tűzoltó utca 37-47.
Budapest, H-1094
E-mail: Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Érbetegségek: 2011/1. 3-11. oldal