Bevezetés: Az érhálózatban fellépő gyulladásos állapot számos kardiovaszkuláris betegség esetén megfigyelhető. A folyamatban résztvevő sejtek közül kiemelten fontosak az endotélsejtek, melyek egyik legismertebb feladata a gyulladás szabályzása. A hibás endotél működés gyógyszeres kezelésére nem sok lehetőség van. A flavonoidok azonban olyan másodlagos növényi anyagcseretermékek, melyeknek az érrendszerre gyakorolt jótékony, gyulladás gátló hatását régóta ismerik, viszont a hatásmechanizmus nem tisztázott.
Célkitűzés: Célunk volt a flavonoidokhoz tartozó öt, szerkezetileg rokon vegyület gyulladás gátló hatását egymással összehasonlítani in vitro endotélsejt tenyészeten.
Módszerek: Kísérleteinket emberi köldökzsinór vénából kollagenázos emésztéssel preparált endotélsejteken (HUVEC) végeztük. A HUVEC sejteket 1% FCS-el, EGF-el, ß-ECGF-el és heparinnal kiegészített AIM-V médiumban tenyésztettük. A citotoxicitási tesztet SYBR-Green fluoreszcens magfestéssel, az NFκB nukleáris transzlokációját fluoreszcens mikroszkóppal mértük és kvantifikáltuk.
A citokin termelést ELISA és xMAP módszerekkel végeztük. Tenyésztéskor a sejteket kezeltük a flavonoidokkal, majd IL-1ßindukciót alkalmaztunk 24 órán át. A kezelés végén a felülúszókból meghatároztuk az IL6, IL-8, és MCP-1 koncentrációt a kitek gyári leírásai alapján.
A flavonoidok oxidációját a specifikus fényelnyelési hullámhosszokon az OD megváltozása alapján mértük.
Eredmények: Az általunk vizsgált flavonoidok közül egyik sem mutatott citotoxikus hatást 50µM-os koncentrációig, kivételt az izoramnetin jelentett, amely még 25µM-os koncentrációnál is enyhén toxikusnak bizonyult. Először megvizsgáltuk a flavonoidoknak az NFκB nukleáris transzlokációjára gyakorolt hatását, és azt tapasztaltuk, hogy csak a kvercetin gátolja ezt a folyamatot. Ezután megnéztük, hogy befolyásolják-e a flavonoidok az IL-1ß indukálta citokin választ. A gyógyászatban is ismert hidroxietil-rutozidok, illetve a trihidroxietil-rutozid nem befolyásolták az IL-1ß által kiváltott citokin termelést, viszont a nem hidroxietilált flavonoidok az IL-1ß indukálta citokin választ különböző mértékben gátolták. Legerősebb hatása a kvercetinnek volt, ezt követte az izoramnetin, és a szintén gyógyszerként alkalmazott rutin. Feltételezésünk szerint a különböző molekulaszerkezetű flavonoidok közötti különbség hátterében az eltérő gyökfogóképesség is állhat. Ezért megnéztük, mely vegyületek képesek semlegesíteni a H2O2-t. A vártakkal összhangban a kvercetin és az izoramnetin oxidálódott H2O2 jelenlétében, míg a glikozilált származékok egyáltalán nem.
Következtetés: A vizsgált flavonoidok gyulladásgátló mechanizmusa szoros szerkezet/hatás összefüggést mutat. Ezt részben jól magyarázza az NFκB transzlokációjának és a proinflammatorikus citokinek termelődésének visszaszorítása. Az öt, strukturálisan rokon flavonoidszármazék gyulladáscsökkentő hatásának pontosabb feltérképezésére az in vitro eredményeket állatmodellen is fontos megismételni, hiszen az így kapott farmakokinetikai tulajdonságok az in vivo vaszkuláris betegségekre gyakorolt hatásukról adhatnak egy pontosabb képet.
Érbetegségek: 2011/4. - 87-95. oldal
KULCSSZAVAK
Endotélsejt, flavonoid, kvercetin, gyulladás, citokin, oxidáció
Bevezetés
Az ereket belülről borító endotélsejt hálózat a szelektív barrier funkció ellátása mellett számos folyamat regulátora. Az endotélium működése az érhálózat különböző szakaszain hasonló, de mégis érszakasz specifikus. Így például a vérnyomás szabályozása az artériákon-arteriólákon, a permeabilitás szabályozása a kapillárisok területén, míg a fehérvérsejtek transzmigrációjának szabályzása a venulákon és a kapillárisoknál valósul meg a leghatározottabban.
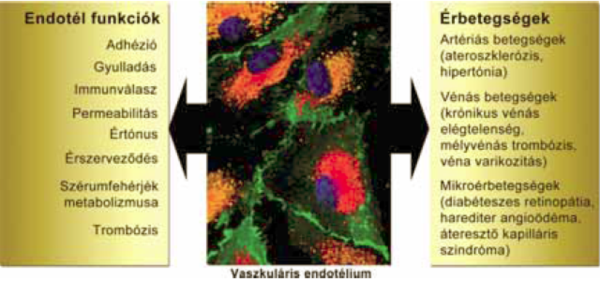
1. ábra:
Endotélsejtek funkciói
Bár a szív és érrendszeri megbetegedések nagyobb csoportokba oszthatók a kóros érszakaszok anatómiai helyzete alapján (1. ábra), az endotélsejtek hibás működése az érszakasztól függetlenül, jól leírt módon hozzájárul, vagy megelőzi e betegségek (pl. ateroszklerózis, krónikus vénás elégtelenség, diabéteszes retinopátia) kialakulását (1).
Az endotélsejt funkciói közül a gyulladás szabályzása központi szerepet tölt be. Ezt citokinek, kemokinek és sejtfelszíni adhéziós molekulák segítségével valósítják meg az endotélsejtek, melyeknek hibás működése krónikus gyulladásos állapot kialakulásához vezet (2). A gyulladásos állapot kialakulása és krónikus fennállása nyomon követhető a gyulladás kialakulását meghatározó citokinek és kemokinek, mint például az interleukin-6, interleukin-8 (IL-6, IL-8) és a moncita-kemoatraktáns protein-1 (MCP-1), termelődésének fokozódásával, és a gyulladásban résztvevő sejtek sejtfelszíni adhéziós molekuláinak fokozott expressziójával. Ezen molekulák kifejeződése több szignáltranszdukciós útvonalon beindítható, melyek közül az NFκB mediált traszkripcó az egyik legismertebb folyamat. A citokinek, kemokinek és az adhéziós molekulák olyan gyulladásos markerek, amelyek emelkedett szintjét leírták már számos szív és érrendszeri betegség esetén. Például a krónikus szívelégtelenség esetén főleg az IL-6 és MCP-1 szérumszintje emelkedett, míg az ateroszklerózisban inkább az IL-8 növekedése jellemző (3, 4).
Az endotélsejtek működésének normalizálására azonban nem sok gyógyszeres kezelési lehetőség van. A flavonoid molekulacsalád számos tagjáról leírták már, az érhálózatra gyakorolt jótékony, gyulladáscsökkentő hatásuk van. A publikálók közül elsőként Szent-Györgyi és Rusznyák írták le az általuk elnevezett P-vitaminról, - amely szintén egy flavonoid származék, - hogy képes csökkenteni a kapillárisok permeabilitását (5). A flavonoidok másodlagos növényi anyagcseretermékek, megoszlásuk az emberi táplálékokban nagyon változó. A táplálkozási szokásoktól függően az átlagos flavonoid fogyasztás 10-100 mg/nap között van. A legnagyobb mennyiségben a vöröshagyma, az alma, a cseresznye, a brokkoli, a lestyán, a vörös szőlő, és a tea (camellia sinensis) tartalmaz flavonoidokat, közülük a kvercetin mennyisége a legnagyobb, amely elérheti esetenként az összes flavonoid bevitel 2/3-ad részét is (1.táblázat).
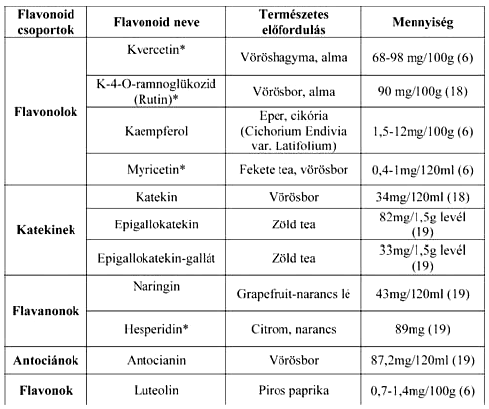
1. táblázat:
Természetes flavonoidok leggyakoribb előfordulásai és mennyiségük. A *-gal jelöltek gyógyszerkészítmények alapvegyületei is.
Leírták, hogy azokban az országokban, ahol a táplálkozási szokások miatt az átlagos napi flavonoid bevitel magasabb mint 25 mg, a kardiovaszkuláris megbetegedések száma, valamint a kialakulásának rizikója szignifikánsan alacsonyabb azokhoz képest, ahol a flavonoid napi beviteli szintje a 19 mg-ot nem haladja meg (6). A természetes módosulatok gyakran glikoziláltak, a keringési rendszerbe azonban leginkább aglikon formában jutnak el (7). A fentebb említett P-vitamin, - más néven rutin - is a kvercetin egy rutinózzal szubsztituált módosulata. Ezt a vegyületet már évtizedek óta alkalmazzák a gyógyászatban visszér és aranyeres panaszok kezelésére. A rutinból szintetizálják a hidroxietil-rutozidokat, melyek közül a legnagyobb arányban keletkezik a trihidroxietil-rutozid. Ezeket a vegyületeket a vaszkuláris funkciók javítása érdekében alkalmazzák a krónikus vénás elégtelenség és ödéma kezelésére. A természetben szintén gyakori, hogy szulfatált vagy metilált módosulatok jönnek létre. A kvercetin egy metilált módosulata endotélsejtekben alakul ki, ezt a vegyületet izoramnetin néven ismerik.
A flavonoidok endotélsejtekre gyakorolt gyulladásgátló hatása régóta ismert, azonban a pontos hatásmechanizmus nem tisztázott. Fontos megjegyezni azonban, hogy a flavonoidokra általánosan nem lehet egyetlen mechanizmust illeszteni, hiszen az óriási molekuláris variabilitás eleve több csoportba osztható hatást feltételez. Ezek között szerepel elsősorban a szabadgyökfogóképesség, és bizonyos, a gyulladás folyamatában résztvevő enzimek működésének gátlása vagy éppen aktiválása is. A reaktív oxigéngyököknek (ROS) fontos szerepük van a gyulladás fiziológiás folyamatában, azonban a szabályozatlan termelődésük vagy nem hatékony eliminációjuk súlyos következményekkel jár. Az általunk vizsgált ötféle flavonoid strukturálisan a kvercetin köré csoportosítható. Molekulaszerkezeti különbségeik jól definiáltak és a gyulladáscsökkentő hatásukról számos értekezés szól, azonban ezen vegyületek gyulladáscsökkentő hatásáról összehasonlító tanulmány nem készült.
Célkitűzés
Kísérleteinkben a kvercetin, az izoramnetin, a rutin, a trihidroxietil-rutozid és a hidroxietil rutozidok in vitro tenyésztett endotélsejtekre gyakorolt gyulladáscsökkentő hatásának összehasonlítását tűztük ki célul. Az irodalomban ugyanis hiányosak az ismeretek ezen flavonoidok gyulladáscsökkentő mechanizmusairól, és az egymáshoz viszonyított hatásukról egyetlen értekezés sem szól, pedig ezek strukturálisan hasonló vegyületek, és a szerkezet/hatás összefüggése a flavonoidok körében jól ismert. Mindemellett, a kvercetin családba tartozó flavonoidok közül a kvercetin (QRC) a legnagyobb mennyiségben előforduló természetes flavonoid, a rutin (RUT) és a félszintetikus hidroxietilrutozidok (THR, HR) gyógyszerként alkalmazott flavonoidok, míg az izoramnetin (IRM) a kvercetin endothelsejtek által metilált aktív metabolitja, így ezen molekuláknak kiemelt szerepe van az endotélsejt diszfunkció kijavításában.
Anyagok és módszerek
Az endotélsejt preparálást az emberi köldökzsinór vénából és a tenyésztés folyamatát a laboratóriumunkban leírt és beállított protokoll szerint végeztük (8).
Az endotélsejtekkel végzett kísérleteket mindig a második vagy a harmadik passzálás után végeztük. A méréseket legalább háromszor ismételtük.
Először sejt citotoxicitási tesztet végeztünk kétféle módszer alkalmazásával. Az egyik egy mikroszkópos morfológiai vizsgálaton alapszik, melyben a sejtek alakját és számát értékeltük egy ötpontos rendszerben. A sejteket 96 lyukú sejttenyésztő lemezre szélesztettük konfluens (10000 sejt/lyuk) koncentrációban, majd kezeltük a különböző koncentrációjú (200; 100; 50; 25; 12,5; 6,25µM) HR, THR, RUT, QRC és IRM flavonoidokkal 24, máskor 96 órán keresztül. A HUVEC sejtek számát és morfológiáját pontoztuk a flavonoid kezelés 2., 24., máskor a 48. és 96. órájában. A 0 pont közel 0% élő sejtet, 4 pont a konfluens, élő tenyészetet jelentette. A másik mérés fluoreszcens magfestésen alapul. Az előzőekben leírt kezelések alkalmazása után a sejteket mostuk, majd fixáltuk a 24 illetve a 96 óra elteltével jéghideg metanol/aceton 1:1 arányú elegyével. Ezután jelöltük a sejtmagot Sybr-Green fluoreszcens festékkel. Végül lyukanként leolvastuk a fluoreszcencia intenzitását, amely arányos a lyukankénti sejtszámmal.
A HUVEC sejteket 96-lyukú sejttenyésztő lemezre szélesztettük Comp-AIM-V médiumban, 8000 sejt/lyuk (szemikonfluens) koncentrációban. 1 nap elteltével kezeltük a sejteket a flavonoidok háromféle koncentrációjával (1, 5, 10/50µM) és IL-1ß-val (0,3ng/ml, Biosource). 60 perces kezelést követően jéghideg metanol/acetonnal (50:50%) fixáltuk őket 10 percig, majd ECP-vel (Salsol-A 500ml TEVA-Gyógyszergyár Zrt., Tris-Cl 5ml SigmaAldrich, FCS-1% SigmaAldrich) történő rehidrálást követően 45 percig nyúl anti-humán NFκB p65 ellenanyaggal (1:200, Santa Cruz Biotechnology) inkubáltuk őket, ezt követően szekunder ellenanyagként kecske anti-nyúl Alexa-568-at (GAR-Alexa-568, 1:500, Molecular Probes), a mag láthatóvá tételéhez Hoechst 33342 (Molecular Probes) festéket használtunk. A festett sejteket Olympus DP70 digitális kamerával felszerelt, Olympus IX-81 típusú (Olympus Optical Co.) inverz fluoreszcens mikroszkóppal vizsgáltuk. A transzlokáció mértékét a magban és a citoszolban mérhető piros fluoreszcencia intenzitások arányából számoltuk ki analySIS szoftver segítségével.
Az xMAP technikával végzett mérés az R&D Systems cégtől rendelt gyári xMAP-kitben kapott protokoll szerint történt. A reakcióelegy egyfajta mastermixként tartalmazza az IL-6, IL-8 és MCP-1 antitestekkel fedett mikropartikulumokat. Ehhez mértük hozzá a felülúszó mintákat 1:30 hígításban, majd a detektáló antitest keveréket és végül a Streptavidin- Phycoerythrint. Végül Luminex 100TM rendszerrel flow citometriás elven meghatároztuk az analitok koncentrációját.
Az xMAP módszerrel nyert eredmények validálására az IL-6, IL-8 és MCP-1 méréseket az R&D systems által forgalmazott gyári ELISA duo kittek felhasználásával is elvégeztük a megadott protokoll leírások szerint. A minták IL-6 esetében háromszorosára, IL-8 esetében hússzorosára, MCP-1 esetében pedig nyolcvanszorosára hígított, flavonoidokkal és IL-1ß-val kezelt sejtek felülúszói voltak. Az ötféle flavonoid oxidációját a 230-500 nm közötti abszorpciós spektrum felvétel, spektrofotométerrel (SmartSpec 3000, Bio-Rad) mértük. Először PBS-ben (PAA Laboratories GmbH, Austria), 50µM koncentrációban, légköri oxigén jelenlétében rögzítettük az abszorpciós spektrumot hatvan percen keresztül. Ezután a kísérletet megismételtük 10 mM H2O2 hozzáadásával. A kapott abszorpciós spektrumok (OD) alapján az adatokat a flavonoidokra specifikus 345 és 373 nm hullámhosszokon 60 percnél mért OD megváltozása alapján, százalékban kifejezve ábrázoltuk. Végül a kísérletet úgy is elvégeztük, hogy a hidroxietilrutozidokat illetve a kvercetint 90 percig inkubáltuk 0,1; 1; 10 mM hidrogénperoxid jelenlétében, 1 mU/ml tormaperoxidáz (HRP) hozzáadásával, majd lemértük az OD spektrumot és ábrázoltuk a fentebb leírt módon.
Az eredményeket GraphPad Prism 4.02 (www.graphpad.com) szoftver segítségével elemeztük és ábrázoltuk. A statisztikai analízisekhez egy- illetve kétszempontos variancia-analízist (ANOVA) használtunk, majd Tukey post tesztet alkalmaztunk. Szignifikáns eltérésnek tekintettük, ha a kezeletlen vagy kezelt kontrollhoz viszonyítva p<0,05. Mindenből legalább három független kísérletet végeztünk, ebből egy reprezentatív ábrát tüntettünk fel az eredményeknél.
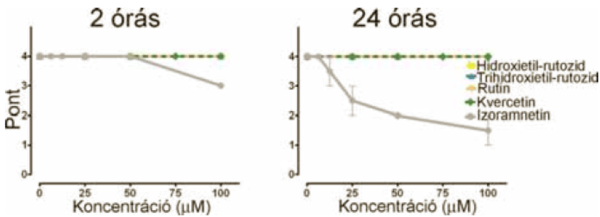
2. ábra:
A flavonoidok citotoxicitásának mérése. A vizsgált flavonoidok 2 és 24 órás kezelés után sem mutattak jelentős citotoxikus hatást, azonban az izoramnetin 10µM felett toxikus volt. A mérés mikroszkópos vizsgálaton alapul, amelyben a sejtek alakja és a relatív sejtszám alapján pontoztuk a flavonoidok toxikus hatását.
Eredmények
A flavonoidok citotoxicitásának vizsgálata. Az in vitro endotélsejteken végzett kísérletek kimenetelét erősen meghatározza a sejtszám és a sejtek normális alapműködése. Ezért a vizsgálatainkat citotoxicitási tesztekkel kezdtük, hogy megállapítsuk van-e mérhető toxikus hatásuk a flavonoidoknak abban az időtartományban, amelyben a kezeléseinket alkalmazzuk. A toxikus hatást többféle koncentrációnál vizsgáltuk négy időpontban. A 2 órás a nekrotikus, míg a 24 órás mérések az apoptotikus hatások kimutatását szolgálták. A 48 és 96 órás kezeléseket azért végeztük el, hogy megbizonyosodjunk a 24 órás kezelés alatt nem indultak be olyan lassabb folyamatok, amelyek sejtkárosodáshoz vezetnek, de még nem kimutathatóak 24 óra után. A mérésekből kiderült, hogy egyik flavonoid sem volt toxikus hatású a kezelések időtartama alatt, egyedül az izoramnetin mutatott némi toxikus hatást a magasabb koncentrációtartományokban (2. ábra).
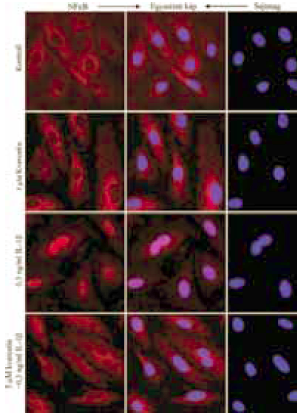
3. ábra:
A kvercetin kezelés gátolja az NFκB nukleáris transzlokációját HUVEC sejteken. 60perces kezelést követően vizsgáltuk az NFκB transzlokációját. IL-1ß gyulladásos indukció hatására jól megfigyelhető ez a folyamat. A kvercetin önmagában nem indukálja a transzlokációt a kontrollhoz viszonyítva, míg gátolja az IL-1ß hatását. A felvételeken a mag kék, az NFκB piros színnel látszik.
Ezért méréseink során legfeljebb 24 órás 50µM-os kezeléseket alkalmaztunk. Kivételt az izoramnetin jelentett, amivel maximálisan 10 µM-os kezelést használtunk, a toxikus hatásokból származó hibás eredmények elkerülése érdekében.
Flavonoidok hatása az NFκB nukleáris transzlokációjára. Az NFκB nukleáris transzlokációja gyulladásos indukció, például IL-1ß hatására megy végbe. A sejtmagba kerülő NFκB transzkripciós faktorként funkcionál, aminek hatására számos gyulladásban résztvevő citokin (pl. IL-6, IL-8) és kemokin (pl. MCP-1) molekula expressziója beindul. Ebből következően a transzlokáció gátlása csökkentett gyulladásos választ eredményez. Megvizsgáltuk, mely flavonoidok képesek csökkenteni az NFκB nukleáris transzlokációján keresztül kialakuló gyulladásos választ. Azt tapasztaltuk, hogy önmagában egyik flavonoid sem váltott ki NFκB transzlokációt (3. ábra).
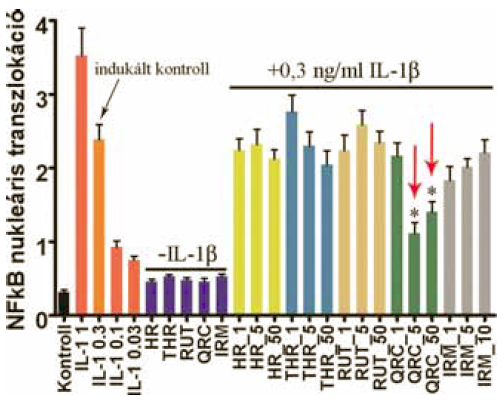
4. ábra:
A flavonoidok hatása az NFκB nukleáris transzlokációjára. Az ábrázolt adatokat a nukleáris és perinukleáris régiók átlag vörös fluoreszcencia intenzitásának arányából számoltuk.
Egyik vizsgált flavonoid sem indukálta önmagában az NFκB nukleáris transzlokációját, viszont az IL-1ß-val indukált sejtvonalak közül a kvercetin kezelés szignifikánsan gátolta ezt a folyamatot.
Ezzel szemben IL-1ß hatására erőteljes nukleáris transzlokációt figyelhettünk meg. Ezt a folyamatot az 5 és 50 µM kvercetin kezelés szignifikánsan képes gátolni (4. ábra).
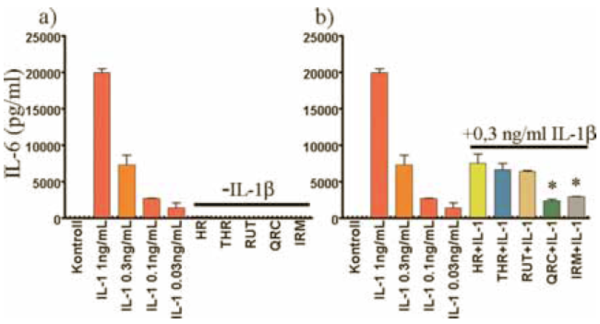
5. ábra:
A flavonoidok hatása az IL-6 citokin szintre. Az IL-6 szinteket gyári ELISA kitek segítségével határoztuk meg. Megvizsgáltuk a flavonoidok hatását az IL-6 szintjére önmagukban (5/a ábra), majd IL-1ß indukció hatásására is (5/b ábra). A flavonoidok önmagukban nem befolyásolják, azonban az izoramnetin és a kvercetin szignifikánsan gátolja az IL-1ß-ra adott IL-6 citokin választ.
Flavonoidok hatása a gyulladásos citokinek termelődésére. A gyulladásos indukció hatására termelődő citokinek és kemokinek mennyiségének csökkenésével jól jellemezhető a gyulladás gátlása. Hibás endotélfunkció esetén gyakran a proinflammatorikus citokinek szintjének emelkedése tapasztalható, amely fontos tényező számos betegségben. Méréseinkben arra kerestük a választ, hogy milyen különbségeket lehet kimutatni a flavonoidok között az IL-6, IL-8 és MCP-1 termelés indukciójában, illetve az IL-1ß hatására termelődő citokinek termelődésének gátlásában. Méréseinkből kiderül, hogy egyik általunk vizsgált flavonoid sem indukálta az IL-6, IL-8, MCP-1 termelődését (5a, 6a, 7a ábra). Az IL-1ß-val indukált IL-6 termelést azonban a kvercetin és az izoramnetin szignifikánsan gátolta (5b. ábra). Ehhez hasonlóan az indukált sejtek IL-8 termelődését a kvercetin és az izoramnetin mellett a rutin kezelés is gátolta (6b. ábra). Az endotélsejtek normál körülmények között is termelnek mérhető mennyiségű MCP-1-et. Ezt a szintet az IL-1ß megnöveli, amit a megelőző kvercetin kezelés szignifikánsan gátol (7b. ábra).
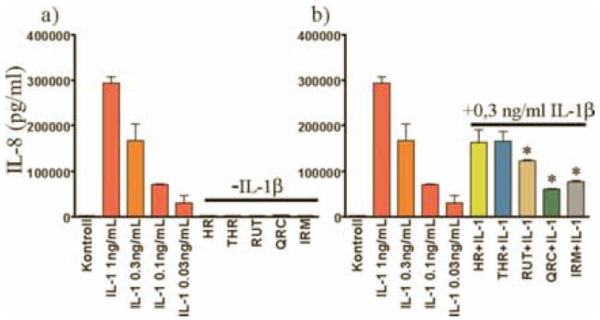
6. ábra:
A flavonoidok hatása az IL-8 termelődésére. Önmagukban a flavonoidok nem váltakan ki IL-8 választ (6/a) ábra). Az IL-8 termelődését az izoramnetin, a kvercetin és a rutin 50µM koncentrációja képes szignifikánsan gátolni a (6/b ábra).
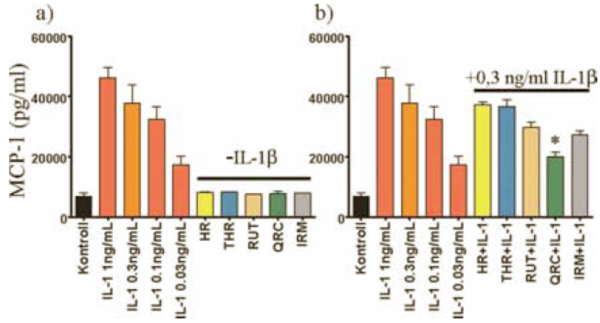
7. ábra:
A flavonoidok hatása az MCP-1 termelődésére. A flavonoidok nem indukálják az MCP-1 citokin termelődését (7/a ábra). A kvercetin szignifikánsan képes gátolni az IL-1ß indukálta MCP-1 választ (7/b ábra).
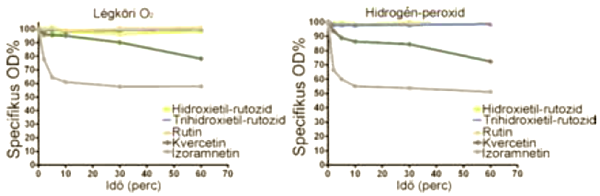
8. ábra:
A flavonoidok légköri oxigén hatására és H2O2 hozzáadása mellett történő oxidációja. A hidroxietil-rutozidok, a trihidroxietil-rutozid valamint a rutin semmiféle mérhető bomlást nem mutatott. A kvercetin és az izoramnetin esetében bomlás volt megfigyelhető, amely az eltelt idő függvényében egyre nagyobb mértékű. A bomlás a hozzáadott 10µM hidrogén-peroxid hatására még intenzívebb ennél a két vegyületnél, míg a hidroxietil-rutozidok, a trihidroxietil-rutozid és a rutin semmilyen bomlást nem mutatott.
Flavonoid oxidáció. A gyulladás folyamata együtt jár egy nagyon intenzív szabadgyök termelődéssel, amelynek a védelmi funkció mellett jelentős sejtkárosító hatása is van. A túlzott szabadgyök termelődés előidézője lehet egy krónikus gyulladásos állapot létrejöttének. Ezért azok a vegyületek, amelyek jó gyökfogó képességgel rendelkeznek, általában a gyulladási folyamatokra is mérséklő hatással vannak. A flavonoidok gyökfogó képességét már több tanulmány igazolta. Az is ismert, hogy a gyökfogó képesség és a flavonoidok molekulaszerkezete szoros összefüggésben van. Kísérleteinkben összehasonlítottuk az ötféle flavonoid oxidálhatóságát, mely összefügg a gyökfogó képességgel, valamint összefüggéseket kerestünk az oxidálható tulajdonság és a korábbi kísérletek eredményei között. Először megvizsgáltuk, hogy légköri oxigén hatására bomlanak-e a flavonoidok, majd a mérést megismételtük 10mM H2O2 jelenlétében is. Azt tapasztaltuk, hogy a kvercetin és az izoramnetin esetében bomlás figyelhető meg az egy órás inkubáció során, és ez a bomlási folyamat a hozzáadott H2O2 hatására fokozódik (8 a,b. ábra). Végül megnéztük, hogy a legstabilabbnak bizonyuló hidroxietil-rutozidok és a könnyen oxidálható kvercetin bomlása hogyan módosul 10; 1; 0,1 mM H2O2 és 1 mU/mL torma-peroxidáz jelenlétében (9.ábra). A hidroxietil-rutozidok még a legnagyobb koncentrációjú hidrogénperoxidos kezelés hatására sem mutattak jelentős bomlást, míg a kvercetin bomlása már a leghígabb kezelés hatására szinte teljesen végbement.
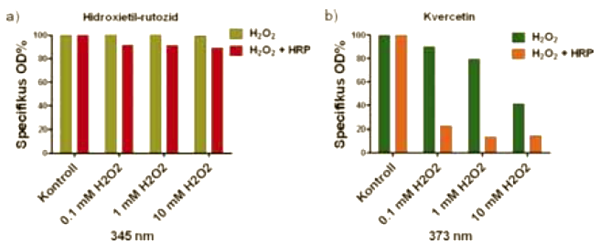
9. ábra:
A hidroxietil rutozidok és a kvercetin oxidációjának vizsgálata hidrogén-peroxid és torma-peroxidáz jelenlétében. A hidroxietil-rutozidokat és a kvercetint 90 percig 0,1; 1 illetve 10 mM H2O2-dal kezeltük (9/a, 9/b ábra). A hidroxietil-rutozidok esetében nem tapasztaltunk bomlást, míg a kvercetin a hozzáadott hidrogén-peroxid koncentrációjának függvényében bomlott. A kísérleteket megismételtük 1 mU/ml torma-peroxidáz jelenlétében is (9/a, 9/b ábra). Jelentős bomlást ez esetben sem mutattak a hidroxietil-rutozidok, viszont a kvercetin esetében a bomlást fokozza a hozzáadott peroxidáz enzim.
Megbeszélés
Kísérleteinkben összehasonlítottunk ötféle, köztük természetes és szintetikus flavonoidszármazékok gyulladáscsökkentő hatását in vitro tenyésztett endotélsejteken. Az elsőként elvégzett citotoxicitási tesztekből kiderült, hogy a flavonoidok a későbbi kísérletek során használt kezelési időnél jóval hosszabb időtartományban sem mutattak toxikus flavonoid közvetlen hatását az NFκB aktivációra egyáltalán nem vizsgálták. Az NFκB nukleáris transzlokációját a kvercetin képes gátolni, az endotélsejteken, ami összefügg azzal, hogy az irodalom szerint a kvercetin az NFκB természetes gátlószerét, az IκB-t (inhibitor of κB) stabilizálja, és ezáltal tovább tud inaktív állapotban maradni az NFκB. (10, 11) Fontos még azt is megjegyeznünk, hogy egyik flavonoid sem váltott ki önmagában NFκB nukleáris transzlokációt. Az endotélfunkciók javítására egy lehetőség, hogy a hibás proinflammatorikus citokin szekréciót célzottan gátoljuk. Több flavonoidról leírták, hogy képes csökkenteni a gyulladás által indukált (IL-1ß, TNFα, LPS, oxLDL, ROS) citokinek termelődését (12). Ezzel összhangban van, hogy az irodalom szerint, a citokin termelés gátlásában hatásosnak bizonyuló flavonoidok közül néhány képes gátolni az adhéziós molekulák kifejeződését is (pl. ICAM-1, VCAM-1 (13). A kvercetin proinflammatorikus citokinekre gyakorolt hatásáról található a legtöbb irodalmi adat, azonban endotélsejt modellen eddig nem vizsgálták, valamint a gátló mechanizmust sem írják le egyértelműen. Vitatják ugyanis, hogy mi számít a kvercetin elsődleges hatásnak, a gyökfogóképessége vagy valamelyik enzimre gyakorolt gátló hatása. Kísérleteinkben különbséget találtunk a flavonoidok proinflammatorikus citokinek termelődésére gyakorolt gátló hatásai között. Az IL-6, IL-8 és MCP-1 általunk vizsgált citokinek expressziójához az NFκB aktivációja szükséges. Azonban felmerül a kérdés, hogy milyen más mechanizmusokon keresztül képes gátolni az izoramnetin illetve a rutin az IL-6 illetve IL-8 szinteket, hiszen a korábbi kísérleteinkben csak a kvercetinnél tudtuk kimutatni az NFκB aktivációjának gátlását. Ennek az lehet a magyarázata, hogy ezen citokinek expresszióját más szignáltranszdukciós útvonalakon keresztül is be lehet indítani (pl. p38-MAPK, JNK-MAPK stb.), és feltehetően az izoramnetin és a rutin ezeknek a szignáltranszdukciós utaknak a gátlásán keresztül képesek csökkenti a citokin válasz mértékét. Mivel a kvercetin mind a három vizsgált citokin termelődését képes gátolni, feltételezhető, hogy hatását nem csak az NFκB aktivációjának gátlásán, hanem más utak gátlásán keresztül is, szinergista módon fejti ki. A kvercetin MCP-1-re gyakorolt hatásáról fontos megjegyezni, hogy az endotélsejtek által termelt alap MCP-1 szintet nem befolyásolja semmilyen irányba, tehát önmagában nincs immunszupresszív hatása sem, ami nagyon fontos paraméter egy esetleges gyógyszer jelölt molekula esetében. A citokinekkel kapott eredményeink alapján az is felmerül, hogy a különböző (akár természetes, táplálékban található, akár a gyógyszerként alkalmazott) flavonoidokkal szelektíven lehetne befolyásolni a gyulladásos válasz szignálútjait, és így a kimenetelét.
A szakirodalomban szinte minden értekezés kitér a flavonoidok reaktív szabadgyök elimináló képességének fontosságára, és arra, hogy szoros összefüggés van a flavonoidok molekulaszerkezete és az antioxidáns/szabadgyök fogó hatásuk között. Számos tanulmány született a flavonoidok oxidáz enzimek (xantin/xantin-oxidáz, NADPH-oxidáz) működését gátló hatásáról (14, 15), és a szabadgyökökkel történő reakciójukról is (16). Mivel a hidrogén-peroxid nagyon aktív szereplője a gyulladás folyamatának, - nemcsak az antimikrobás hatásán keresztül, hanem jelátviteli funkciókat is ellát (képes aktiválni az NFκB-t) - a mi kísérleteink ezért a flavonoidok hidrogén-peroxiddal történő reakcióinak megismerésére irányultak. A kvercetin és az izoramnetin képes reagálni a hidrogén-peroxidból származó reaktív szabadgyökökkel, míg az általunk vizsgált glikozilált flavonoid származékok nem. Ennek hátterében az eltérő molekulaszerkezet áll, és valószínűleg a glikozil csoport jelenléte akadályozza a szabadgyökkel történő reakciót, ami egyezik más munkacsoportok megfigyeléseivel (17). Azon túl, hogy egyik általunk vizsgált flavonoid sem mutatott toxikus hatást a vizsgálati körülmények között, önmagukban nincsenek hatással sem az NFκB transzlokációjára, sem a proinflammatorikus citokin szintre. IL-1ß gyulladásos indukciót alkalmazva azonban a kvercetin tűnik a leghatékonyabb gátlószernek, ugyanis az NFκB aktivációját is, valamint a proinflammatorikus citokin szintet is képes csökkenteni. Ugyanakkor a levegőn történő gyors oxidációja miatt felhasználhatósága korlátozott. A glikozilált formák (pl. a kvercetin esetében a rutin) stabilabbak, felszívódás közben deglikozilálódnak, és az ilyen módon a keringésbe jutó aglikon formák a szervezet számára jobb gyökfogó képességgel rendelkezhetnek. Ezzel összefügg, hogy a gyógyászatban alkalmazott hidroxieitl-rutozidoknak semmilyen gyulladáscsökkentő hatást nem tudtunk bizonyítani az in vitro kísérletekben, azonban a bizonyított érvédő hatásukért feltehetően az aglikon formák felelősek leginkább. Ezt a kereskedelmi forgalomban nem kapható, ezért nehezen hozzáférhető hidroxietil-kvercetinnel végzett előzetes kísérleteink is bizonyítják (nem bemutatott ábra). A flavonoidok gyulladáscsökkentő hatásának pontosabb megismerése és az egyes hatásokért felelős molekularészletek, funkciós csoportok felfedezése nagyban hozzájárulhat a keringési betegségek kapcsán felmerülő hibás endotélsejt működés gyógyszeres kezeléséhez.
Irodalom
- Wu, K. K., and P. Thiagarajan. 1996. Role of endothelium in thrombosis and hemostasis. Annu Rev Med 47:315-331.
- Kofler, S., T. Nickel, and M. Weis. 2005. Role of cytokines in cardiovascular diseases: a focus on endothelial responses to inflammation. Clin Sci (Lond) 108:205-213.
- Greig, D., P. Castro, L. Gabrielli, R. Miranda, H. Verdejo, H. Alcaino, C. Bustos, M. Chiong, I. Godoy, R. Mellado, L. Garcia, D. Salas, R. Vivar, J. L. Vukasovic, R. Concepcion, and G. Diaz-Araya. 2008. [Inflammation and endothelial dysfunction in patients with chronic heart failure]. Rev Med Chil 136:687-693.
- Aukrust, P., B. Halvorsen, A. Yndestad, T. Ueland, E. Oie, K. Otterdal, L. Gullestad, and J. K. Damas. 2008. Chemokines and cardiovascular risk. Arterioscler Thromb Vasc Biol 28:1909-1919.
- Rusznyák S, Szent-Györgyi A. 1936. Vitamin nature of flavones. Nature 138:798.
- Hertog, M. G., and P. C. Hollman. 1996. Potential health effects of the dietary flavonol quercetin. Eur J Clin Nutr 50:63-71.
- J.-L. Kienzler, D. S., M.-H. Schifflers, A. Ghika. 2002. Pharmacokinetics of mono-3'- and mono-4'-0- (betha-hydroxyethyl)-rutoside derivatives, after single doses of Venoruton powder in healthy volunteers. Eur J ClinPharmacol 58:395–402.
- Kiszel, P., V. Mako, Z. Prohaszka, and L. Cervenak. 2007. Interleukin-6 -174 promoter polymorphism does not influence IL-6 production after LPS and IL-1 beta stimulation in human umbilical cord vein endothelial cells. Cytokine 40:17-22.
- Bischoff, S. C. 2008. Quercetin: potentials in the prevention and therapy of disease. Curr Opin Clin Nutr Metab Care 11:733-740.
- Martinez-Florez, S., B. Gutierrez-Fernandez, S. Sanchez-Campos, J. Gonzalez-Gallego, and M. J. Tunon. 2005. Quercetin attenuates nuclear factor-kappaB activation and nitric oxide production in interleukin-1beta-activated rat hepatocytes. J Nutr 135:1359-1365.
- Ying, B., T. Yang, X. Song, X. Hu, H. Fan, X. Lu, L. Chen, D. Cheng, T. Wang, D. Liu, D. Xu, Y. Wei, and F. Wen. 2009. Quercetin inhibits IL-1 beta-induced ICAM-1 expression in pulmonary epithelial cell line A549 through the MAPK pathways. Mol Biol Rep 36:1825-1832.
- Tang, F. Y., and M. Meydani. 2001. Green tea catechins and vitamin E inhibit angiogenesis of human microvascular endothelial cells through suppression of IL-8 production. Nutr Cancer 41:119-125.
- Tribolo, S., F. Lodi, C. Connor, S. Suri, V. G. Wilson, M. A. Taylor, P. W. Needs, P. A. Kroon, and D. A. Hughes. 2008. Comparative effects of quercetin and its predominant human metabolites on adhesion molecule expression in activated human vascular endothelial cells. Atherosclerosis 197:50-56.
- Qin, C. X., X. Chen, R. A. Hughes, S. J. Williams, and O. L.Woodman. 2008. Understanding the cardioprotective effects of flavonols: discovery of relaxant flavonols without antioxidant activity. J Med Chem 51:1874- 1884.
- Schewe, T., Y. Steffen, and H. Sies. 2008. How do dietary flavanols improve vascular function? A position paper. Arch Biochem Biophys 476:102-106.
- Mandal, S., B. Hazra, R. Sarkar, S. Biswas, and N. Mandal. 2009. Assessment of the Antioxidant and Reactive Oxygen Species Scavenging Activity of Methanolic Extract of Caesalpinia crista Leaf. Evid Based Complement Alternat Med.
- Formica, J. V., and W. Regelson. 1995. Review of the biology of Quercetin and related bioflavonoids. Food Chem Toxicol 33:1061-1080.
- Iacopini, P., M. Baldi, P. Storchi, and L. Sebastiani. 2008. Catechin, epicatechin, quercetin, rutin and resveratrol in red grape: Content, in vitro antioxidant activity and interactions. J Food Compos Anal 21:589-598.
- Scalbert, A., and G. Williamson. 2000. Dietary intake and bioavailability of polyphenols. J Nutr 130:2073S- 2085S.
Jani Péter Károly
MTA-Semmelweis Egyetem,
Gyulladásbiológiai és Immungenomikai Kutatócsoport
Érbetegségek: 2011/4. - 87-95. oldal